
- DAZ.online
- DAZ / AZ
- DAZ 34/2017
- Wenn es den Nerven an den...
Autoimmunerkrankungen
Wenn es den Nerven an den Kragen geht
Bei Multipler Sklerose steht die Abwehr der Immunsystemattacken im Fokus
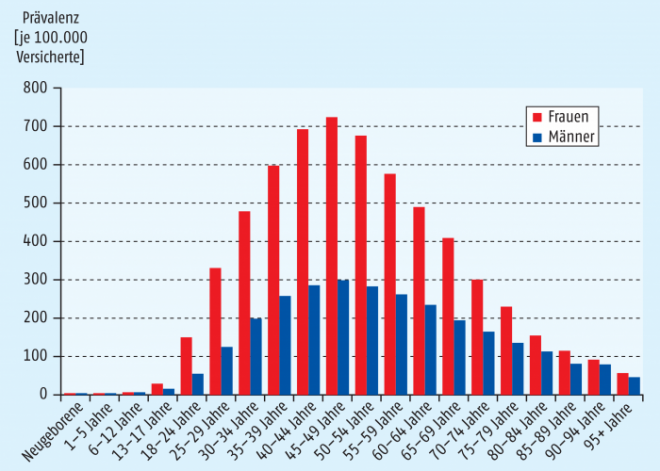
Üblicherweise treten die ersten Symptome im Alter zwischen 20 und 40 auf, und oft dauert es Jahre, bis von den ersten leichten Sehstörungen, der Gangunsicherheit oder der starken Müdigkeit tatsächlich die sichere Diagnose gestellt wird, dass es sich um Multiple Sklerose handelt. Weltweit geht man von mehr als 2,5 Millionen Patienten aus, die unter der Erkrankung leiden, in Deutschland sind es ca. 200.000, wobei deutlich mehr Frauen als Männer betroffen sind (Abb. 1).
Ein Anfang mit vielen Gesichtern
Dass die ersten Symptome sehr unterschiedlich sein können, liegt in der Natur der Krankheit: Per Definition handelt es sich bei der Multiplen Sklerose um eine chronisch-entzündliche Erkrankung des zentralen Nervensystems, die mit einer Zerstörung der schützenden Myelin-Umhüllungen der Nerven einhergeht. Durch diese Demyelinisierung wird die Signalweiterleitung durch die Nervenzellen gestört. Je nachdem, in welchem Hirnareal dieser Entzündungsprozess beginnt und wie gut unser zentrales Nervensystem die ersten Ausfälle kompensieren kann, ist die Anfangssymptomatik völlig unterschiedlich. Dieses anfänglich auftretende, sogenannte klinisch isolierte Syndrom (KIS) geht bei ca. 85% der Patienten in die schubförmige Verlaufsform der Multiplen Sklerose (RRMS, relapsing remitting MS) über. Als Schub wird dabei definiert, dass ein neues neurologisches Defizit auftritt, das durch eine frische entzündliche Läsion im Zentralnervensystem verursacht wird. Die klinischen Ausfälle und Symptome müssen mindestens 24 Stunden anhalten, in einem zeitlichen Abstand von mehr als 30 Tagen zum Beginn des vorausgegangenen Schubs auftreten und nicht durch Änderungen der Körpertemperatur oder durch eine Infektionserkrankung ausgelöst werden. Oft bilden sich die Symptome eines Schubs wieder vollständig zurück. Auf Dauer können jedoch zunehmend Behinderungen bleiben. Dann ist die Multiple Sklerose in die sekundär progrediente Verlaufsform (SPMS, secondary progressive MS) übergegangen, bei der zusätzlich noch weiterhin Schübe auftreten können. Ohne Therapie kommt es bei mindestens 50% der Patienten mit einer schubförmigen Verlaufsform nach durchschnittlich zehn Jahren zu einer Veränderung in die sekundär progrediente Form.
Mit nur ca. 10% der Patienten deutlich seltener ist die primär progrediente Multiple Sklerose (PPMS, primary progressive MS), bei der es von Anfang an zu einer kontinuierlichen Verschlechterung kommt, ohne dass Krankheitsschübe auftreten. Interessanterweise sind bei dieser Krankheitsform Männer ungefähr ebenso häufig betroffen wie Frauen und die Symptome beginnen meist erst in der vierten oder fünften Lebensdekade – also später als die schubförmige Verlaufsform. Ein zur Therapie der PPMS zugelassenes Arzneimittel gibt es in Deutschland noch nicht. Für das schon in den USA zugelassene Ocrelizumab ist jedoch die EU-Zulassung beantragt.
Auslöser und Ergebnis
Warum so viele Menschen an Multipler Sklerose erkranken, ist nach wie vor nicht komplett aufgeklärt. Wie bei anderen Autoimmunerkrankungen auch, trägt eine Kombination aus genetischen Ausstattungen und Umweltfaktoren entscheidend zur Krankheit bei. Unter den genetischen Faktoren hat sich eine Gen-Variante des MHC-II, HLA-DRB1*15:01, als hochriskant hervorgetan. Die MHC-II-Moleküle präsentieren CD4+-T-Zellen bestimmte Peptid-Antigene und können darüber eventuell eine T-Zell-Antwort z. B. gegen die Myelin-Scheide der Nerven stimulieren und die Demyelinisierung initiieren.
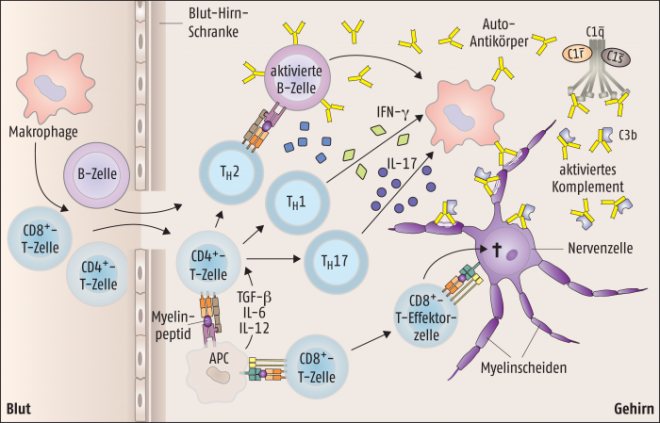
Zu den Umweltfaktoren, die mit starker Evidenz an der Auslösung einer Multiplen Sklerose beteiligt sind, gehören Vitamin-D-Mangel, Rauchen und Virusinfektionen, hier vor allem Infektionen mit Epstein-Barr-Virus (EBV), humanem Herpes-Virus 6 (HHV-6), Herpes-zoster-Virus (HZV) oder John-Cunningham-Virus (JCV). Die Gemeinsamkeit dieser Viren ist, in Neuronen zu persistieren, weshalb sie auch im Gehirn durch das Immunsystem bekämpft werden müssen. Ob anschließend molekulare Mimikry, also die Ähnlichkeit von viralen Oberflächenproteinen mit Bestandteilen der Myelin-Scheide, oder aber Fehlleistungen der Immunzellen zur Etablierung einer Multiplen Sklerose führen, kann im Einzelfall nicht genau nachvollzogen werden. Sicher ist, dass schließlich sowohl Th1- als auch Th17-Zellen, aber auch zytotoxische T-Zellen sowie in gewissem Umfang B-Zellen, am Entzündungsgeschehen im Gehirn beteiligt sind und zum Abbau der Myelin-Scheide der Neuronen führen (Abb. 2). Diese Zellen müssen allerdings zunächst aus der Peripherie kommend die Blut-Hirn-Schranke passieren, bevor sie im Gehirn, dem immunprivilegierten Organ, aktiv werden können. An dieser Stelle findet sich eine Erklärungsmöglichkeit, weshalb Frauen wesentlich häufiger von einer Multiplen Sklerose betroffen sind als Männer: Ein wichtiges Molekül, das die Barrierefunktion des Endothels im Gehirn steuert, ist der Sphingosin-1-phosphat-Rezeptor 2, der bei Frauen stärker exprimiert wird, als bei Männern. Dieser Rezeptor destabilisiert die Adhärenz-Verbindungen in der Blut-Hirn-Schranke und erleichtert darüber die Einwanderung von Immunzellen ins Gehirn, wo sie dann die Nervenzellen attackieren können.
Therapie des akuten Schubes
Auf dem Gebiet der Immuntherapeutika hat sich in den letzten Jahren enorm viel getan, was auch die Therapie der Multiplen Sklerose maßgeblich beeinflusst hat. Die aktuell gültige Leitlinie zur Diagnose und Therapie der Multiplen Sklerose wurde im August 2014 ergänzt und ist mindestens noch bis 29. September 2017 relevant (Tab. 1). Aufgrund der neuen Wirkstoffe und Studien wird allerdings an einer kompletten Neufassung gearbeitet.
Indikation |
klinisch isoliertes Syndrom (KIS)1
|
schubförmig verlaufende MS (RRMS)1
|
sekundär progredient verlaufende MS (SPMS)1
|
||||
|---|---|---|---|---|---|---|---|
verlaufsmodifizierende Therapie |
(hoch-)aktiveVerlaufsform |
1. Wahl Alemtuzumab
|
2. Wahl Mitoxantron
(– Cyclophosphamid)3
|
3. Wahl experimentelle Verfahren |
mit aufgesetzten Schüben |
ohne aufgesetzte Schübe |
|
milde/moderateVerlaufsform |
|
(– Azathioprin)2
(– i. v. Immunglobuline)3
|
(– Cyclophosphamid)4
|
(– Cyclophosphamid)4
|
|||
Schub-Therapie |
2. Wahl |
|
|||||
1. Wahl |
|
||||||
Bei Versagen einer verlaufsmodifizierenden Therapie bei milder/moderater Verlaufsform einer MS werden diese Patienten wie eine aktive MS behandelt. 1 Substanzen in alphabetischer Reihenfolge, die hier gewählte Darstellung impliziert keine Überlegenheit einer Substanz innerhalb einer Indikationsgruppe 2 zugelassen, wenn Interferon-β nicht möglich oder unter Azathioprin-Therapie stabiler Verlauf erreicht 3 Einsatz nur postpartal im Einzelfall gerechtfertigt, insbesondere vor dem Hintergrund fehlender Behandlungsalternativen 4 zugelassen für bedrohlich verlaufende Autoimmunkrankheiten, somit nur für fulminante Fälle als Ausweichtherapie vorzusehen, idealerweise nur an ausgewiesenen MS-Zentren | |||||||
Nach wie vor wird bei einem akuten Schub die möglichst zeitnah beginnende Therapie mit einer intravenösen Gabe einer hohen Glucocorticosteroid-Dosis empfohlen. Das heißt, nach Ausschluss eventueller Komorbiditäten und Kontraindikationen – vor allem akute Infektionen – wird dem Patienten über drei bis fünf Tage morgens während einer 30- bis 60-minütigen Kurzinfusion 1000 mg (in Einzelfällen: 500 mg) Methylprednisolon i. v. verabreicht. Die Hochdosis-Therapie sollte anschließend ausschleichend abgesetzt werden. Das wird über zehn bis maximal 14 Tage erreicht, indem oral Methylprednisolon verabreicht wird; beginnend mit 100 mg Methylprednisolon kann an jedem zweiten Tag eine Dosis-Reduktion um 20 mg stattfinden. Wird Methylprednisolon nicht vertragen, kann auch eine Therapie mit Dexamethason, Prednison oder Prednisolon erfolgen. Durch die Glucocorticosteroid-Therapie sollen unter anderem die Migration der Immunzellen gehemmt und die Expression proinflammatorischer Zytokine wie Interleukin 2 (IL-2), Interferon γ (IFN-γ) und Tumornekrosefaktor α (TNF-α) inhibiert werden. Bestehen die Schubsymptome auch noch zwei Wochen nach der Therapie, sollte eine zweite Hochdosis-Gabe über fünf Tage erfolgen – in Abhängigkeit von der Schwere der Symptome eventuell sogar eine Ultra-Hochdosis von 2000 mg Methylprednisolon i. v. über fünf Tage. Nur als Mittel der zweiten Wahl sollte bei besonders schweren Schüben eine Plasmapherese bzw. Immunadsorption in Erwägung gezogen werden.
Langzeittherapie der Multiplen Sklerose
Abgesehen von der Therapie der akuten Schübe ist ein wesentlicher Ansatz bei der Behandlung der Patienten mit Multipler Sklerose, möglichst die Progression der Erkrankung zu verhindern. Das bedeutet letztlich, die Aktivität des Immunsystems so zu modulieren, dass die Entzündungen möglichst nicht weiter fortschreiten. Idealerweise sollte das bereits bei Patienten mit klinisch isoliertem Syndrom beginnen, damit sich daraus weniger schnell bzw. keine schubförmige Verlaufsform entwickeln kann.
Das Stufenschema der Leitlinie sieht zur Therapie des klinisch isolierten Syndroms die Wirkstoffe Glatirameracetat und die Beta-Interferone als gleichwertig an. Diese Wirkstoffe sind auch zur Langzeittherapie milder Verlaufsformen der RRMS empfohlen. Die Beta-Interferone sind zum Teil bereits seit 20 Jahren zugelassen und gehören somit zu den alten immunmodulierenden Wirkstoffen (Tab. 2). Man geht davon aus, dass sie relativ allgemein proinflammatorische Ereignisse modulieren, indem sie z. B. die Expression von Zytokinen oder Adhäsionsmolekülen beeinflussen oder die Th17-vermittelten Entzündungsreaktionen inhibieren. Für die Anwendung beim klinisch isolierten Syndrom und bei leicht verlaufender schubförmige MS stehen verschiedene Präparate zur Verfügung, die unterschiedlich häufig, meist subkutan, verabreicht werden müssen. Eine Ausnahme hinsichtlich der Indikation stellt das Peginterferon beta 1a (Plegridy®) dar, das nur für die schubförmige Verlaufsform der Multiplen Sklerose zugelassen ist, nicht aber für das klinisch isolierte Syndrom.
Wirkstoff |
Präparat
(Beispiele)
|
Dosis |
Applikationshäufigkeit |
Applikations-route |
DDD-Nettokosten [Euro] |
|---|---|---|---|---|---|
Interferon-beta 1a |
Avonex®
|
30 μg |
einmal wöchentlich |
i. m. |
55,46 |
Interferon-beta 1a |
Rebif®
|
22 μg bzw. 44 μg |
dreimal wöchentlich |
s. c. |
69,29 |
Interferon-beta 1b |
Betaferon®
Extavia®
|
250 μg |
jeden zweiten Tag |
s. c. |
50,25
44,09
|
Peginterferon-beta 1a |
Plegridy®
|
125 μg |
zweimal monatlich |
s. c. |
61,54 |
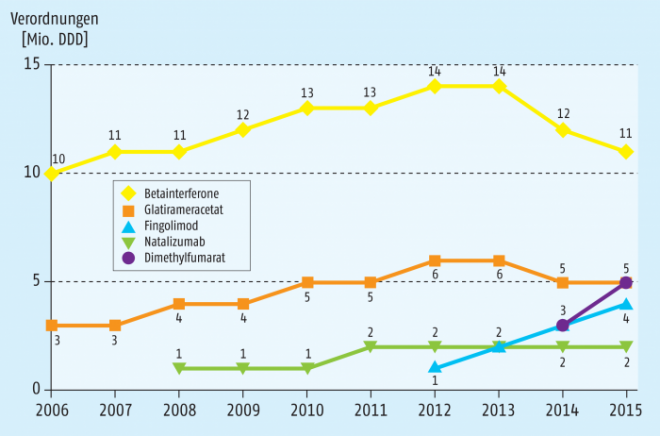
Ebenfalls eher allgemein immunmodulierend scheint Glatirameracetat (Copaxone®) zu wirken. Die genaueren Mechanismen, wie die Mischung synthetischer Polypeptide aus nur vier verschiedenen Aminosäuren die Pathophysiologie der Multiplen Sklerose beeinflussen, sind nicht genau geklärt. Es kommt infolge der Anwendung des Peptidgemisches zu einer gesteigerten Aktivierung von Th2-Zellen gegenüber Th1-Zellen, wodurch auch verstärkt antientzündliche Zytokine wie IL-4 und IL-10 ausgeschüttet werden. Außerdem sind vermehrt regulatorische T-Zellen vor Ort zu finden, die ebenfalls die Entzündungsreaktion unterdrücken. Auch Glatirameracetat wird parenteral appliziert und mit 20 mg einmal täglich oder 40 mg dreimal pro Woche subkutan injiziert (Tab. 3). Mit Clift® der Firma Mylan dura GmbH wurde in der EU kürzlich ein Nachahmerpräparat zugelassen. Als sogenanntes non-biological complex drug (NBCD) erfolgte die Zulassung unter Beachtung der Vorschriften für Generika und für Biosimilars. Da sich die Wirkstoffgemische der Referenzarznei und des Nachahmerprodukts unmöglich exakt vergleichen lassen, erfolgte die Zulassung letztlich auf Basis einer vergleichsweise großen klinischen Studie, die tatsächlich eine Nichtunterlegenheit des Nachahmerprodukts im Vergleich zur Referenzarznei belegte. Schaut man sich die Marktentwicklung der verschiedenen Präparate an, gehen sowohl für Beta-Interferone als auch für Glatirameracetat in letzter Zeit die Verordnungszahlen etwas zurück, wobei 2015 immer noch zwölf Millionen DDD (defined daily dose) aller Beta-Interferone und 5,2 Millionen DDD Glatirameracetat verordnet wurden (Abb. 3).
Deutlich gestiegen sind hingegen in den letzten Jahren die Verordnungszahlen für Dimethylfumarat und Teriflunomid, die für die Langzeittherapie milder Formen der schubförmig verlaufenden Multiplen Sklerose angewendet werden können. Durch die einfacheren, oral verfügbaren Arzneiformen kommen diese Wirkstoffe der Patienten-Compliance entgegen, müssen allerdings (mehrmals) täglich eingenommen werden (Tab. 3). Für beide Substanzen ist der genaue Wirkmechanismus nicht bekannt. Da Teriflunomid selektiv und reversibel das Enzym Dihydroorotat-Dehydrogenase (DHODH) in den Mitochondrien hemmt, verhindert es die De-novo-Synthese von Pyrimidin auch in aktivierten, für die Pathogenese der Multiplen Sklerose relevanten, autoreaktiven Lymphozyten. Von Dimethylfumarat ist bekannt, dass es den Nuclear factor(erythyroid-derived 2)-like-2(Nrf2)-Transkriptionsweg aktiviert, der wiederum Zellen vor potenziell schädlichen Einflüssen wie oxidativem Stress schützt. Im Tiermodell konnte gezeigt werden, dass sich geschädigte Nervenzellen in Anwesenheit von Dimethylfumarat sogar regenerieren können.
Wirkstoff |
Präparat
(Beispiele)
|
Dosis |
Applikationshäufigkeit |
Applikations-route |
DDD-Nettokosten [Euro] |
|---|---|---|---|---|---|
Glatirameracetat |
Copaxone®
|
20 mg
40 mg
|
einmal täglich
dreimal wöchentlich
|
s. c. |
48,00 |
Glatirameracetat |
Clift®
|
20 mg |
einmal täglich |
s. c. |
ca. 37,79 |
Dimethylfumarat |
Tecfidera®
|
240 mg (langsam aufdosieren) |
zweimal täglich |
oral |
55,11 |
Teriflunomid |
Aubagio®
|
14 mg |
einmal täglich |
oral |
39,56 |
Fingolimod |
Gilenya®
|
0,5 mg |
einmal täglich |
oral |
58,50 |
Natalizumab |
Tysabri®
|
300 mg |
einmal alle vier Wochen |
i. v. |
69,65 |
Alemtuzumab |
Lemtrada®
|
12 mg |
einmal jährlich: fünf Tage lang einmal täglich (drei Tage lang einmal täglich im zweiten Jahr) |
i. v. |
Bei schweren Verlaufsformen der RRMS werden in der Leitlinie als Mittel der ersten Wahl bisher Alemtuzumab, Fingolimod und Natalizumab empfohlen, mit denen sehr gezielt Lymphozyten angesteuert werden. Fingolimod wirkt dabei als funktioneller Antagonist an S1P1-Rezeptoren und verhindert das Auswandern von Lymphozyten aus den Lymphknoten in das ZNS und dadurch die Aufrechterhaltung der Entzündungsreaktion. Einen ähnlichen Effekt, allerdings über einen anderen Angriffspunkt, hat Natalizumab. Dieser humanisierte Antikörper bindet an Oberflächenmoleküle auf Leukozyten, die für die Transmigration der Zellen über die Gefäßendothelien ins Gehirn wichtig sind. Demgegenüber führt die Verabreichung des Antikörpers Alemtuzumab, der gegen das Oberflächenmolekül CD52 gerichtet ist, zu einer gleichzeitigen Depletion der zirkulierenden T- und B-Zellen, weshalb der Wirkstoff ursprünglich in Form des Arzneimittels MabCampath® für die Therapie der chronisch lymphatischen Leukämie zugelassen war. Anhand der Pathogenese der Multiplen Sklerose lag es allerdings nahe, den Antikörper auch für diese Indikation zu testen. Die klinischen Studien CARE-MS I und II verliefen erfolgreich, was den Hersteller zu einer sehr umstrittenen Konsequenz veranlasste. Statt die Zulassung um die Indikation „Multiple Sklerose“ zu erweitern, zog der Hersteller die Marktzulassung des Antikörpers für die Anwendung bei chronisch lymphatischer Leukämie 2012 freiwillig zurück und brachte den Wirkstoff stattdessen im Herbst 2013 in Form des Arzneimittels Lemtrada® für die Indikation Multiple Sklerose auf den Markt. Das Dosierungsschema für Alemtuzumab umfasst zwei Behandlungsphasen: In der ersten Phase wird der Wirkstoff an fünf aufeinander folgenden Tagen als intravenöse Infusion verabreicht (12 mg pro Tag). In der zweiten Phase, zwölf Monate später, an drei aufeinander folgenden Tagen in gleicher Dosierung (Tab. 3). Die Hoffnung ist, dass danach weitere Behandlungen nicht oder erst später wieder notwendig werden. Eine Verlängerungsstudie zu CARE-MS II hatte gezeigt, dass mit Alemtuzumab behandelte Patienten mit hochaktiver schubförmig verlaufender Multipler Sklerose bis zu vier Jahre frei von neuen aktiven Läsionen bleiben. Allerdings ist wegen der bestehenden Gefahr von Nebenwirkungen ein umfangreiches Monitoring sehr wichtig.
T- bzw. B-Zellen werden auch von den beiden Antikörpern Daclizumab (Zinbryta®) und Rituximab (MabThera®) adressiert, die als Eskalationstherapie bei schwerer schubförmig verlaufender Multipler Sklerose eingesetzt werden können. Daclizumab bindet an die α-Untereinheit (CD25) des IL-2-Rezeptors auf T-Zellen und verhindert die Proliferation aktivierter T-Zellen und war zwischen 1999 und 2009 unter dem Handelsnamen Zenapax® für die Indikation „Prävention einer akuten Abstoßungsreaktion nach Nierentransplantation“ auf dem europäischen Markt zugelassen. Seit Sommer 2016 ist der humanisierte Antikörper für die Therapie der schubförmigen Multiplen Sklerose zugelassen. Nach dem Tod einer Patientin infolge einer fulminanten Leberinsuffizienz sind Leberfunktionsstörung und eine vorbestehende Lebererkrankung Kontraindikationen für die Therapie mit Zinbryta®. Alle Patienten, die den Antikörper erhalten, müssen auf Anzeichen und Symptome einer Leberschädigung überwacht werden. Rituximab ist (noch) nicht für die Therapie der Multiplen Sklerose zugelassen, wird aber relativ oft off label in einer Dosierung von 1000 mg i. v. an Tag 1 und 15 oder von vierwöchentlich 375 mg/m2 i. v. alle sechs bis zwölf Monate eingesetzt. Der chimärisierte Antikörper bindet an CD20 auf B-Zellen und führt zu deren Depletion, was zu einer mehr oder weniger starken Immunsuppression und vermehrt auftretenden Infektionen führen kann. Deshalb sollten auch die mit Rituximab behandelten MS-Patienten während der Therapie engmaschig überwacht werden.
Als Mittel der zweiten Wahl bei schwerer schubförmig verlaufender Multipler Sklerose, aber auch bei sekundär progredienter Form, wird das Zytostatikum Mitoxantron angewendet. Dieser Wirkstoff interkaliert in die DNA und verhindert die Bildung von RNA sowie die Aktivität der Topoisomerase II. Außerdem verursacht er Quervernetzungen und Strangbrüche in der DNA. Dadurch wirkt Mitoxantron relativ unspezifisch auf sich teilende und ruhende Zellen und reduziert die Proliferation von T- und B-Zellen. Mitoxantron wird als Infusion mit 12 mg/m2 Körperoberfläche alle drei Monate streng intravenös verabreicht, wobei die Dosis bei wiederholter Gabe je nach Ausmaß der Knochenmarksuppression angepasst werden sollte. Die maximal über die Lebenszeit zulässige kumulative Gesamtdosis Mitoxantron von 140 mg/m2 Körperoberfläche darf nicht überschritten werden.
Immunmodulation versus Immunsuppression
Dass die Therapie der Multiplen Sklerose von immunmodulierenden Wirkstoffen dominiert wird, ist aufgrund der Pathogenese sehr gut nachvollziehbar. Je nach Schwere der Erkrankung reicht das Wirkprinzip von Verschiebungen des Zytokin-Spektrums und der Anteile der (T-)Zell-Subtypen bis hin zu einer massiven Immunsuppression. Inwieweit dabei die Wirkstoffe selbst ins ZNS gelangen müssen oder ob es bereits ausreicht, in der Peripherie das Zytokin-Muster und die Lymphozyten-Verteilung zu ändern, sei dahingestellt. Sicher ist, dass die Blut-Hirn-Schranke bei MS-Patienten durchlässiger ist, als bei Gesunden. Ob dadurch jedoch z. B. Interferone ins ZNS eindringen können, ist trotzdem fraglich. Dass Immunzellen auch bei Gesunden ins Gehirn gelangen, ist sicher – schließlich müssen sie dort patrouillieren, dass sich keine Virusinfektion im Nervengewebe manifestieren kann. Dies gelingt sehr gut, wie man daran sieht, dass zwar geschätzt 85% der Erwachsenen weltweit Antikörper gegen das JC-Virus haben, was auf eine durchgemachte Infektion hindeutet, jedoch nur diejenigen an einer progressiven multifokalen Leukenzephalopathie erkranken, bei denen das Immunsystem gezielt beeinträchtigt wird. Diese Leukenzephalopathie ist eine gefürchtete Komplikation bei der Therapie mit Natalizumab. Durch die therapeutisch gewünschte Unterdrückung der Lymphozyten-Einwanderung wird nicht nur der Entzündungsprozess der Multiplen Sklerose gehemmt, sondern es kann auch zu einer Reaktivierung der in den Nervenzellen schlummernden Viren kommen. Und auch sonst kann jegliche Modulation des fein aufeinander abgestimmten Immunsystems zu einer veränderten Reaktivität gegenüber verschiedenen Pathogenen führen. Nicht zuletzt deshalb muss vor Therapiebeginn bei vielen der bereits genannten Wirkstoffe auch der Immunstatus z. B. gegen Tuberkulose oder Hepatitis-B- und -C-Viren geprüft werden.
Zukünftige Therapien?
Für die Therapie der Multiplen Sklerose befinden sich sehr viele Wirkstoffe in der Pipeline, allein zehn sind in klinischen Phase-III-Studien oder sogar bereits im Zulassungsverfahren (Tab. 4). Etliche dieser Substanzen lehnen sich an bereits zugelassene Wirkstoffe an, wie z. B. die beiden CD20-Antikörper Ocrelizumab und Ofatumumab oder die S1P-Rezeptor-Modulatoren. Potenzielle neue Arzneimittel, die in einem noch früheren Stadium der Entwicklung sind, adressieren zum Teil ebenfalls B- und T-Zellen als wichtige Zielstrukturen des Pathogenesemechanismus. So bindet beispielsweise der humanisierte monoklonale Antikörper MEDI-551 an CD19 und führt zu einer umfassenderen Depletion von B-Zellen, inklusive Plasmablasten und Plasmazellen. Demgegenüber scheiterte das Fusionsprotein Atacicept, das die Aktivierung von B-Zellen über BAFF (B-Cell activating Factor of the TNF Family) und APRIL (A Proliferation-Inducing Ligand) hemmt, in ersten klinischen Studien als potenzielles Therapeutikum gegen Multiple Sklerose.
Wirkstoff; Einnahmeform |
Wirkungsweise |
Stand des Projekts |
|---|---|---|
Ocrelizumab; zur Injektion |
humanisierter Antikörper gegen CD20, führt zur Depletion von B-Zellen |
im Zulassungsverfahren in der EU gegen schubförmige und primär-progrediente MS |
Cladribin; oral applizierbar |
Nukleosidanalogon, das in sich teilenden und ruhenden Zellen in DNA und RNA eingebaut wird; führt zur Reduktion der Leukozytenzahl |
im Zulassungsverfahren in der EU |
Ofatumumab; zur Injektion |
humanisierter Antikörper gegen CD20, führt zur Depletion von B-Zellen |
in klinischer Erprobung, Phase III |
Immunoglobulin Octagam; zur Injektion |
intravenös applizierte Immunglobulin-Präparate zur Immunmodifikation |
in klinischer Erprobung, Phase III |
Masitinib; oral applizierbar |
selektiver Tyrosinkinase-Inhibitor, moduliert Migration, Überleben und Degranulation von Mastzellen |
in klinischer Erprobung gegen progrediente MS, Phase III |
Ponesimod; oral applizierbar |
selektiver S1P1-Rezeptor-Modulator, verhindert Freisetzung von T- und B-Lymphozyten aus den Lymphknoten |
in klinischer Erprobung, Phase III |
Siponimod (BAF-312); oral applizierbar |
selektiver S1P1- und S1P5-Rezeptor-Modulator, verhindert Freisetzung von T- und B-Lymphozyten aus den Lymphknoten |
in klinischer Erprobung gegen sekundär-progrediente MS, Phase III |
Ozanimod; oral applizierbar |
selektiver S1P1- und S1P5-Rezeptor-Modulator, verhindert Freisetzung von T- und B-Lymphozyten aus den Lymphknoten |
in klinischer Erprobung, Phase III |
Monomethylfumarat-Prodrug |
Aktivierung des Nuclear factor(erythyroid-derived 2)-like 2 (Nrf2)-Transkriptionswegs |
in klinischer Erprobung, Phase III |
MD-1003 (D-Biotin) |
hochdosiertes Vitamin, als prosthetische Gruppe von Enzymen |
in klinischer Erprobung gegen primär-progrediente MS, Phase III |
Wesentlich unterschiedlichere Therapieansätze zielen in Richtung der T-Zellen. Neben der Blockade stimulierender und proinflammatorischer Signalwege über CTLA-4, IL-7, IL-17, wird auch versucht, gezielt regulatorische T-Zellen zu mobilisieren. Intensiv wird zudem daran geforscht, die Toleranz der T-Zellen gegen das Myelin-basische Protein zu steigern, beispielsweise über spezielle Peptide, die den Patienten verabreicht werden, oder aber über eine Verabreichung autologer, attenuierter, Antigen-spezifischer T-Zellen. Vor allem für die Therapie der progredienten MS-Formen besteht noch ein erheblicher Bedarf an neuen Wirkstoffen, und hier ist ein Wechsel hin zu sehr ungewöhnlichen Strategien zu beobachten. Neben Tyrosinkinase-Inhibitoren oder Hochdosis-Biotin werden beispielsweise auch Erythropoetin, adrenocorticotropes Hormon oder ein Antikörper gegen den Inhibitor der Axon-Myelinisierung LINGO-1 (Leucine-rich repeat and immunoglobulin-like domain containing neurite outgrowth inhibitor receptor–interacting protein-1) getestet. Ein großes Problem der MS-Forschung ist das Fehlen der richtigen Tiermodelle – vielleicht wäre das Therapieangebot dann sogar noch viel größer. |
Literatur
Bittner S, Ruck T, Wiendl H et al. Targeting B cells in relapsing–remitting multiple sclerosis: from pathophysiology to optimal clinical management. Ther Adv Neurol Disord 2017;10:51-66
Bittner S, Wiendl H. Neuroimmunotherapies Targeting T Cells: From Pathophysiology to Therapeutic Applications. Neurotherapeutics 2016;13:4-19
Cohen J, Belova A, Selmaj K et al. Equivalence of Generic Glatiramer
Acetate in Multiple Sclerosis – A Randomized Clinical Trial. JAMA Neurol 2015;72:1433-1441
Cohen JA, Coles AJ, Arnold DL et al. Alemtuzumab vs. interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012;380:1819-1828
Coles AJ, Twyman CL, Arnold DL et al. Alemtuzumab for patients with
relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial. Lancet 2012;380:1829-1839
Cruz-Orengo L, Daniels BP, Dorsey D et al. Enhanced sphingosine-1-phosphate receptor 2 expression underlies female CNS autoimmunity susceptibility. J Clin Invest 2014;124:2571-2584
Diagnose und Therapie der Multiplen Sklerose. S2e- Leitlinie der Deutschen Gesellschaft für Neurologie (DGN), AWMF-Registernummer: 030/050, in Überarbeitung
Geginat J, Paroni M, Pagani M et al. The Enigmatic Role of Viruses in Multiple Sclerosis: Molecular Mimicry or Disturbed Immune Surveillance? Trends Immunol 2017;38:498-512
Krankheitsbezogenes Kompetenznetz Multiple Sklerose e. V. Qualitätshandbuch Multiple Sklerose – Empfehlungen zur Therapie der MS für Ärzte (2016), www.kompetenznetz-multiplesklerose.de
Petersen G, Wittmann R, Arndt V, Göpffarth D. Epidemiologie der Multiplen Sklerose in Deutschland. Nervenarzt 2014;85:990-998
Schwabe U, Paffrath D (Hrsg). Arzneiverordnungsreport 2016, Springer Verlag Berlin Heidelberg, 2016
Shirani A, Okuda DT, Stüve O. Therapeutic Advances and Future Prospects in Progressive Forms of Multiple Sclerosis. Neurotherapeutics 2016;13:58-69






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.