
- DAZ.online
- DAZ / AZ
- DAZ 10/2017
- Entzündungsmediatoren ...
Pharmakologie
Entzündungsmediatoren abfangen
Hemmung von proinflammatorischen Zytokinen durch Biologicals
Pathologische Entzündungsreaktionen und die Rolle proinflammatorischer Zytokine
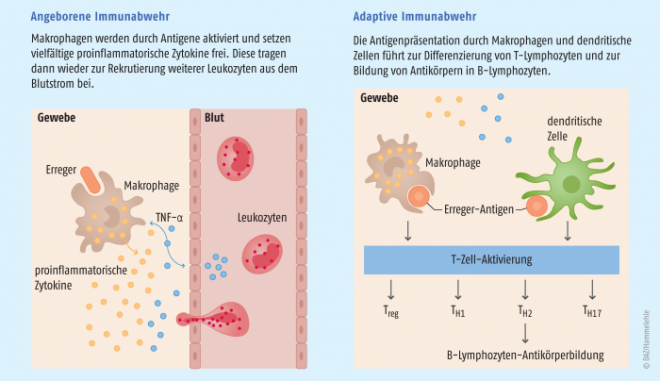
Entzündungen sind im Grunde Abwehrreaktionen, mit denen sich der Körper gegen schädigende Einflüsse zur Wehr setzt. Auf zellulärer Ebene beginnt sie mit der angeborenen Immunabwehr, z. B. in Form der Phagozytose pathogener Strukturen durch Makrophagen im Gewebe und durch Rekrutierung von Leukozyten aus dem Blutstrom. Daran schließen sich die Reaktionen der erworbenen Immunabwehr an, die durch die Aktivierung und Proliferation von Lymphozyten mit der Bildung spezifischer Antikörper einhergehen. Damit wird eine hochgradige Differenzierung der Fremdstoffe von körpereigenen Strukturen gewährleistet. All die genannten Prozesse werden durch die Kommunikation der Zellen über proinflammatorische Zytokine vorangetrieben (Abb. 1). Zytokine sind regulatorische Proteine, die in die Proliferation und Differenzierung von Zellen in vielfältiger Art eingreifen.
Durch eine Fehlregulation des Körpers – zumeist auf der Ebene der Lymphozyten – können aber Entzündungsreaktionen auch pathologisch entgleisen und selbst zum pathologischen Mechanismus werden, wobei sie zeitlich und räumlich entkoppeln. Die genauen Ursachen der genetischen Fehlregulation sind bisher nicht bekannt, doch zeigen die chronischen Entzündungserkrankungen trotz ihrer symptomatischen Diversität (Rheumatoide Arthritis, Psoriasis, Multiple Sklerose …) ein uniformes Verlaufsmuster der funktionell fehlgeleiteten Immunabwehr.
Um systemisch hemmend in den Entzündungsfortgang einzugreifen und nicht nur Symptome zu bekämpfen, bieten sich die proinflammatorischen Zytokine als Zielstrukturen (Targets) von Pharmaka an, denn sie sind zentrale Mediatoren (Kommunikationselemente) der immunkompetenten Zellen (Tab. 1).
Bedeutungsträger |
Name (INN) |
Präparat |
Target*
|
|---|---|---|---|
-lim-u-mab |
Adalimumab
Belimumab
Golimumab
|
Humira
Benlysta
Simponi
|
TNF-α
BLyS
TNF-α
|
-li-zu-mab |
Certolizumab Pegol
Daclizumab
Mepolizumab
Reslizumab
Tocilizumab
|
Cimzia
Zinbryta
Nucala
Cinqaero
RoActemra
|
TNF-α
IL-2-R
IL-5
IL-5
IL-6-R
|
-li-xi-mab |
Basiliximab
Infliximab
|
Simulect
Remicade
|
IL-2-R
TNF-α
|
-kin-u-mab |
Secukinumab
Ustekinumab
|
Cosentyx
Stelara
|
IL-17A
IL-12, IL-23
|
-ki-zu-mab |
Ixekizumab |
Taltz |
IL-17A |
* R = Rezeptor | |||
Zytokine
Von der strukturell und funktionell vorgenommenen Einteilung der Zytokine in fünf Familien sind für Entzündungen insbesondere die Interleukine, die Tumornekrosefaktoren, die Chemokine sowie die Interferone von Bedeutung.
Interleukine greifen regulatorisch in die Lymphozyten-Aktivierung ein. Es sind über 70 Interleukine bekannt, die teils pro-, teils antiinflammatorisch wirken. Die wichtigsten proinflammatorischen Interleukine sind IL‑1, IL‑6, IL‑12, IL‑17 und IL‑23. Antiinflammatorisch wirksam sind u. a. IL‑10 und IL‑1-Rezeptorantagonisten.
Der Tumornekrosefaktor alpha (TNF-α) ist ein zentrales Signalmolekül; er wird insbesondere von Makrophagen sezerniert und stimuliert rezeptorvermittelt die Aktivierung und Proliferation von Lymphozyten.
Chemokine wirken „chemotaktisch“; sie steuern die Fortbewegung von Leukozyten im Gewebe entlang eines Gradienten dieser Mediatoren. Chemokine werden bisher nicht pharmakotherapeutisch adressiert.
Interferone sind Mediatoren, die als Reaktion auf z. B. virale Infektionen von unterschiedlichen Zellen sezerniert werden und so ein Spektrum antiinflammatorischer oder antiproliferativer Effekte entfalten. Therapeutisch werden Interferone z. B. in der MS-Therapie eingesetzt.
TNF‑α‑Hemmung als antiinflammatorische Strategie
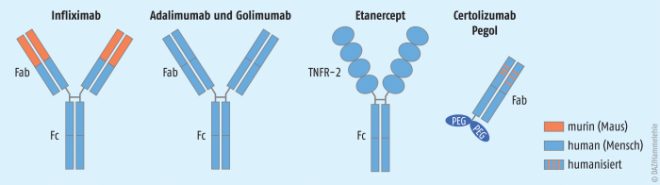
TNF‑α ist als ein zentraler Mediator in vielfältige pathologische Entzündungsreaktionen und Prozesse involviert, sodass eine Hemmung dieses Zytokins den Entzündungsfortgang in verschiedenen Krankheitsbildern blockieren kann. Seit einigen Jahren sind fünf rekombinante TNF‑α-Hemmer auf dem Arzneimittelmarkt (Abb. 2).
Infliximab (Remicade®). Bereits im Jahre 1999 wurde mit Infliximab der erste Wirkstoff zur Blockade des TNF‑α zugelassen. Infliximab ist ein chimärer (murin-humaner) IgG1 -Antikörper gegen TNF‑α, der in murinen Hybridomzellen hergestellt wird. Der Erstzulassung zur Therapie des Morbus Crohn folgten schnell Indikationserweiterungen zur Therapie der Rheumatoiden Arthritis (RA), Psoriasis, Psoriatrischen Arthritis, Spondylitis ankylosans (Morbus Bechterew) sowie Colitis ulcerosa, jeweils in Kombination mit Methotrexat (MTX), wenn die jeweilige Standardtherapie nicht ausreichend ist. Als der Patentschutz von Remicade® im Februar 2015 abgelaufen war, wurden zwei Biosimilars, die zueinander „bioidentischen“ (gleiche Produktionslinie) Remsina® und Inflectra®, von der EMA zugelassen, gefolgt vom dritten Biosimilar Flexabi® im Jahr 2016.
Therapie mit Infliximab
Infliximab (Remicade®) wird intravenös über ca. zwei Stunden in Kombination mit MTX in einer Dosierung von 3 mg/kg Körpergewicht bei RA (bei den anderen Erkrankungen 5 mg/kg) im Intervall von zwei und sechs Wochen, danach alle acht Wochen verabreicht.
Adalimumab (Humira®). Adalimumab ist ein humaner IgG1 -Antikörper gegen TNF‑α, der in CHO-Zellen generiert wird. Die Zulassung zur Therapie der RA erfolgte bereits 2003 (AbbVie), vielfältige Indikationserweiterungen folgten. Adalimumab ist u. a. zur Therapie der Psoriasis, Psoriasis-Arthritis, ankylosierenden Spondylitis, Colitis ulcerosa, des Morbus Crohn (Patienten ab 6 Jahre), der polyartikulären juvenilen Arthritis (ab 4 Jahre) sowie Acne inversa zugelassen. Im Gegensatz zu Infliximab kann Adalimumab wegen seines geringeren immunogenen Potenzials auch als Monotherapie angewendet werden. Adalimumab war Statistiken zufolge weltweit das umsatzstärkste Arzneimittel im Jahr 2015!
Therapie mit Adalimumab
Adalimumab (Humira®) wird als subkutane Injektion von 40 mg im zweiwöchigen Abstand appliziert. Die Nebenwirkungen und Kontraindikationen von TNF-α-Inhibitoren sind zu beachten (s. Kasten „Zytokine“). Trotz des Vorliegens einer rein humanen Proteinstruktur wurde auch die Bildung von Antikörpern gegen Adalimumab beschrieben, die bei ca. 30% der Patienten zu einem Wirkungsverlust führen.
Etanercept (Enbrel®). Etanercept ist ein weiterer TNF‑α-Hemmstoff, aber im Gegensatz zu Infliximab und Adalimumab kein Antikörper. Etanercept ist ein dimeres chimäres Protein, welches aus der extrazellulären Ligandenbindungsdomäne des humanen TNF‑α-Rezeptors-2 (TNFR-2) und dem Fc-Fragment eines humanen IgG1 besteht (Abb. 2). Ein Etanercept-Molekül kann somit zwei Moleküle TNF‑α binden. Es unterscheidet sich in zweierlei Hinsicht von den o. g. Antikörpern:
- Es bindet nur freies, nicht aber membranär gebundenes TNF‑α, und
- es kann auch Lymphotoxin-A (TNF-β) binden.
Die Zulassung (Wyeth) erfolgte bereits 2000 zur Therapie der RA bei Versagen der Standardtherapie; es folgten Indikationserweiterungen zur Therapie (jeweils in Kombination mit MTX) der ankylosierenden Spondylitis, Psoriasis (ab 6 Jahre), Psoriasis-Arthritis sowie der juvenilen idiopathischen Polyarthritis (ab 2 Jahre). Etanercept (Enbrel®) war im Jahr 2015 das zweit-umsatzstärkste Arzneimittel weltweit (nach Adalimumab). Mit Benepali® (Biogen) hat im Januar 2016 das erste Biosimilar die Zulassung in Europa erhalten, die FDA hat ein weiteres Biosimilar (Erelzi®; Sandoz) im August 2016 zugelassen.
Therapie mit Etanercept
Etanercept (Enbrel®) wird subkutan in einer Dosierung von 25 mg zweimal wöchentlich appliziert. Etanercept gilt als gut verträglich, die resultierende Immunsuppression erfordert aber auch Vorsichtsmaßnahmen und die Beachtung von Kontraindikationen.
Golimumab (Simponi®). Golimumab ist ein humaner IgG1 -Antikörper gegen TNF‑α, der in einer murinen Hybridom-Zelllinie hergestellt wird. Golimumab erhielt 2009 (Centocor B. V.) die Zulassung zur Therapie der RA in Kombination mit MTX, weitere Zulassungen existieren zur Therapie der ankylosierenden Spondylitis, der Psoriasis-Arthritis sowie der Colitis ulcerosa.
Therapie mit Golimumab
Golimumab (Simponi®) wird in einer Dosierung von 50 mg einmal monatlich subkutan durch eine Fertigspritze, kombiniert mit einem Autoinjektor, durch die Patienten selbst verabreicht. Hinsichtlich Nebenwirkungen und Kontraindikationen gelten die genannten Aspekte der immunsuppressiven Wirkung des Antikörpers.
Certolizumab Pegol (Cimzia®). Certolizumab Pegol ist ein weiterer TNF‑α-Antagonist, der für die Therapie der RA bei Versagen der Standardbehandlung in Kombination mit MTX seit 2009 zugelassen ist (UCB Pharma). Es ist ein in E. coli gebildetes humanisiertes Antigen-bindendes (Fab-)Fragment eines TNF‑α-Antikörpers, welches zur Verlängerung seiner Zirkulationszeit mit einem Polyethylenglykol (PEG) verbunden wurde (Abb. 2). Diese vereinfachte Antikörperstruktur ohne den Fc-Bereich bedingt eine verminderte Komplementaktivierung sowie reduzierte antikörperabhängige zelluläre Zytotoxizität. In der Schweiz sowie den USA ist Certolizumab Pegol auch zur Therapie des Morbus Crohn zugelassen.
Therapie mit Certolizumab Pegol
Certolizumab Pegol (Cimzia®) wird als subkutane Injektion im zweiwöchigen Abstand in einer Dosierung von initial 400 mg, ab der dritten Gabe 200 mg verabreicht. Trotz der vereinfachten Antikörperstruktur unterscheidet sich Certolizumab Pegol bezüglich Wirkung und Nebenwirkung nicht deutlich von den anderen TNF-α-Antagonisten.
Nebenwirkungen und Kontraindikationen. Die Blockade des TNF-α verursacht eine Immunsuppression der Patienten. Daraus ergeben sich bestimmte Nebenwirkungen und Kontraindikationen von TNF-α-Inhibitoren:
Nebenwirkungen:Infusionsbedingte (anaphylaktische) Reaktionen, erhöhte Infektanfälligkeit (insbesondere des Respirationstrakts, cave Tuberkulose!), Reaktivierung von viralen Infekten, invasive Pilzinfektionen, Bildung von Autoantikörpern; eine beschriebene Lymphomanfälligkeit ist aufgrund der geringen Fallzahlen nicht als signifikant zu bewerten.
Kontraindikationen: Aktive Infekte, Tuberkulose, andere immunsuppressive Therapien; außerdem eine schwere bis mittelschwere Herzinsuffizienz.
Therapeutischer Stellenwert. Die TNF‑α-Antagonisten haben die Pharmakotherapie pathologischer Entzündungen mit bis dato nie erreichten antiinflammatorischen Effekten revolutioniert und gleichzeitig mit ihrer frühen Marktpräsenz das gesamte Gebiet der rekombinanten Proteinarzneistoffe positiv in die öffentliche Aufmerksamkeit gerückt. Denn unter den zehn weltweit erfolgreichsten Arzneimitteln befinden sich drei TNF‑α-Antagonisten.
Die fünf zugelassenen TNF‑α-Antagonisten (Abb. 2) unterscheiden sich in ihrer Wirksamkeit und in ihrem Nebenwirkungspotenzial nicht deutlich voneinander.
Beratung in der Apotheke. Der hohe therapeutische Stellenwert der TNF‑α-Antagonisten bringt diese Wirkstoffe relativ häufig in die Apothekenpraxis. Obwohl die Apotheker nicht in die Therapie der TNF‑α-Blocker eingreifen dürfen (Ausnahme: Austauschbarkeit der Bioidenticals Remsina® und Inflectra®), ergeben sich für die Beratung der Patienten vielfältige Ansatzpunkte.
- Durch die resultierende Immunsuppression der Patienten gilt ihrer Selbstmedikation besondere Aufmerksamkeit.
- Bei der Reiseberatung muss auf die höheren Gefahren durch Infektionen mit bakteriellen (Tuberkulose!) oder parasitären Erregern hingewiesen werden.
- Impfungen mit Totimpfstoffen gelten für diese Patienten in der Regel als komplikationslos, Impfungen mit Lebendimpfstoffen müssen durch den behandelnden Arzt erwogen werden.
Wie bei allen Biologicals sind durch den Proteincharakter der Wirkstoffe hinsichtlich der Metabolisierung keine Wechselwirkungen mit anderen Arzneistoffen zu beachten.
Weiterentwicklung. Die Anwendung der TNF-α-Antagonisten zum Wegfangen des überschießenden TNF-α kommt einer „passiven Immunisierung“ der Patienten gleich. Eine neuere Idee verfolgt nun die Strategie, durch die aktive Immunisierung der Patienten mit einem wirkungslosen, aber immunogenen TNF-α-Derivat eine TNF-α-Antikörperbildung zu induzieren, die sich an die reale TNF‑α-„Last“ anpasst. Damit könnten nicht nur die dauerhaft teuren Antikörper-Applikationen entfallen, sondern es wären auch weniger negative Konsequenzen der Immunsuppression zu befürchten. Die französische Firma Neovacs hatte bereits 2014 ein strukturell abgewandeltes TNF-α-Proteinassoziat (TNF-Kinoid) in einer Phase-IIb-Studie mit 140 therapieresistenten RA-Patienten getestet, doch hatte es nicht die erhoffte Wirksamkeit gezeigt.
Therapeutische Hemmung von Interleukinen
Von den proinflammatorischen Interleukinen werden gegenwärtig die Interleukine 6, 12, 17A und 23 durch verschiedene Antikörperpräparate therapeutisch adressiert.
Interessanterweise ist das für Entzündungsreaktionen wichtige Interleukin-1 (IL‑1) aktuell für die Therapie kaum von Bedeutung. Der rekombinante IL‑1-Rezeptorantagonist Anakinra (Kineret®, Zulassung 2002 für die Therapie der RA in Kombination mit MTX) besitzt heutzutage wegen seiner täglichen Applikation (100 mg subkutan) keine Bedeutung mehr für diese Therapie.
Ustekinumab (Stelara®) zur Hemmung von IL‑12 und IL‑23. Ustekinumab ist ein humaner Antikörper, der sowohl IL‑12 als auch IL‑23 bindet. Der Antikörper ist seit 2009 zur Therapie von Patienten (ab dem 12. Lebensjahr) mit mittelschwerer oder schwerer Plaque-Psoriasis zugelassen, wenn eine systemische Standardtherapie nicht erfolgreich ist. Seit 2013 kann der Antikörper auch als Monotherapie oder mit MTX kombiniert zur Therapie der psoriatischen Arthritis Erwachsener eingesetzt werden. Die Blockade von IL‑12 und IL‑23 hemmt die T‑Zell-Aktivierung und -Differenzierung und trifft somit eine bedeutende pathologische Kaskade der Psoriasis. Studien zeigten eine Wirkungsüberlegenheit gegenüber Etanercept. Ustekinumab zeigte auch bei der Behandlung von Morbus-Crohn-Patienten, die nicht adäquat auf TNF‑α-Antagonisten ansprachen, eine Wirksamkeit. Auf Basis erfolgreicher Phase-III-Studien [1] wurde im Sommer 2016 die Empfehlung zur Indikationserweiterung für Morbus Crohn ausgesprochen.
Therapie mit Ustekinumab
Ustekinumab (Stelara®) wird als subkutane Injektion in einer Dosierung von 45 mg zu Beginn der Therapie zweimal im vierwöchigen Abstand, dann weiter im dreimonatlichen Intervall von den Patienten selbst appliziert. Die mit der Anwendung einhergehende Immunsuppression bedarf hinsichtlich Nebenwirkung und Kontraindikationen die Beachtung der bereits besprochenen Aspekte.
Secukinumab (Cosentyx®) zur Hemmung von IL‑17A. Secukinumab ist ein humaner Antikörper gegen IL‑17A. Dieses Interleukin ist ein entscheidender Mediator des Entzündungsprozesses bei der Plaque-Psoriasis. Mit der Zulassung von Secukinumab 2015 wurde erstmals ein Biological als Zytokin-Antagonist zur Erstlinien-Therapie einer chronischen Entzündung zugelassen. In der Zulassungsstudie war Secukinumab dem Etanercept deutlich überlegen. Auch das IQWiG hat in seiner Bewertung 11/2015 dem Wirkstoff einen Zusatznutzen für die Psoriasis-Therapie bescheinigt. Durch Indikationserweiterung ist Secukinumab auch zur Therapie der psoriatischen Arthritis sowie der Spondylitis ankylosans zugelassen. Seine Wirksamkeit bei der Multiplen Sklerose wird zur Zeit klinisch geprüft (Phase II).
Therapie mit Secukinumab
Secukinumab (Cosentyx®) wird in einer Dosierung von 300 mg (geteilt in zwei Dosen à 150 mg) subkutan zu Beginn fünfmal im wöchentlichen Abstand, gefolgt von monatlichen Intervallen appliziert. Es gelten alle genannten Begleiterscheinungen und Kontraindikationen aufgrund der Immunsuppression.
Ixekizumab (Taltz®) zur Hemmung von IL‑17A. Ixekizumab ist ein humanisierter IgG4-Antikörper gegen IL‑17A, der 2016 von FDA und EMA die Zulassung (Eli Lilly) zur Therapie der mittelschweren oder schweren Verlaufsformen der Psoriasis erhielt. Ixekizumab wird erst im Verlauf des Jahres 2017 in Europa verfügbar sein. Es soll als Fertigpen oder -spritze mit einer Dosierung von 80 mg initial 14-tägig subkutan appliziert werden, nach zwölf Wochen kommt ein monatliches Applikationsintervall zum Tragen.
Tocilizumab (RoActemra®) zur Hemmung des IL‑6-Rezeptors. Tocilizumab ist ein humanisierter Antikörper, der sowohl die lösliche als auch die membranständige Form des IL‑6-Rezeptors bindet und so IL‑6 in seiner proinflammatorischen Wirkung hemmt. Der Antikörper ist seit 2009 als Infusion mit MTX zur Therapie Erwachsener mit schwerer progressiver RA zugelassen, seit 2014 kann Tocilizumab auch subkutan als Monotherapie für Patienten mit mäßiger bis mittelschwerer RA angewendet werden.
Therapie mit Tocilizumab
Tocilizumab (RoActemra®) wird in einer Dosierung von 8 mg/kg Körpergewicht alle vier Wochen intravenös infundiert (20 mg/ml); für die subkutane Anwendung gilt eine feste Dosierung von 162 mg wöchentlich. Auch für Tocilizumab gelten die vorab genannten Begleiterscheinungen und Kontraindikationen im Zusammenhang mit der Immunsuppression.
Nebenwirkungen: Während andere rekombinante Proteine kaum Anlass für eine Wechselwirkung mit der Biotransformation anderer Arzneistoffe geben, gilt dies für Tocilizumab nicht. Da IL‑6 verschiedene Subenzyme des CYP450-Systems unterdrückt, kann unter Tocilizumab das Enzymsystem wieder seine „normale“ Aktivität aufnehmen und somit die Wirkstoffspiegel anderer Arzneistoffe (z. B. Atorvastatin, Simvastatin, Warfarin, Ciclosporin, Phenytoin) beeinflussen.
Hemmung von IL‑5 in der Asthmatherapie
Das Zytokin IL‑5 ist für die Aktivierung, Differenzierung und das Wachstum eosinophiler Granulozyten von herausragender Bedeutung und hat damit als Target für die therapeutische Hemmung der eosinophilen Asthmaformen eine große Bedeutung erlangt.
Mepolizumab (Nucala®). Mepolizumab ist ein humanisierter IgG1 -Antikörper gegen IL‑5. Im Dezember 2015 erhielt Mepolizumab (GSK) die Zulassung als Zusatztherapeutikum für Patienten mit schwerem refraktärem eosinophilem Asthma. Durch Blockade von IL‑5 wird die Aktivierung des Rezeptorkomplexes auf den Eosinophilen unterbunden. Der proinflammatorische Effekt der Eosinophilen im Lungengewebe wird durch die starke Abnahme der Eosinophilen-Anzahl im Blut deutlich reduziert.
Therapie mit Mepolizumab
Mepolizumab (Nucala®) wird in einer Menge von 100 mg im vierwöchigen Abstand subkutan appliziert. Bei der Anwendung werden Kopf- und Rückenschmerzen sowie lokale Reizungen an der Injektionsstelle als unerwünschte Wirkungen beschrieben. Das IQWiG hat Mepolizumab in der Therapie von Patienten mit schweren Verlaufsformen des eosinophilen Asthmas, die ansonsten häufig auf orale Glucocorticoide zurückgreifen müssten, einen geringen Zusatznutzen bescheinigt.
Reslizumab (Cinqaero®). Reslizumab ist ein humanisierter IgG4 -Antikörper gegen IL‑5, der mit Zulassung im August 2016 (Teva) ähnlich wie Mepolizumab zur Therapie erwachsener Patienten mit schwerem refraktärem eosinophilem Asthma als Zusatztherapie eingesetzt werden kann.
Therapie mit Reslizumab
Das Präparat Cinqaero® liegt als konzentrierte Lösung von 10 mg/ml vor, das nach Herstellen einer Infusionslösung (0,9% NaCl) intravenös in einer Dosierung von 3 mg/kg Körpergewicht im vierwöchigen Intervall appliziert werden muss. Bei 2% der behandelten Patienten wird eine Erhöhung der Creatinphosphokinase im Blut als mögliche Nebenwirkung beschrieben. Aber weder dieses Symptom noch Myalgien führten zu einem Therapieabbruch.
! Cave: IL‑5-Blockade. Eosinophile Granulozyten haben im Immunsystem eine Funktion zur Abwehr von Parasiten. Die therapeutische Blockade von IL‑5 würde daher z. B. die Behandlung einer Wurmerkrankung stören, sodass diese vor der Anwendung von Mepolizumab oder Reslizumab erfolgen müsste. Beide IL‑5-Antikörper sind bisher nicht für die Anwendung bei Kindern und Jugendlichen zugelassen.
Hemmung des IL‑2-Rezeptors auf T‑Lymphozyten
IL‑2 kann über seinen membranständigen Rezeptor auf T‑Lymphozyten einen direkt aktivierenden Einfluss auf die T‑Zell-Proliferation und damit den Entzündungsfortgang entfalten. Eine Blockade dieses Signalweges geht also mit immunsupprimierenden, so auch antiinflammatorischen Effekten einher.
Daclizumab (Zinbryta®). Daclizumab ist ein humanisierter Antikörper, der an eine Untereinheit (CD25) des IL‑2-Rezeptors bindet und so die Proliferation und Differenzierung von T‑Lymphozyten hemmt. Auch eine Verstärkung der Aktivität von natürlichen Killerzellen (NK-Zellen) als Regulatoren der überschießenden T‑Zell-Aktivierung wird beschrieben. Der ursprünglich zur Unterdrückung der Transplantatabstoßung eingesetzte Antikörper (Marktrücknahme 2009) ist seit August 2016 zugelassen (Biogen) für die Therapie der schubförmig verlaufenden Multiplen Sklerose.
Therapie mit Daclizumab
Daclizumab (Zinbryta®) wird in einer Dosierung von 150 mg einmal monatlich subkutan appliziert. Als Nebenwirkungen werden teilweise schwere Hautreaktionen beschrieben sowie die aus der Immunsuppression resultierende erhöhte Infektanfälligkeit. Unter der Therapie traten vereinzelt erhöhte Werte der Serum-Transaminasen sowie Leberschädigungen auf.
Basiliximab (Simulect®) ist ein chimärer Antikörper gegen den IL‑2-Rezeptor auf T‑Lymphozyten und verhindert so wie Daclizumab die T‑Lymphozyten-Proliferation. Seit 1999 ist Basiliximab in Kombination mit Ciclosporin zur Prophylaxe der Transplantatabstoßungsreaktionen bei Leber- und Nierentransplantationen zugelassen.
Hemmung von BLyS
BLyS (B-Lymphozyten-Stimulator) ist ein Zytokin, welches durch Bindung seiner Rezeptoren auf B-Lymphozyten deren Aktivität induziert. Die Hemmung von BLyS ist daher für die Therapie B-Zell-getriggerter autoimmuner Entzündungserkrankungen, insbesondere des systemischen Lupus erythematodes, von großer Bedeutung.
Belimumab (Benlysta®) ist ein humaner Antikörper gegen BLyS, der seit 2011 zur Therapie des Lupus zugelassen ist. Unter Therapie mit Belimumab nehmen der pathologische Spiegel der durch B-Zellen gebildeten Autoantikörper sowie die Krankheitsaktivität ab.
Therapie mit Belimumab
Belimumab (Benlysta®) wird als einstündige intravenöse Infusion in einer Dosierung von 10 mg/kg Körpergewicht appliziert – zu Therapiebeginn im zweiwöchigen Abstand, ab der 4. Gabe im monatlichen Intervall.
Antikörper in der Pipeline
Dupilumab (Dupixent®) ist ein humaner Antikörper gegen die identische α-Untereinheit des IL‑4- und IL‑13-Rezeptors auf B-Lymphozyten. Dupilumab blockiert daher die IL‑4- und IL‑13-Wirkung auf B-Zellen und hemmt somit die von TH2 -Zellen vermittelte Immunreaktion, die für atopische Ekzeme sowie für allergische Asthmareaktionen von Bedeutung ist. Dupilumab hat sehr erfolgreich die klinische Phase-II-Prüfung zur Behandlung des allergischen Asthmas abgeschlossen [2] und befindet sich auch in der klinischen Untersuchung bei atopischer Dermatitis.
Sirukumab ist ein humaner Antikörper gegen IL‑6, der nach positiven Phase-III-Studien zur Therapie der RA [3] von den Firmen GSK und Janssen bei EMA und FDA zur Zulassung eingereicht wurde.
Sarilumab ist ein humaner Antikörper gegen den IL‑6-Rezeptor (wie Tocilizumab), der von Sanofi und Regeneron Pharmaceutics nach einer erfolgreichen Phase-III-Studie zur Therapie der RA zur Zulassung bei der EMA (08/2016) eingereicht wurde. Der Zulassungsantrag bei der FDA wurde zur Klärung von Parametern des Herstellungsprozesses vorerst zurückgewiesen (10/2016).
Clazakizumab ist ein in Hefezellen produzierter, aglykosylierter humanisierter Antikörper gegen IL‑6, der gegenwärtig durch Vitaeris weiterentwickelt wird und eine klinische IIb-Studie für die Therapie der RA [4] erfolgreich abgeschlossen hat sowie auch für Psoriasis und Psoriasis-Arthritis klinisch untersucht wird.
Brodalumab (Siliq™) ist ein Antikörper gegen den IL‑17-Rezeptor. Nach erfolgreichen Phase-III-Studien zur Therapie der Psoriasis [5] sowie der Psoriasis-Arthritis (Überlegenheit gegenüber Ustekinumab) hat Valeant Pharmaceuticals im Februar 2017 von der FDA die Zulassung für die Psoriasis-Therapie erhalten.
Wertung und therapeutischer Stellenwert
Die zentrale Bedeutung proinflammatorischer Zytokine für die Forcierung und Steuerung von Entzündungsreaktionen hat diese Signalmoleküle als Targets (Zielstrukturen) für Biologicals in eine exponierte Stellung gebracht. Biologicals zur Zytokinblockade greifen blockierend in die Entzündungsprozesse ein. Auch wenn damit die Ursache der autoimmunen Entzündungserkrankungen nicht behoben werden kann, ermöglichen die Zytokinantagonisten eine bisher nie dagewesene Krankheitskontrolle und Reduktion destruktiver Begleiterscheinungen. Die Hemmung der Zytokine hat den Siegeszug der rekombinanten Proteine entscheidend mitgeprägt.
Die hohe Anzahl und das Innovationspotenzial klinischer Wirkstoffkandidaten, die hemmend in die Signalfunktionen der Zytokine eingreifen, beweist eindrucksvoll den Wert dieser pharmakologischen Strategie für die Therapie autoimmuner Entzündungserkrankungen. |
Biologicals – die Zukunft
Biologicals sprießen wie Pilze aus dem Boden, sie sind teuer, und sie versprechen ungeahnte Möglichkeiten – gleichzeitig verwirren sie mit komplexen Wirkstoffbezeichnungen, mit ihrer Empfindlichkeit und unerwarteten Indikationsüberschneidungen.
Machen Sie sich vertraut mit diesen innovativen Arzneistoffen, indem Sie Grundkenntnisse zu Struktur und Herstellung aufpolieren, beispielhafte Indikationen und Targets kennenlernen und die Konsequenzen für das Handling in der Apotheke verstehen.
Biopharmazeutika liegen im Trend – daten Sie sich up!
Gerd Bendas, Martina Düfer
Update Biologicals
Rekombinante Proteine und ihr therapeutischer Einsatz.
Update Pharmazie.
XII, 85 S., 42 farb. Abb., 2 Tab., kartoniert, 24,80 €
Deutscher Apotheker Verlag, Stuttgart 2016
ISBN 978-3-7692-6628-3
Einfach und schnell bestellen
Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart
Tel. 0711 – 25 82 341, Fax: 0711 – 25 82 290
E-Mail: service@deutscher-apotheker-verlag.de
oder unter www.deutscher-apotheker-verlag.de
Literatur
[1] Feagan BG, et al. Ustekinumab as Induction and Maintenance Therapy for Crohn‘s Disease. N Engl J Med 2016;375:1946-1960
[2] Wenzel S, et al. Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium-to-high-dose inhaled corticosteroids plus a long-acting β2 agonist: a randomised double-blind placebo-controlled pivotal phase 2b dose-ranging trial. Lancet 2016;388:31-44
[3] Lazzerini PE, et al. Spotlight on sirukumab for the treatment of rheumatoid arthritis: the evidence to date. Drug Des Devel Ther 2016;10:3083-3098
[4] Weinblatt ME, et al. The efficacy and safety of subcutaneous clazakizumab in patients with moderate-to-severe rheumatoid arthritis and an inadequate response to methotrexate: results from a multinational, phase IIb, randomized, double-blind, placebo/active-controlled, dose-ranging study. Arthritis Rheumatol 2015;67:2591-2600
[5] Farahnik B, et al. Brodalumab for the Treatment of Psoriasis: A Review of Phase III Trials. Dermatol Ther 2016;6:111-124























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.