
- DAZ.online
- DAZ / AZ
- DAZ 49/2016
- Generisches Imatinib
Meinung
Generisches Imatinib
Die Indikationslücke GIST könnte für Probleme sorgen
Aktuell weist Glivec® neun verschiedene Indikationen auf (s. Kasten „Zugelassene Anwendungsgebiete“), die nicht alle gleichzeitig zugelassen wurden. Da die positiven Studienergebnisse zu gastrointestinalen Stromatumoren (GIST) gegenüber der CML etwas später zur Verfügung standen, erfolgte die Zulassung von Glivec® zur GIST-Behandlung im Jahr 2002. Damit ist zu erwarten, dass bis Oktober 2021 die GIST in den Gebrauchsinformationen der Generika als zugelassene Indikation nicht zu finden sein wird.
Zugelassene Anwendungsgebiete für Glivec® gemäß Fachinformation (Stand 10/2016)
- Erwachsene und Kinder mit neu diagnostizierter Philadelphia-Chromosom(bcr-abl)-positiver (Ph+) chronischer myeloischer Leukämie (CML), für die eine Knochenmarkstransplantation als Erstbehandlungsmöglichkeit nicht in Betracht gezogen wird.
- Erwachsene und Kinder mit Ph+ CML in der chronischen Phase nach Versagen einer Interferon-Alpha-Therapie, in der akzelerierten Phase oder in der Blastenkrise.
- Erwachsene mit neu diagnostizierter Philadelphia-Chromosom-positiver akuter lymphatischer Leukämie (Ph+ ALL) in Kombination mit einer Chemotherapie.
- Erwachsene mit rezidivierter oder refraktärer Ph+ ALL als Monotherapie.
- Erwachsene mit myelodysplastischen/myeloproliferativen Erkrankungen (MDS/MPD) in Verbindung mit Gen-Umlagerungen des PDGF-Rezeptors (platelet-derived growth factor).
- Erwachsene mit fortgeschrittenem hypereosinophilem Syndrom (HES) und/oder chronischer eosinophiler Leukämie (CEL) mit FIP1L1-PDGFRα-Umlagerung.
- Zur Behandlung c-kit(CD 117)-positiver nicht resezierbarer und/oder metastasierter maligner gastrointestinaler Stromatumoren (GIST) bei Erwachsenen.
- Adjuvante Behandlung Erwachsener mit signifikantem Risiko eines Rezidivs nach Resektion c-kit(CD 177)-positiver GIST. Patienten mit einem niedrigen oder sehr niedrigen Rezidivrisiko sollten keine adjuvante Behandlung erhalten.
- Behandlung Erwachsener mit nicht resezierbarem Dermatofibrosarcoma protuberans (DFSP) und Erwachsene mit rezidivierendem und/oder metastasiertem DFSP, die für eine chirurgische Behandlung nicht infrage kommen.
Rückblick
Mit Imatinib (Glivec®) wurde 2001 eine neue Ära der CML-Behandlung beschritten, da mit einer alleinigen oralen Therapie bei insgesamt guter Verträglichkeit lang anhaltende vollständige zytogenetische Remissionen von über 95% erreicht werden konnten.
Ebenfalls von Vorteil erwies sich seine vergleichsweise gut voraussagbare klinische Pharmakokinetik, da die inter- bzw. intraindividuellen Schwankungsbreiten der Talspiegel mit 25 bis 64% bzw. 15 bis 27% relativ gering sind. Dabei spielen
- seine relativ hohe Absorptionsquote,
- unabhängig von den Mahlzeiten,
- bei vernachlässigbarem First-pass-Effekt,
- bei gleichzeitig aktivem Hauptmetaboliten,
- vernachlässigbarem Einfluss von Protonenpumpeninhibitoren (PPI) in der Komedikation und
- keine signifikanten Unterschiede in der Absorption zwischen Kindern und Erwachsenen bzw. CML- und GIST-Patienten
eine wichtige Rolle. Diese Eigenschaften sind auch insofern von Vorteil, da die Einhaltung definierter Imatinib-Konzentrationsbereiche im Plasma über die Zeit von prognostischer Bedeutung für das Therapieansprechen sind [1, 8].
Auch wenn prospektiv angelegte Studien noch ausstehen, so geht man inzwischen doch ziemlich fest davon aus, dass bei einem langfristig eingehaltenen Talspiegel (cmin -Wert) von mindestens 1 µg/ml bei CML-Patienten und mindestens 1,1 µg/ml bei GIST-Patienten langanhaltende Remissionen unterstützt werden. Experten haben in diesem Zusammenhang sogar empfohlen, zumindest einmal vier (bis 12) Wochen bzw. ein Jahr nach Beginn einer Imatinib-Therapie eine Bestimmung von Talspiegeln vorzusehen, um Patienten mit unerwartet großen Abweichungen in Bezug auf definierte Durchschnittswerte rechtzeitig identifizieren zu können, um daraufhin zu prüfen, ob mögliche Interaktionen oder Non-Adhärenzen die Ursache sind. Der Wert nach zwölf Monaten Therapie bietet sehr wahrscheinlich einen wichtigen Hinweis auf das zu erwartende zytogenetische Ansprechen von Imatinib bei der CML [7, 12].
Pharmakodynamische Unterschiede: GIST und CML
Während die klinische Wirksamkeit des Imatinib bei CML-Patienten primär auf der selektiven Hemmung der bcr-abl-assoziierten Tyrosinkinase beruht, steht seine Wirksamkeit bei GIST vor allem mit der Inhibition von c-kit- und PDGFR-α-assoziierten Tyrosinkinasen in Zusammenhang. Die besondere pharmakodynamische Bedeutung von c-kit und PDGFR α in der GIST wird auch dahingehend verständlich, da die Tyrosinkinasehemmer Sunitinib und Regorafenib in der Zweit- und Drittlinientherapie der GIST ebenfalls diese beiden Onkoproteine effektiv hemmen [8].
Zulassung eines Imatinib-Generikums
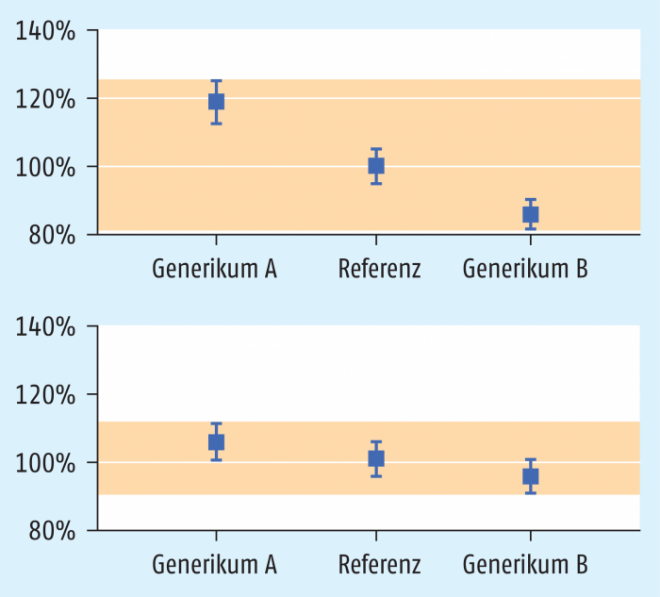
Voraussetzung für die Zulassung der TKI-Generika – allen voran Imatinib – ist, dass bei ihnen das 90%-Konfidenzintervall der Parameter cmax und AUC im Bereich von 80 bis 125% der Referenz (Originalpräparat) liegt [9]. Für Arzneistoffe mit geringer therapeutischer Breite (narrow therapeutic index drug, NTID) liegen die Bioäquivalenzgrenzen hingegen bei 90 bis 111% (Abb. 1).
Wie bei fast allen anderen Generika (Ausnahme: CMR-Arzneimittel wie Zytostatika) wird die Bioäquivalenz mit der Referenz bei gesunden Probanden geprüft; klinisch-pharmakokinetische Untersuchungen am Zielkollektiv (z. B. CML-Patienten) sind für die Zulassung des Generikums unter regulatorischen Gesichtspunkten nicht vorgesehen [4, 10].
In diesem Zusammenhang führten zwischenzeitlich Fallserien zu Verunsicherungen, die beim Wechsel des Originalpräparats Glivec® auf ein Generikum teilweise von Verlusten der kompletten hämatologischen Remission berichteten (Tab. 1). Allerdings stammen diese Angaben aus Ländern außerhalb der EU und den USA, sodass Unklarheiten zu den regulatorischen Gegebenheiten des jeweiligen Zulassungsverfahrens für ein Imatinib-Generikum bestehen. So könnte beispielsweise die Vorlage von In-vitro-Dissolutions-Tests für die Zulassung ausreichend gewesen sein. Darüber hinaus stehen keine Angaben zu Imatinib-Blutspiegeln vor, während und nach den Umstellungsphasen zur Verfügung, um die Einzelfallbeobachtungen klinisch-pharmakokinetisch untermauern zu können [3, 6, 11].
Fälle (Land) |
Bericht |
|---|---|
n = 4 (Ägypten) |
CHR unter Glivec®, hämatologischer Rückfall unter generischem Imatinib (Imatib®), erneute CHR nach Wechsel auf Glivec®
|
n = 1 (Marokko) |
CHR unter Hydroxyurea/Interferon, hämatologischer Rückfall unter Imatinib-Generikum (Imatinib Coper®), erneute CHR nach Wechsel auf Glivec®
|
n = 126 (Irak) |
Hämatologische Rückfallrate von 33% unter generischem Imatinib (Imatib®)
|
CHR = komplette hämatologische Remission | |
Auswirkungen der Rabattverträge
Auf der Basis bestehender Rabattverträge gemäß § 130a Abs. 8 SGB V rechnet die GKV im ambulanten Arzneimittelmarkt in Deutschland derzeit mit Kosteneinsparungen von mehr als 3,2 Mrd. Euro pro Jahr, wenn man die offiziellen Listenpreise der verschiedenen verfügbaren Arzneimittel zugrunde legt. Ausgangspunkt dieser Ausgabensenkung war der GBA-Beschluss vom 1. April 2007, nachdem alle Präparate nach dem Aut-idem-Prinzip austauschbar sind, wenn sich keine offensichtlichen Unterschiede zwischen den Präparaten erkennen lassen.
Darüber hinaus wurde 2009 eine Erweiterung dahingehend vorgenommen, dass eine Aut-idem-Substitution nach § 129 SGB V in öffentlichen Apotheken auch dann vorgenommen werden muss, wenn zumindest eine zugelassene Indikation zwischen Generikum und Referenzprodukt übereinstimmt (§ 4 Anlage 1e der Rabattverträge).
Diese Regelung hat sehr wahrscheinlich zur Folge, dass bei einem Rabattvertrag zu einem Imatinib-Generikum das entsprechende Handelspräparat auch bei GIST-Patienten abgegeben werden muss, auch wenn diese Indikation aus patentrechtlichen Gründen nicht in der Gebrauchsinformation des Imatinib-Generikums aufgeführt ist [2].
Ärztliche und pharmazeutische Bedenken
Es ist rechtlich festgeschrieben, dass der Apotheker bei der Abgabe eines rabattbegünstigten Arzneimittels ausdrücklich von den Vorgaben des § 129 SGB V im Rahmen einer Aut-idem-Substitution abweichen darf, wenn bei der Abgabe im konkreten Einzelfall pharmazeutische Bedenken bestehen. Ist beispielsweise offensichtlich eine innere Ablehnung des Patienten erkennbar, auf ein (anderes) Generikum zu wechseln, sodass eine Non-Adhärenz sehr wahrscheinlich die Folge wäre, dann darf die Apotheke das bisher verwendete Fertigarzneimittel gemäß § 4 Abs. 3 Rahmenvertrag abgeben, wobei allerdings auf dem Rezept (Muster 16) die pharmazeutischen Bedenken stichwortartig zum Zeitpunkt der Belieferung begründet und mit dem speziell dafür vorgesehenen Sonderkennzeichen versehen werden müssen [2].
Im Grundsatz kann auch der behandelnde Arzt jeglichen Austausch von Fertigarzneimitteln gemäß § 129 SGB V ausschließen, in dem er das Aut-idem-Feld in der Muster-16-Vorlage ankreuzt. Allerdings muss er dann die Dokumentationspflicht übernehmen und im Zweifelsfall die aus Kassensicht erfolgte unwirtschaftliche Verordnungsweise begründen können.
Würde demzufolge ein GIST-Patient die Substitution seines bisher verordneten Glivec® auf ein Imatinib-Generikum ablehnen, weil er die fehlende Zulassung für seine Indikation anprangert, so könnte die Apotheke das Originalpräparat abgeben, wenn in diesem Zuge die Adhärenz sichergestellt wäre.
Diskussion
In den nächsten Jahren verlieren verschiedene Tyrosinkinase-Inhibitoren (TKI) sukzessive ihren Patentschutz – allen voran Glivec®. Die Zulassung dieser Generika erfolgt auf der Basis von Bioäquivalenzstudien an gesunden Probanden, wobei die beiden Parameter cmax und AUC die vorgegebenen Zielbereiche einhalten müssen, wie sie für Generika mit großer therapeutischer Breite definiert sind.
Aus patentrechtlichen Gründen werden die Imatinib-Generika für die ersten Jahre nicht die GIST als Indikation aufführen, sodass im Rahmen einer wirtschaftlichen Verordnungsweise auf der Basis bisher praktizierter Rabattverträge (gemäß § 4 Anlage 1e) ein Off-label-Use vorprogrammiert ist, der rechtlich mit den Vorgaben des BSG-Urteils (2002) kollidiert (s. Kasten „Off-label-Use und GKV“), da mit dem Originalpräparat eine zugelassene Behandlungsalternative existiert [13].
Off-label-Use und GKV
Richtungsweisende Voraussetzungen, damit ein Off-label-Use gemäß BSG-Urteil vom 19.03.2002 (B 1 KR 37/00R) zulasten der GKV erstattungsfähig werden kann (mod. nach [13]):
1. Es muss sich um eine schwerwiegende (lebensbedrohliche oder die Lebensqualität nachhaltig beeinträchtigende) Erkrankung handeln.
2. Es darf keine andere zugelassene Behandlungsalternative verfügbar sein.
3. Es muss auf der Basis der verfügbaren Datenlage eine begründete Aussicht bestehen, dass mit dem betreffenden Präparat ein Behandlungserfolg erzielt werden kann.
Immer wieder klagen pharmazeutische Unternehmen gegen die Vorgabe des § 4 Anlage 1e, so zuletzt die Firma Pfizer: Das Originalpräparat Lyrica® ist sowohl zur Behandlung von Epilepsien als auch zur Behandlung neuropathischer Schmerzen zugelassen, während entsprechende Generika aus patentrechtlichen Gründen nur die erstgenannte Indikation aufweisen. Auf der Basis der Rabattverträge erfolgt derzeit allerdings regelmäßig bei GKV-Patienten eine Aut-idem-Substitution auf Pregabalin-haltige Generika zur Behandlung neuropathischer Schmerzen gemäß § 129 SGB V, obwohl der Patentschutz nur für die Indikation „Behandlung von Epilepsien“ abgelaufen war. Die Firma Pfizer machte im Rahmen der rechtlichen Auseinandersetzung deutlich, dass es nicht sein könne, dass mit einer solchen Regelung der finanzielle Aufwand zur Indikationserweiterung konterkariert wird, d. h. ein Patent mit seiner bekannten Laufzeit keine Rechtssicherheit mehr zur Erwirtschaftung von Erlösen mit sich bringt und gleichzeitig die ansonsten sehr eng gefassten Regelungen des erstattungsfähigen Off-label-Use (BSG-Urteil 2002) faktisch außer Kraft gesetzt werden.
Überlegungen, den Terminus „Imatinib bei GIST“ zukünftig in die erweiterte Substitutionsausschlussliste aufzunehmen, dürften sich schwierig gestalten, da die Apotheke bisher auf keine Datenbasis zurückgreifen kann, wodurch zu erkennen wäre, um welche Indikation es sich bei dem Patienten handelt, sodass eine Nachfrage im direkten Gespräch notwendig wäre! Darüber hinaus sind in dieser Liste bisher v. a. Produkte mit geringer therapeutischer Breite und der damit zusammenhängenden Notwendigkeit regelmäßiger Blutspiegelkontrollen zu finden, was beim Imatinib nicht routinemäßig vorgesehen ist.
Inwieweit man zukünftig im Rahmen einer geplanten Imatinib-Umstellung durch ein engmaschigeres Monitoring von Plasmaspiegeln bei CML- und GIST-Patienten prüfen sollte, ob bisherige cmin -Werte (Talspiegel) weiterhin sicher aufrechterhalten werden, könnte unter wissenschaftlichen Gesichtspunkten von Interesse sein, vor allem wenn man bedenkt, dass bereits von Problemen im Rahmen von Umstellungen auf Imatinib-Generika berichtet wurde [10].
Entsprechende TDM-Analysen wären auch insofern von Bedeutung, da die zulassungsrelevanten Daten zur Bioäquivalenz ausschließlich an gesunden Probanden und nicht an CML- bzw. GIST-Patienten erhoben wurden. Solche Post-Marketing-Analysen konnten am Beispiel eines Amoxicillin-Generikums zeigen, dass die ursprüngliche zur Zulassung vorgelegte Bioäquivalenz nicht bestätigt werden konnte [5]!
Flankierend bietet sich im Rahmen eines Wechsels auch ein engmaschigeres zytogenetisches Biomonitoring an. Es ist selbstredend, dass insbesondere Patientenverbände durch die Einführung von Imatinib-Generika kritisch sind und durch zu häufige Präparatewechsel qualitative Einschränkungen ihrer etablierten Therapie befürchten. So forderten entsprechende Organisationen beispielsweise in einem internationalen Konsensus-Meeting, dass die Option bestehen muss, bei Anzeichen eines Wirkverlusts oder einer spürbaren erhöhten Nebenwirkungsrate möglichst rasch auf das vorherige Präparat wechseln zu können [10]. Sollte wiederum zu viel Druck im Rahmen der Aut-idem-Substitution aufgebaut werden, so ist nicht auszuschließen, dass eine häufigere Verordnung der weiterhin patentgeschützten Präparate Nilotinib (Tasigna®) und Dasatinib (Sprycel®) in der CML die Folge sein könnte (Tab. 2) [1].
Imatinib, Glivec®
|
Dasatinib, Sprycel®
|
Nilotinib, Tasigna®
|
|
|---|---|---|---|
|
Zulassungsspektrum
(in verkürzter Form)
|
Ph+ CML (chronische Phase, akzelerierte Phase, Blastenkrise)
PDGFR-assoz. MDS/MPD
(c-kit+) GIST
|
Ph+ CML (chronische Phase, akzelerierte Phase, Blastenkrise nach Vorbehandlung)
|
Ph+ CML
(chronische Phase)
|
|
Pharmakodynamik
(Zielstrukturen)
|
bcr-abl
c-kit
DDR1 und 2
CSF-1R
PDGFR α und β
|
bcr-abl
Src
c-kit
EPH
PDGFR β
|
bcr-abl
PDGFR
c-kit
EPH
|
Abkürzungen: DDR = Discoidin-Domain-Rezeptor; EPH = Ephrin-Rezeptor-Kinase; CSF-1R = Kolonie-stimulierender-Faktor-Rezeptor 1; PDGFR = Thrombozyten-Wachstumsfaktor-Rezeptor | |||
Zusammenfassend ist festzustellen, dass die bisherigen Vorgaben der Rabattverträge zu erheblichen Verunsicherungen führen können, wenn Lücken in den zugelassenen Anwendungsgebieten zwischen dem Originalpräparat und den Generika bestehen. Es ist davon auszugehen, dass diese Problematik mit der Verfügbarkeit weiterer TKI-Generika zunehmen wird, da es bei den verschiedenen Vertretern dieser Stoffklasse über die Jahre immer wieder zu sukzessiven Erweiterungen von Indikationsgebieten kam. Im Gegenzug darf es nicht überraschen, wenn – wie am Beispiel von Lenvatinib (Lenvima®) – neue Indikationsfelder (z. B. metastasiertes Nierenzellkarzinom) mittlerweile in einem getrennten Zulassungsverfahren und einem neuen Fertigarzneimittelnamen (Kisplyx®) münden, sodass die Vorgaben von § 4 Anlage 1e der Rabattverträge nicht mehr greifen werden! |
Literatur
[1] Anderson KR, et al. Medication adherence among adults prescribed imatinib, dasatinib, or nilotinib for the treatment of chronic myeloid leukemia. J Oncol Pharm Practice 2015;1:19-25
[2] Brüggen J, Warmers H. Retaxfall des Monats: Im Sinne der Krankenkasse – Wann sind pharmazeutische Bedenken ausreichend begründet? DAZ 2016;156:4032-3
[3] Chouffai Z. Hematologic relapse after 2 years on a non-authorized copy version of imatinib in a patient with chronic myeloid leukemia in chronic phase: a case report. Case Rep Oncol 2010;3:272-276
[4] De Lemos ML, Kyritsis V. Clinical efficacy of generic imatinib. J Oncol Pharm Practice 2015;21:76-79
[5] Del Tacca M, et al. Lack of pharmacokinetic bioequivalence between generic and branded amoxicillin formulations. A post-marketing clinical study on healthy volunteers. Br J Clin Pharmacol 2009;68:34-42
[6] Goubran HA. Failure of a non-authorized copy product to maintain response achieved with imatinib in a patient with chronic phase chronic myeloid leukemia: a case report. J Med Case Rep 2009;29:7112-7114
[7] Gotta V, et al. Clinical usefulness of therapeutic concentration monitoring for imatinib dosage individualization: results from a randomized controlled trial. Cancer Chemother Pharmacol 2014;74:1307-19
[8] Kirrstetter M, Eickhoff A, Riemann JF. Therapie gastrointestinaler Stromatumoren (GIST). Arzneimitteltherapie 2008;26:239-45
[9] Lipp HP. Grenzen der Aut-idem-Substitution: NTID, Biosimilars und NBCD. Krankenhauspharmazie 2013;34:384-92
[10] Mathews V. Generic imatinib: the real-deal or just a deal? Leuk Lymphoma 2014;55:2678-2680
[11] Mattar M. Failure of copy Imatib (CIPLA, India) to maintain hematologic and cytogenetic responses in chronic myeloid leukemia in chronic phase. Int J Hematol 2010;91:104-106
[12] Sharma SK, et al. Utility of the trough plasma imatinib level monitoring at two time points in patients with the chronic myeloid leukemia-chronic phase. J Cancer Res Ther 2014;10:305-8
[13] Von Harder Y. Off-label-Use. Ellipse 2007;23:35-41






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.