
- DAZ.online
- DAZ / AZ
- DAZ 41/2016
- Preis-werte ...
Arzneimittel und Therapie
Preis-werte Abfallentsorgung
Medizin-Nobelpreis für die Entschlüsselung der Autophagie
Bereits 1974 erhielt der Entdecker der Lysosomen Christian de Duve zusammen mit Albert Claude und George Palade für ihre Arbeiten zur Aufklärung der strukturellen und funktionellen Organisation der Zellen den Nobelpreis für Medizin oder Physiologie. Im Jahr 2004 folgte der Nobelpreis für Chemie an die Wissenschaftler Aaron Ciechanover, Avram Hershko und Irwin Rose für die Entdeckung des Ubiquitin-abhängigen Proteinabbaus. Und jetzt kürzlich, am Tag der Deutschen Einheit, wurde der diesjährige Preisträger des Nobelpreises für Medizin oder Physiologie, Yoshinori Ohsumi, verkündet. Der japanische Wissenschaftler hat maßgeblich dazu beigetragen, den Prozess der Autophagie aufzuklären.
„Bring’ doch bitte mal den Müll raus …“
Den Müll-Rausbringen funktioniert (vielleicht) bei uns in unserer sozialisierten Umgebung – und solange die Müllabfuhr nicht streikt. Unser Körper unternimmt ganz andere Anstrengungen und scheidet über verschiedene Wege diverse Reste und Abfallprodukte aus. Was machen aber einzellige Organismen, bei denen auch das ein oder andere Abfallprodukt anfällt? Einfach alles auszuschleusen, könnte riskant sein – ähnlich riskant wie in Neapel, wenn längere Zeit die Müllmänner streiken: Man erstickt fast im eigenen Müll! Besser ist es, möglichst wenig Abfall zu erzeugen, vor allem dann, wenn er auch noch wertvolle Bestandteile enthält, die gut wiederverwertet werden können. Hier helfen kleine zelluläre „Verdauungsorgane“, die Lysosomen.
Im Elektronenmikroskop lassen sich Lysosomen wunderbar betrachten. Die ersten Hinweise auf Autophagie kamen genau über diese Beobachtungen: In Nierenzellen neugeborener Mäuse waren nicht nur Lysosomen zu sehen, die von außen aufgenommene Objekte abbauten – so wie Christian de Duve das bereits beschrieben hatte –, sondern auch solche, die offensichtlich Mitochondrienfragmente und andere zelleigene Bestandteile enthielten.
Autophagie, ein Begriff, den Christian de Duve 1963 geprägt hat, stammt aus dem Griechischen und bedeutet „selbst-essen“. Den Beobachtungen zufolge war dies ein wichtiger Prozess, der vor allem bei der Differenzierung und beim Remodeling verschiedener Gewebe wie Gehirn, Darm, Niere, Lunge, Leber, etc. auftrat. Aber auch in einfacheren Organismen, wie Insekten, Amöben und einzelligen Eukaryonten gehört die Autophagie zu den normalen Vorgängen. Ein Umstand, den sich Yoshinori Ohsumi zunutze machte: Er untersuchte in den 1990er Jahren die Autophagie in der Bäckerhefe Saccharomyces cerevisiae genauer.
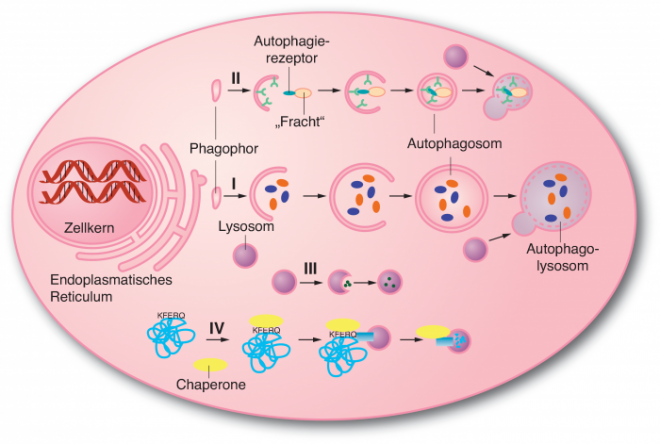
Bis dahin wusste man aus den Beobachtungen am Elektronenmikroskop, dass sich zu Beginn des „Selbst-Essens“ eine kleine Membranabschnürung bildet, das Phagophor (Abb. 1). Dieses Gebilde weitet sich aus und umschließt dabei einen Teil des Zytoplasmas mitsamt den darin enthaltenen größeren Strukturen und Organellen wie Ribosomen und Mitochondrien. Dadurch entsteht ein Autophagosom, das allerdings nur ca. 10 bis 20 Minuten existiert, bevor es mit einem Lysosom verschmilzt. Anschließend wird der gesamte Inhalt in die Einzelteile zerlegt und der Wiederverwertung zugeführt.
Autophagie findet nicht nur statt, wenn zellulärer Abfall entsorgt werden muss, sondern auch dann, wenn nicht genügend Nährstoffe von außen zur Verfügung stehen, also wenn die Zelle hungert. In Säugetierzellen unterdrückt Insulin, Glucagon hingegen induziert den Prozess.
Autophagie-Modellorganismen
Die von Ohsumi ausgewählte Hefe Saccharomyces cerevisiae war eine sehr gute Wahl als Modellsystem: Sie lässt sich schnell vermehren, relativ einfach genetisch manipulieren, und sie hat eine gut sichtbare Vakuole, über die die Autophagie verfolgt werden kann. Zunächst beobachtete Ohsumi in Hefe-Mutanten die Entstehung der Autophagosomen unter Nahrungsmangel. In diesen Hefezellen waren die typischen lysosomalen Proteasen Proteinase A, Proteinase B und Carboxy-Peptidase ausgeschaltet, und demzufolge war ihre „Verdauung“ gestört. Nachdem der Phänotyp charakterisiert war, wurden die Zellen einer weiteren, diesmal zufälligen Mutagenese ausgesetzt. Dadurch entstanden Tausende verschiedene Mutanten, die man auf eine zusätzlich gestörte Autophagie untersuchen konnte. So gelang es Ohsumi, nach einer arbeits- und zeitaufwendigen Suche, 15 Gene zu identifizieren, die die Autophagie zu steuern scheinen. Ohsumi bezeichnete diese Gene zunächst als APG1 bis 15.
Der Anfang der Aufklärung der molekularen Steuerung der Autophagie war gemacht! Im Laufe der folgenden Jahre klonierte Ohsumi noch zahlreiche andere Gene und charakterisierte die entsprechenden Proteine. Mittlerweile wurde die Nomenklatur geändert und aus dem Kürzel APG wurde ATG, so dass jetzt die relevanten Gene beginnend mit ATG1 durchnummeriert werden.
Hinter dem Prozess der Autophagie steckt eine komplexe Signalkaskade, an der unter anderem auch die Target-of-Rapamycin (TOR)-Kinase und die Phosphatidylinositol-3-Kinase beteiligt sind.
Nachdem die Gene und Proteine in Hefe bekannt waren, war es recht einfach, die relativ ähnlichen, homologen Proteine in Säugetieren zu identifizieren. Entsprechende Knock-out-Mausmodelle, bei denen verschiedene ATG-Gene ausgeschaltet wurden, bestätigten schließlich die Relevanz der Autophagie auch für die Entwicklung eines Säugetiers.
Inzwischen lassen sich verschiedene Typen der Autophagie unterscheiden (Abb. 1). Während Hungersituationen bzw. Stress wird über die sogenannte Makroautophagie völlig unselektiv ein Teil des Zytoplasmas inklusive enthaltener Organellen abgebaut, um neue Bausteine zu gewinnen. Demgegenüber werden bei der selektiven Autophagie bestimmte Protein-Aggregate, Organellen oder aber eingedrungene Viren und Bakterien verdaut, wofür zusätzlich spezielle Erkennungsmoleküle nötig sind, die die „Fracht“ identifizieren und an die Membran der Autophagosomen bringen. Neben diesen beiden wichtigen Mechanismen gibt es noch die sogenannte Mikroautophagie, bei der nur geringe Zytoplasmamengen über eine kleine Membraneinstülpung in die Lysosomen aufgenommen werden, und die Chaperone-vermittelte Autophagie (CMA). Die CMA ist dadurch charakterisiert, dass Proteine mit speziellen Erkennungssequenzen über Chaperone, also „Begleit-Proteine“ direkt in die Lysosomen transportiert werden.
Beteiligt an Alzheimer- und Tumorentstehung
Autophagie, besonders die Makroautophagie tritt vor allem dann auf, wenn die Zelle Stress ausgesetzt ist. Allerdings findet der Abbau von zellulärem Material ständig statt, jedoch auf niedrigem Level. Auf diese Weise wird ein Gleichgewicht an Proteinen und Organellen innerhalb der Zelle und deren Funktionsfähigkeit aufrechterhalten. Kann die Autophagie wegen einer Mutation in einem der ATG-Gene nicht mehr wie gewohnt ablaufen, kann dies zur Tumorentstehung beitragen. Dies konnte z. B. für das humane Protein Beclin-1 gezeigt werden, das ein Homolog des Hefe-ATG6-Proteins ist und z. B. in etlichen Brust- und Eierstocktumoren in inaktiver Form vorliegt. Auch für neurodegenerative Erkrankungen wie Alzheimer, an denen unlösliche Aggregate fehlgefalteter Proteine ursächlich beteiligt sind, ist wahrscheinlich eine Fehlfunktion der Autophagie mitverantwortlich. Nicht zuletzt die Tatsache, dass Autophagosomen an der Elimination eingedrungener Pathogene mithelfen, zeigt die Relevanz dieses zellulären Prozesses. Kein Wunder, dass sich die Anzahl der Veröffentlichungen zum Thema „Autophagie“ in den letzten Jahren rasant nach oben entwickelt hat: Waren bei Pubmed im Jahr 2003 noch nur 114 Treffer gelistet, liegt die Zahl für 2016 bereits bei 4029 – und das Jahr ist noch nicht zu Ende! So wundert es auch nicht, dass der Pionier der Autophagie, Yoshinori Ohsumi, in diesem Jahr mit dem Nobelpreis für Medizin oder Physiologie geehrt wird. |
Quelle
www.nobelprize.org: Pressemitteilung des Nobelpreiskommitees
www.nobelprize.org: Scientific Background Discoveries of Mechanisms for Autophagy



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.