
- DAZ.online
- DAZ / AZ
- DAZ 41/2016
- Daclizumab als „Robin ...
Arzneimittel und Therapie
Daclizumab als „Robin Hood der IL-2-Verteilung“
Neuer Antikörper halbiert das Risiko von MS-Schüben
Die Therapie der multiplen Sklerose (MS) ist seit einigen Jahren in Bewegung geraten. Neue Wirkstoffe und ein geändertes Stufenschema, das schon früh eine hocheffektive Therapie zulässt, haben die Behandlungsstrategien verändert. In den Leitlinienempfehlungen der Deutschen Gesellschaft für Neurologie (DGN) wird nicht mehr in Basis- und Eskalationstherapie unterschieden, sondern die Behandlungsstrategie am Krankheitsverlauf orientiert. Mit Daclizumab gibt es nun eine weitere Option für die Erstlinientherapie der schubförmig remittierenden MS.
Gegen aktivierte T-Zellen
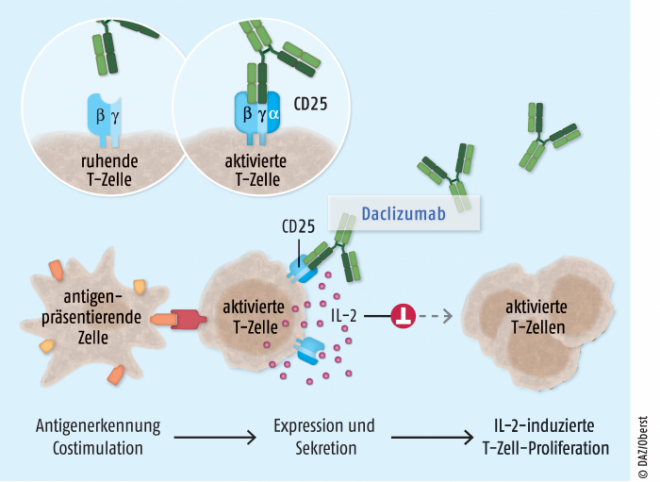
Konkret handelt es sich bei Daclizumab um einen humanisierten monoklonalen Antikörper, der gegen eine spezifische Untereinheit des Interleukin- 2-Rezeptors, das Oberflächenprotein CD25 auf aktivierten T-Zellen, gerichtet ist und immunregulatorisch wirkt (siehe Abb.). Die Bindung an CD25 hemmt einerseits die von Interleukin 2 (IL-2) angestoßene Signaltransduktionskaskade und so das Wachstum der aktivierten T-Zellen. Auf diese Weise soll der Zerstörung der Myelinscheiden und der Entstehung von typischen Entzündungsherden entgegengewirkt werden. Gleichzeitig kommt es zu einer gesteigerten IL-2-vermittelten Expansion von natürlichen Killerzellen vom Subtyp CD56bright, denen eine wichtige Rolle bei der Hemmung der Krankheitsaktivität zugeschrieben wird. Nach Absetzen von Daclizumab kommt es zu einem Wiederanstieg der T-Zellen. Daclizumab gilt als reversibler Immunregulator, durch den die Zahl aktivierter T-Zellen reduziert wird, ohne eine generelle Immunzelldepletion zu verursachen. Der exakte Mechanismus der therapeutischen Effekte von Daclizumab bei MS ist allerdings nicht bekannt.
In der SELECT- und in der DECIDE-Studie wurde der therapeutische Effekt von Daclizumab bei etwa 2200 Patienten untersucht.
SELECT: Placebo überlegen
In der randomisierten, doppelblinden Phase-IIb-Dosisfindungsstudie SELECT wurden 621 Patienten entweder mit Daclizumab 150 mg, Daclizumab 300 mg oder Placebo behandelt, jeweils mit einer subkutanen Injektion alle vier Wochen über ein Jahr. Das Fazit: Innerhalb eines Jahres kommt es zu einer signifikanten Reduktion der Krankheitsaktivität in Bezug auf relevante klinische und kernspintomografische Parameter. Konkret: Die jährliche Schubrate (annualized relapse rate; ARR) wurde unter Daclizumab 150 mg – der letztlich zugelassenen Dosis – signifikant um 54% reduziert im Vergleich zu Placebo. Das relative Risiko einer nach 24 Wochen bestätigten Behinderungsprogression wurde um 76% gesenkt. Die durchschnittliche Anzahl neuer/sich neu vergrößernder hyperintenser T2-Läsionen ging um 70% zurück, die durchschnittliche Anzahl neuer Gd+-Läsionen zwischen Woche acht und Woche 24 um 69%.
In der sich anschließenden offenen SELECTION-Studie wurden die Patienten entweder mit Daclizumab direkt weiterbehandelt oder nach einer 24-wöchigen Auswaschphase erneut behandelt. Weder unter kontinuierlicher Therapie noch während der Auswaschphase oder der erneuten Therapie erhöhte sich das Risiko unerwünschter Ereignisse.
DECIDE: Vergleich mit Interferon beta-1a
Zulassungsrelevant waren letztlich die Daten der DECIDE-Studie, einer Phase-III-Studie, die Daclizumab mit Interferon beta-1a (IFN beta-1a) bei insgesamt 1841 Patienten mit schubförmiger MS untersuchte. Verglichen wurde die einmal monatliche subkutane Applikation von Daclizumab in einer Dosis von 150 mg mit der einmal wöchentlichen intramuskulären Applikation von IFN beta-1a 30 μg über einen Zeitraum von bis zu 144 Monaten. Der Blick auf den primären Endpunkt, die ARR, zeigte den klinischen Vorteil des Antikörpers. Daclizumab reduzierte die jährliche Schubrate um 45%, nämlich von 0,22 gegenüber 0,39 unter IFN beta-1a (p < 0,001). Die Zahl der neuen oder sich vergrößernden hyperintensen T2-Läsionen war über 96 Wochen unter Daclizumab um 54% niedriger (4,3 vs. 9,4), die durchschnittliche Anzahl neuer Gd+-Läsionen um 75%. Die geschätzte Behinderungsprogression, bestätigt nach zwölf Wochen, lag in Woche 144 bei 16% gegenüber 20%. Dieser Unterschied war nicht signifikant. Das relative Risiko einer nach 24 Wochen bestätigten Behinderungsprogression verringerte Daclizumab um 27% (p = 0,033).
Eine interessante Nebenbeobachtung war ein günstiger Effekt von Daclizumab auf die Kognition mit einem signifikanten Vorteil im SDMT(Symbol Digit Modalities Test)-Score.
Nebenwirkungen managen
Nebenwirkungen unter Daclizumab betreffen vor allem Infektionen, Leberwerterhöhungen und Hautreaktionen. Dabei ist kein Zeitmuster erkennbar. Diese unerwünschten Wirkungen können jederzeit im Therapieverlauf auftreten. Leberwerterhöhungen über dem Fünffachen des Normalwerts wurden bei 6% der mit Daclizumab behandelten Patienten beobachtet gegenüber 3% unter Interferon-Therapie. Das hat Konsequenzen für das Therapiemanagement. Alanin-Aminotransferase (ALT), Aspartat-Aminotransferase (AST) und Bilirubin sollen während der Therapie im Abstand von vier Wochen und bis zu vier Wochen nach Therapieende kontrolliert werden. Bei erhöhten Leberwerten sollte Daclizumab nicht injiziert werden. Nach Absetzen der Therapie kommt es in der Regel zu einer Normalisierung der Leberwerte. Ein erneuter Therapieversuch kann erwogen werden. Da Daclizumab nicht über die Leber abgebaut wird, geht man davon aus, dass den Leberwerterhöhungen immunologische Prozesse zugrunde liegen.
Auf Hautreaktionen unter Daclizumab sollte der Patient vorbereitet werden. Ekzematöse und psoriatische Läsionen sind ebenso möglich wie allergische Reaktionen oder Akne-ähnliche Veränderungen. Sie sind nicht Narben-bildend und gehen nach dem Absetzen zurück. Empfohlen wird bei Bedarf eine dermatologische Standardtherapie, meist mit topischen oder systemischen Glucocorticoiden. |
Quellen
Launch-Fachpressekonferenz „Zinbryta®: neues Wirkprinzip in der Therapie bei schubförmiger Multipler Sklerose“, München, 8. September 2016 (Veranstalter: biogen)
Kappos L, et al. Daclizumab HYP versus Interferon Beta-1a in Relapsing Multiple Sclerosis. N Engl J Med 2015;373(15):1418–1428























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.