
- DAZ.online
- DAZ / AZ
- DAZ 21/2016
- Lichtempfindlich durch ...
Beratung
Lichtempfindlich durch Arzneimittel
Ursachen fototoxischer Hautreaktionen und Beratung zu fotosensibilisierenden Arzneistoffen
Da die steigende Anzahl lichtbedingter Schäden der Haut in der Bevölkerung vornehmlich durch extensives Sonnenbaden sowie auf die verstärkte Nutzung von Solarien zurückgeführt wird, verweisen Ärzte sowie Apotheker vor allem in den Sommermonaten auf einen verstärkten Hautschutz durch Sonnenschutzmittel. Dabei kann selbst eine kurze Lichtexposition, auch bei niedrigen Temperaturen, Hautreaktionen hervorrufen, sofern fototoxische oder fotoallergisierende Arzneimittel angewandt wurden [1]. Solche Fotosensibilisatoren oder deren Metabolite, die entweder durch direkten Kontakt oder systemisch in die Haut gelangen können, besitzen als gemeinsames strukturelles Merkmal eine chromophore Struktur. Diese ist in der Lage, ein Photon zu absorbieren und kurzfristig in einen energiereichen Singulettzustand zu gelangen. Dieses fototoxische Zwischenprodukt kann nun selbst, oder indirekt durch Energieübertragung auf Sauerstoff, Reaktionen mit Proteinen, Lipiden oder DNA eingehen [2].
Während bei einem typischen Sonnenbrand eine quantitative, die natürlichen Schutzmechanismen der Haut überfordernde Überexposition von UV-Strahlung vorliegt, kann im Fall einer fototoxischen Reaktion eine normalerweise tolerierte UV-Dosis, zumeist im UV-A-Bereich, ausreichend sein, um eine sonnenbrandähnliche Dermatitis auszulösen. Die fotoallergische Reaktion besitzt dagegen eine immunologische Komponente. Dabei vermittelt UV-A-, seltener UV-B-Licht nach Bindung an biologische Hautproteine die Bildung eines Vollantigens, das bei erneuter Exposition mit dem Arzneistoff eine T-Zell-vermittelte Typ-IV-Reaktion auslöst (immunologische Spättyp-Reaktion). Seltener kann sich die fotoallergische Reaktion auch als systemische Fotoallergie äußern [3].
Zwar unterscheidet man wie oben beschrieben zwischen fototoxischen (siehe Abbildung 1 und 2) und fotoallergischen Reaktionen (siehe Abbildung 3), jedoch ist das Erscheinungsbild oftmals nicht eindeutig abgrenzbar, bzw. es werden beide Formen teilweise durch die gleichen Wirkstoffe verursacht. Die Lichtempfindlichkeit hält gegebenenfalls auch noch Monate nach Absetzen des Medikaments an. Fototoxische Reaktionen können je nach auslösendem Agens sofort mit Stechen, Brennen und urtikariellen Erythemen, oder verzögert, mit Beginn nach Stunden oder Tagen, auftreten und dann ähnlich einem verstärkten Sonnenbrand mit flächenhaften ödematösen Erythemen und brennendem Schmerz bis hin zur ausgedehnten Blasenbildung erscheinen. Dieser entzündlichen Phase folgt häufig eine ausgeprägte Stimulation der Melanin-Synthese mit Hyperpigmentierung [4]. Fotoallergische Reaktionen zeigen zumeist das klinische Bild einer allergischen Kontaktdermatitis mit Juckreiz, unscharf begrenzten Erythemen, Papulo-Vesikeln, Schuppung und Schuppenkrusten.
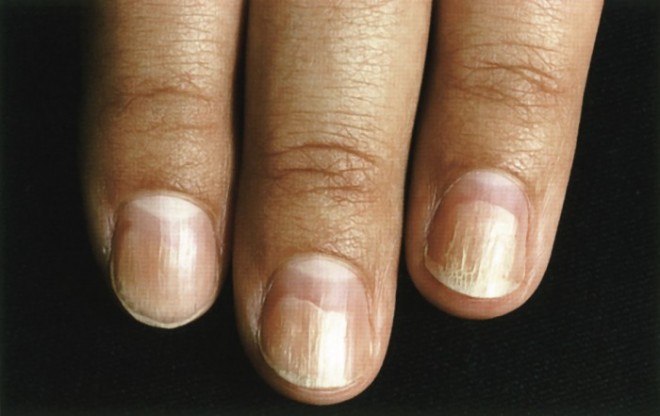
Abb. 1: Fototoxische Onycholyse Tetracycline führen häufig zu dieser fototoxischen Reaktion, die auch isoliert und ohne weitere Hautreaktionen auftreten kann. Es kommt zur Schädigung des Nagelbettepithels bis hin zur Ablösung der Nagelplatte.
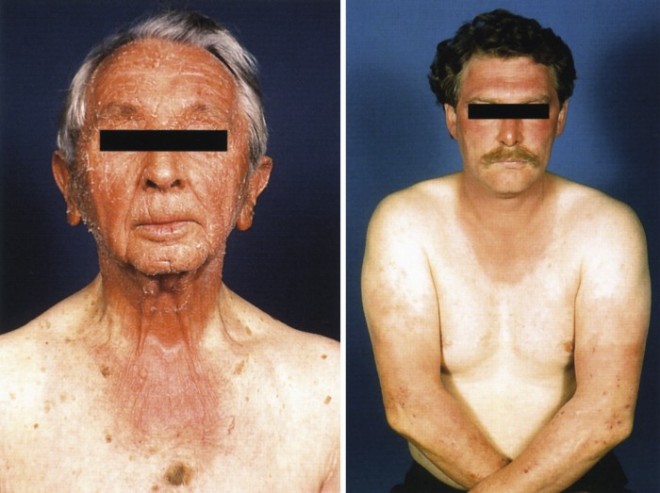
Abb. 2: Fototoxische irreversible Pigmentablagerung Amiodaron führt neben einer verstärkten Neigung zu Sonnenbrand bei chronischer Einnahme zu schiefergrauen Einlagerungen in die Haut.
Abb. 3: Fotoallergische Reaktion Ein chinidinhaltiges Antiarrhythmikum führte zu diesem Ekzem, das an den lichtexponierten Stellen durch Rötung, Infiltration und starke Schuppung gekennzeichnet ist (links). Benzophenon in einer Sonnenschutzcreme war der Auslöser dieser fotoallergischen Kontaktdermatitis an den frei getragenen Hautstellen (rechts).
Dabei können die Reaktionen von Patient zu Patient durchaus variieren. Bei topisch applizierten Arzneistoffen sind aufgrund des Konzentrationsgefälles der Substanz die fotosensitiven Schäden in den oberen Hautschichten besonders ausgeprägt, wohingegen vermehrt tiefere Hautschichten betroffen sind, wenn der Fotosensibilisator über den systemischen Weg in die Haut gelangt. Die Ausprägung der fototoxischen oder fotoallergischen Reaktion hängt ab:
- von den physiko-chemischen Eigenschaften, der Lipophilie, der Konzentration und dem Applikationsweg der fotosensibilisierenden Substanz sowie gegebenenfalls der Hilfsstoffe,
- von den individuellen Hauteigenschaften wie Bräunungsgrad, Hautdicke, Behaarung, Temperatur und Feuchtigkeit,
- von dem kutanen/systemischen Metabolismus der Substanz sowie
- von der elektromagnetischen Strahlung wie Strahlendosis und -dauer bzw. der Wellenlänge (diese bestimmt die Eindringtiefe).
Dabei löst zumeist UV-A-Strahlung die fototoxischen und fotoallergischen Reaktionen aus, während UV-B-Licht überwiegend akute und chronische Schäden der normalen Haut bedingt.
Fotosensibilisierende Arzneistoffe
Obligat fototoxisch wirkende Psoralene (8-Methoxypsoralen) finden Anwendung in der Dermatotherapie, Verteporfin, Porfimer oder Temoporfin werden zur fotodynamischen Behandlung bei altersbedingter Makuladegeneration, nicht-kleinzelligem Bronchialkarzinom und fortgeschrittenem Plattenepithelkarzinom im Kopf- und Halsbereich eingesetzt.
Eine Liste der in Deutschland verwendeten Arzneimittel, über die Berichte zur Fotosensibilisierung existieren, zeigt Tabelle 1.
Stoffgruppe |
Wirkstoffe |
|---|---|
Diuretika |
Hydrochlorothiazid*, Furosemid Amilorid
Triamteren*, Spironolacton Xipamid*
|
nicht-steroidale Antiphlogistika (NSAR) |
Naproxen*, Ketoprofen
Tiaprofensäure
Piroxicam
Diclofenac
Phenylbutazon
Indometacin, Ibuprofen
|
antimikrobielle Substanzen |
Sulfamethoxazol/Trimethoprim*, Sulfasalazin
Ciprofloxacin, Enoxacin
Ofloxacin, Norfloxacin
Oxytetracyclin, Tetracyclin
Doxycyclin, Minocyclin
Isoniazid
Gentamicin
Griseofulvin, Nitrofurantoin
|
Mittel gegen Malaria |
Chloroquin,
Chinin*, Pyrimethamin
Mefloquin
Hydroxychloroquin
|
Antipsychotika |
Thioridazin
Promethazin*
Chlorprothixen
Perazin, Fluphenazin, Promazin
Haloperidol
|
Antidepressiva |
Amitriptylin*, Trimipramin
Nortriptylin
Imipramin, Doxepin
Clomipramin*
|
kardiovaskulär wirksame Substanzen |
Amiodaron, Nifedipin
Chinidin*, Captopril*, Enalapril*
Fosinopril, Ramipril
Hydralazin Simvastatin
|
Antiepileptika |
Carbamazepin*, Lamotrigin
Phenobarbital, Phenytoin
Topiramat, Valproinsäure*
|
Antihistaminika |
Cyproheptadin
Diphenhydramin
Loratadin
|
zytotoxische Substanzen |
Fluorouracil, Vinblastin
Dacarbazin*
Methotrexat
Azathioprin
|
photodynamische Therapie |
Verteporfin, Porfimer, Temoporfin |
Hormone |
Corticosteroide, Östrogene, Progesterone, Spironolacton |
systemische Dermatika |
Isotretinoin, Methoxsalen* (8-Methoxypsoralen*) |
andere |
Goldsalze, Hämatoporphyrin |
*) Diese Wirkstoffe lösen auch fotoallergische Reaktionen aus. | |
Weitere systemisch fototoxisch wirkende Arzneimittel umfassen Tetracycline, Furosemid, Amiodaron, Phenothiazine, Quinolone, NSAR und Fibrate [6 – 8]. Dabei führen Tetracycline häufig zu einer fototoxischen Onycholyse, Amiodaron dagegen neben einer verstärkten Sonnenbrandreaktion bei chronischem Verlauf zu einer meist irreversiblen Pigmentablagerung [9, 10]. Zu klinisch relevanten systemischen Fotoallergenen zählen Sulfonamide, NSAR, Phenothiazine, Hydrochlorothiazid oder Chinidin [11 – 14]. Zu den häufigsten topischen fotoallergenen Substanzen gehören Ketoprofen, Promethazin, Paraaminobenzoesäure- und Zimtsäureester oder Duftstoffe wie 6-Methylcoumarin [15, 16].
Als wichtigste Quellen mit Angaben zu wissenschaftlich validen Publikationen über fotosensibilisierende Arzneistoffe gelten die Datenbank Drugdex oder auch das Drug Eruption Manual [18, 19]. In Deutschland werden Daten zu unerwünschten Arzneimittelwirkungen (UAW) in dem Erfassungssystem des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) und der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) gesammelt, die auf Basis der freiwilligen Meldungen von pharmazeutisch-medizinischem Personal und der Industrie beruhen und somit selten im Rahmen klinischer Studien verifiziert wurden [20]. Freiwillige Meldungen entsprechen zudem häufig nicht dem tatsächlichen Vorkommen von arzneimittelinduzierten Fotosensibilisierungen.
Die Prävalenz fototoxischer oder fotosensibilisierender Reaktionen durch Arzneimittel hängt von dem Fotosensibilisierungspotenzial sowie von der Verordnungshäufigkeit ab. Beispielsweise gilt Hydrochlorothiazid als Diuretikum in Mono- oder Kombinationspräparaten mit sehr hoher Verordnungszahl aber nur mittlerer Sensibilisierungspotenz als Hauptursache für arzneimittelbedingte Lichtsensibilisierung, wohingegen Amiodaron mit wesentlich stärkerem Fotosensibilisierungspotenzial vergleichsweise eine niedrige Anzahl fototoxischer Reaktionen verursacht, da entsprechende Verschreibungen seltener sind [21].
Schmerzgele mit Ketoprofen seit 2012 nicht mehr rezeptfrei!
Ketoprofen zur topischen Anwendung (z. B. Effekton® Gel) darf nach einer entsprechenden Risikoanalyse und Empfehlung der europäischen Behörden sowie anschließenden Befürwortung der Entscheidung durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) in Deutschland nicht mehr rezeptfrei abgegeben werden [17]. Zuvor gab es Berichte über lokale fototoxische und fotoallergische Hautreaktionen durch Ketoprofen, die sich bei gleichzeitiger Anwendung von Sonnenschutzmitteln mit dem UV-Filter Octocrylen verstärkten. Um das Risiko zusätzlich zu minimieren, wurden entsprechende Warnhinweise in die Produktinformation aufgenommen.
Diagnostik
Die abgestufte Belichtung im UV-A- und UV-B-Bereich dient der Diagnostik einer systemischen Fotosensibilisierung, wobei der verdächtige Arzneistoff nicht abgesetzt werden soll. Diese als Lichttreppe bezeichnete Fototestung dient der Bestimmung der Lichtempfindlichkeit der Haut. Dabei werden die zu bestrahlenden Hautareale an einer nicht vorgebräunten und nicht UV-exponierten Stelle mittels einer Schablone mit UV-Strahlen in aufsteigender Dosis bestrahlt, wobei man je nach Hauttyp unterschiedliche Dosierungen wählt. Eine Herabsetzung der UV-Dosis, die ein gerade noch sichtbares, scharf umschriebenes Erythem erzeugt (minimale Erythemdosis, MED) ist charakteristisch für eine systemische Fotosensibilisierung. Normalisiert sich die minimale Erythemdosis nach Absetzen der Medikation, ist eine Fotosensibilisierung wahrscheinlich. Die minimale Erythemdosis ohne Medikation wird mit der MED unter Therapie verglichen; der Quotient ergibt den Fototoxischen Index. Dieses Verfahren ist äußerst sensibel, fordert jedoch einen erheblichen organisatorischen Aufwand [23].
Sollte der Arzneistoff bereits abgesetzt sein, kann dieser erneut appliziert werden, um mithilfe der systemischen Fotoprovokation den potenziellen Fotosensibilisator zu identifizieren (siehe Abbildung 4). Bei dieser Diagnostik wird vor und zu unterschiedlichen Zeitpunkten nach systemischer Administration des Arzneistoffs eine Belichtung an unterschiedlichen Testfeldern an der Haut durchgeführt. Die Zeitpunkte der Bestrahlung sollten sich nach der Pharmakokinetik der Testsubstanz richten. Klinisch auffällige Frühreaktionen können sich durch eine später manifestierende Pigmentierung der Haut zeigen. Bei uneindeutiger Analyse empfiehlt sich eine zusätzliche histopathologische Untersuchung.
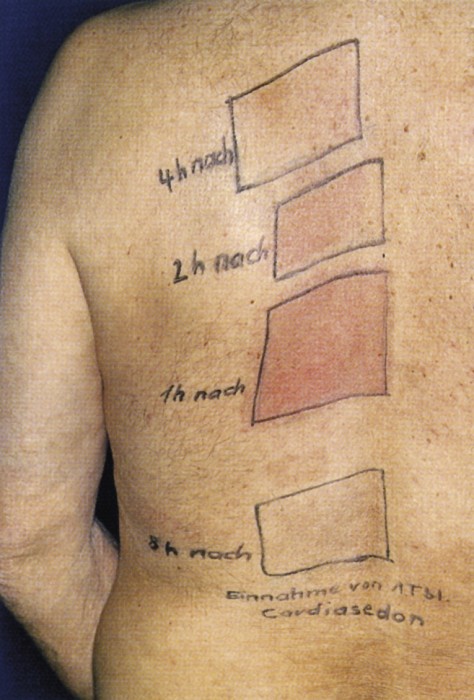
Abb. 4: Systemische FotoprovokationDie Testfelder wurden eine, zwei, vier und acht Stunden nach der Arzneimitteleinnahme (Cardiasedon®, aH, enthielt Phenobarbital und Atropin) mit jeweils 10 J/cm2 UV-A-Licht bestrahlt. Nach 24 Stunden zeigt sich eine deutliche Erythemreaktion in den Feldern, die eine und zwei Stunden nach der Einnahme belichtet wurden. Auch vier Stunden später konnte noch ein geringes Erythem provoziert werden.
Der Fotopatch-Test (belichtete Epikutan-Testung) dient der Feststellung einer vornehmlich topisch vermittelten Fotosensibilisierung durch fotoallergisch oder auch fototoxisch wirkende Arzneistoffe. Dabei werden die potenziellen Substanzen so verdünnt getestet bzw. die UV-A-Strahlung so gering gewählt, dass fototoxische Reaktionen möglichst vermieden werden. Die Applikation der Testsubstanzen erfolgt in doppelter Ausführung am Rücken mittels kleiner Aluminiumkammern. Getrennte Testblöcke ermöglichen eine unbelichtete Dunkelkontrolle, um die Reaktion von einer nicht lichtvermittelten Kontaktsensibilisierung auszuschließen.
PUVA - Fotochemotherapie mit Psoralen und UV-Licht
PUVA steht für eine Kombinationstherapie mit Psoralenen und UV-A-Licht, die in der Dermatologie zur Behandlung von Psoriasis, Neurodermitis oder Vitiligo angewendet wird [5]. Die UV-A-Erstdosis richtet sich dabei nach der individuellen Empfindlichkeit für die fototoxische Reaktion. Psoralene lagern sich nach systemischer oder lokaler Applikation in die DNA kutaner Zellen ein und bilden nicht-kovalente Bindungen. Durch Bestrahlung mit UV-A-Licht gehen diese eine kovalente Bindung mit Pyrimidinbasen ein, wodurch die Zellteilung in der Haut gehemmt und die Pigmentbildung angeregt wird.
Fotodynamische Therapie mit Verteporfin
Die Porphyrinring-haltige Verbindung wird durch Infusion appliziert und reichert sich bevorzugt in den erkrankten Gefäßgebieten an. Mittels thermodynamischem rotem Laserlicht wird Verteporfin aktiviert und bildet reaktive Sauerstoffspezies. Die hieraus resultierende fototoxische Reaktion zerstört die erkrankten Blutgefäße.
Porfimer oder Temoporfin als Zytostatika produzieren in analoger Weise nach Bestrahlung mit rotem Laserlicht reaktiven Singulettsauerstoff. Die Neoangiogenese wird gestoppt, und durch Freisetzung von Cytochrom C gehen Tumorzellen in Apoptose.
Was kann man tun und wie können sich Patienten schützen?
Eine symptomatische Akutbehandlung der betroffenen Hautstellen gelingt mittels stark wirksamer topischer Glucocorticoide, gegebenenfalls in Kombination mit Antiseptika, wenn über die akute Phase hinaus behandelt werden soll. Letzteres dient der Prävention einer nachfolgenden Hyper- oder Hypopigmentierung. Auch empfiehlt sich die regelmäßige Anwendung eines Lichtschutzmittels mit hohem UV-A- und UV-B-Schutz für mehrere Monate. Großflächige Blasen werden analog der Therapie einer Verbrennung zweiten Grades therapiert, inklusive engmaschiger ärztlicher Kontrolle, ggf. Blasenabtragung und Antibiotikatherapie bis hin zu operativer Entfernung toten Gewebes. Bei Melanin-bedingter Hyperpigmentierung eignet sich die Anwendung von Hydrochinon (5%), Hydrocortison (1%) und Tretinoin (0,1%) [24]. In Ausnahmefällen, wie der hartnäckigen Amiodaron- oder Minocyclin-Pigmentierung, ist zudem eine Laserbehandlung angezeigt, um dermale Pigmente abzublassen [25].
Apotheker sollten zudem bei der Abgabe potenziell fotosensibilisierender Arzneistoffe die Patienten auf eine eventuell erhöhte Lichtempfindlichkeit nach Einnahme des Medikaments hinweisen. Die Reaktion kann sofort oder erst verzögert nach einigen Tagen auftreten, weshalb auch Maßnahmen zur Prophylaxe fototoxischer bzw. fotoallergischer Reaktionen erklärt werden sollten [26]. Einerseits können Patienten, nach Rücksprache mit dem behandelnden Arzt, die Arzneimittel mit kurzer Halbwertszeit im Hochsommer vornehmlich abends einnehmen, um eine anschließende, direkte Lichtexposition zu vermeiden. Auch sollte das Sonnenlicht zur Mittagszeit bzw. der Besuch von Solarien gemieden sowie ein potentes Sonnenschutzmittel mit hohem UV-A-Schutz benutzt werden. Da Glas und dünne Kleidung weitgehend UV-B-, nicht jedoch UV-A-Licht abhalten, sind Reaktionen auch bei Sonnenexposition hinter Glasscheiben möglich. Daher sollten entsprechende Textilien mit Lichtschutz getragen und notfalls UV-undurchlässige Folien an Fenstern von Haus und Auto angebracht werden.
Ist die Arzneitherapie auch über längere Zeit unverzichtbar, kann nach Rücksprache mit dem behandelnden Arzt eruiert werden, ob die Dosis gesenkt werden kann, um potenzielle oder bereits erfahrene fototoxische Hautreaktionen zukünftig abzuschwächen oder ganz zu vermeiden.
Und was ist mit Johanniskraut?
Eine ausgeprägte Fototoxizität (sogenannter Hypericismus) wurde bisher nur bei Weidetieren mit hellem Fell beschrieben, die in großen Mengen Johanniskraut fraßen. Die fototoxische Wirkung von Johanniskraut beim Menschen wird jedoch weit überschätzt. Bei den gegen depressive Verstimmungen eingesetzten therapeutischen Dosen als Tablette oder Tee sind keine ernsten Symptome der Fototoxizität zu erwarten. Nur bei extrem hohen Dosen künstlicher Strahlen oder bei erhöhten Dosierungen von Johanniskraut wie zur komplementären antiretroviralen Therapie sind fototoxische Reaktionen häufiger zu beobachten [22].
Schon im Rahmen der Arzneimittelentwicklung erfolgt eine umfassende Risikoanalyse des potenziellen Wirkstoffs, idealerweise auch der fotosensibilisierenden Potenz [27]. In-vitro-Assays an Zellkulturen dienen dabei der Fragestellung, bei welchen Wellenlängenbereichen fototoxische Reaktionen ausgelöst werden können und welche Mechanismen diesen zugrunde liegen. Der Foto-Hühnerei-Test dient ebenfalls der Bestimmung der Fototoxizität und ist als prädiktives In-vivo-Modell etabliert, wobei das Absterben des Embryos nach Exposition mit dem Arzneistoff und Bestrahlung als Endpunkt definiert ist [28].
Sollten diese erwähnten präklinischen Methoden Hinweise auf fotosensibilisierende Eigenschaften des Arzneistoffs erbringen, werden entsprechende Studien auch an gesunden Probanden durchgeführt. Dabei wird unter anderem die MED vor und nach Exposition mit dem Arzneistoff bzw. Placebo geprüft und der fototoxische Index ermittelt, um diesen mit Substanzen mit bekanntem fotosensibilisierendem Potenzial zu vergleichen.
Fazit
Zu den Auslösern einer fototoxischen Reaktion gehören unter anderem Hydrochlorothiazid, Amiodaron, Psoralene oder einige nicht-steroidale Antirheumatika wie Ketoprofen. Dabei sind fototoxische Reaktionen selten gewollt, wie zur lokalen PUVA- oder fotodynamischen Therapie, sondern oftmals als UAW zu verstehen, wobei die individuelle Ausprägung der Fotosensibilität von diversen Faktoren abhängt, inklusive Applikationsart und -ort, tageszeitliche Lichtexposition sowie Metabolisierungskapazität. Eine abwägende Beratung des Patienten hinsichtlich des möglichen Risikos für fototoxische Reaktionen unter Arzneimitteltherapie ist daher besonders wichtig, um einerseits die Compliance nicht zu gefährden und andererseits ernsthafte Folgeschäden zu verhindern. Die Beachtung einiger weniger, jedoch wichtiger Verhaltensmaßnahmen kann das Risiko für fototoxische Reaktionen bereits drastisch senken und sollte daher ein zwingender Bestandteil eines Beratungsgesprächs sein. |
Literatur
[1] Schauder S. Fototoxische Reaktionen der Haut durch Medikamente. Dtsch Ärztebl 2005;102(34–35):A2314–2319
[2] Bergner T, Przybilla B. Fototoxizität. In: Macher E, Kolde G, Bröcker EB: Jahrbuch der Dermatologie – Licht und Haut. Zülpich: Biermann 1993:101–134
[3] Epstein HJ. Fotoxicity and Fotoallergy. Sem Cut Med Surg 1999;18:274–284
[4] Ferguson J. Drug and chemical fotosensitivity. In: Hawk JLM (ed) Fotodermatology, Arnold, London 1999:155-169
[5] Mutschler E et al. Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 10. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart 2013
[6] Stern RS. Fototoxic-reactions to piroxicam and other non-steroidal antiinflammatory agents. N Engl J Med 1983;309:186-187
[7] Schulz KH, Wiskemann A, Wolf K. Klinische und experimentelle Untersuchungen über die fotodynamische Wirksamkeit von Phenothiazinderivaten, insbesondere von Megaphen. Arch Klin Exp Dermatol 1956;202:285-298
[8] Ferguson J, Addo AA, Jones S et al. A study of cutaneous fotosensitivity induced by amiodarone. Br J Dermatol 1985;113:537-549
[9] Frank WB, Cohen JH, Minkin W. Foto-onycholysis due to tetracycline hydrochloride and doxycycline. Archa Derm 1971;103:520-521
[10] Waitzer S, Butany J, Form L et al. Cutaneous ultrastructural changes and fotosensitivity associated with amiodarone therapy. J Am Acad Dermatol 1987;779-787
[11] Wolf R, Dorman B, Krakowski A. Quinidine-induced lichenoid and eczematous fotodermatitis. Dermatologica 1987;174:285-289
[12] Schwartz J, Schwarz-Speck M. Experimentelle Untersuchungen zur Frage der Fotoallergie der Sulfonamide. Dermatologica 1957;114:232-243
[13] Przybilla B, Ring J, Schwab U, Galosi A, Dorn M, Braun-Falco O. Fotosensibilisierende Eigenschaften nichtsteroidaler Antirheumatika im Fotopatch-Test. Hautarzt 1987;38:18-25
[14] Epstein S. Chlorpromazine fotosensitivity; fototoxic and fotoallergic reactions. Arch Dermatol 1968;98:354-363
[15] Epstein S, Rowe RJ. Fotoallergy and fotocross-sensitivity to phenergan. J Invest Dermatol 1957;29:31-326
[16] Leonard F, Adamski H, Bonnevalle A, Bottlaender A et al. The prospective multicenter study on standard fotopatch tests by the French Society of Fotodermatology from 1991-2001. Ann Dermatol Venereol 2005;132:313-320
[17] Wichtige sicherheitsrelevante Informationen für Angehörige der Fachkreise im Zusammenhang mit Ketoprofen-haltigen, topischen Formulierungen, Rote-Hand-Brief, Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), 5. August 2010
[18] Litt JZ. Drug eruption reference manual 2000: the pharmacists guide to drug eruptions and interactions. New York, Parthenon 2000
[19] Malone PM, Melville M, Drugdex® Editorial Staff. Topical Drugs Fotosensitivity. In: Klasco RK (ed.): Drugdex®-System. Thomson Micromedex, Greenwood Village, Colorado 2003, Micromedix
[20] Deutsche UAW-Spontanerfassungssystem, gemeinsame Datenbank von BfArM und AkdÄ
[21] Rappersberger K, Hönigsmann H, Ortel B, Tanew A,Konrad K, Wolff K. Fotosensitivity and hyperpigmentation in amiodarone-treated patients. Incidence, time course and recovery. J Invest Dermatol 1989;93:201–209
[22] Schempp MC, Müller KA, Winghofer B, Schöpf E, Simon JC. Johanniskraut (Hypericum perforatum L.) – eine Pflanze mit dermatologischer Relevanz. Hautarzt 2002;53:316–321
[23] Drummer R. Physikalische Therapiemaßnahmen in der Dermatologie. 2. Auflage, Springer-Verlag, Berlin und Heidelberg, 2006
[24] Neumann NJ, Hölzle E, Lehmann P. Leitlinie fototoxische und fotoallergische Reaktionen. JDDG 2004;(2)8:710–716
[25] Karrer S, Hohenleutner U, Szeimies RM, Landthaler M. Amiodarone-induced pigmentation resolves after treatment with Q-switched Laser. Arch Dermatol 1999;135:251–252
[26] Moore DE. Drug-induced cutaneous fotosensivity: incidence, mechanism, prevention and managment. Drug Saf 2002;25:345–347
[27] Ferguson J. Fotosensitivity due to drugs. Photodermatol Photoimmunol Photomed 2002;18:262–269
[28] Neumann NJ, Hanneken S, Ruzicka T, Lehmann P. Fototoxicity of exogenous protoporphyrin IX and Laminolevulinic acid in the foto hen‘s egg test. Photodermatol Photoimmunol Photomed 2004;20:224–229
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.