
- DAZ.online
- DAZ / AZ
- DAZ 2/2016
- Die Auswahl des ...
Klinische Studien
Die Auswahl des richtigen Studientyps
Klinische Studien und ihre Bewertung, Teil 1
Welcher Studientyp ist der richtige?
Ganz allgemein lässt sich sagen, dass jeder Studientyp Vor- und Nachteile bietet und daher der „richtige“ vor allem von der Fragestellung abhängt, die in der jeweiligen Studie beantwortet werden soll [2] (s. Tab. 1). Wenn beispielsweise ein neuer Wirkstoff klinisch geprüft werden soll, wird er bei einer Patientengruppe angewendet (Interventionsgruppe, auch Verum-Gruppe), während eine andere Patientengruppe die Standardmedikation oder ein Placebo erhält (Vergleichsgruppe, Kontrollgruppe). Damit der Wirkunterschied möglichst sicher auf das neue Medikament zurückgeführt werden kann, ist es von entscheidender Bedeutung, dass die beiden Gruppen eine größtmögliche Ähnlichkeit aufweisen [1].
Studientyp |
Fragestellung |
|---|---|
|
Randomisierte kontrollierte Studie
(RCT)
|
Eignung eines Arzneistoffs zur
|
Kohortenstudie |
|
Fall-Kontroll-Studie |
|
Querschnittsstudie |
|
Systematische Fehler (sog. Bias), die das Ergebnis zusätzlich beeinflussen, können in jedem Stadium einer Studie vorkommen und müssen vermieden bzw. minimiert werden. Beispiele für verschiedene Biasquellen sind in Tabelle 2 dargestellt. In Abhängigkeit vom Studientyp kann in unterschiedlichem Ausmaß ein Bias vermieden werden [6].
Bias |
Definition |
Beispiele |
Mögliche Lösung |
|---|---|---|---|
Zuteilungsbias (selection bias) |
ungleiche Verteilung der Patienten auf die Gruppen |
|
Randomisierung |
Behandlungsbias (performance bias) |
ungleiche Versorgung der Patienten im Studienverlauf |
|
Verblindung |
Verschleißbias (attrition bias) |
ungleicher Verlust von Patienten im Studienverlauf |
|
Intention-to-treat-Analyse |
Detektionsbias (detection bias) |
ungleiche Bewertung der Endpunkte |
|
Verblindung |
Welche Studientypen gibt es?
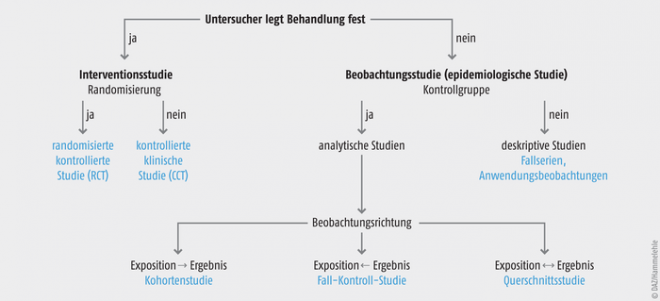
Einen Überblick über die verschiedenen Studientypen gibt Abbildung 1. Grundsätzlich sind interventionelle (experimentelle) von nicht-interventionellen (beobachtenden) Studien zu unterscheiden [1]. Bei einer Beobachtungsstudie wird die Therapie vom Arzt bzw. Patient festgelegt. Bei Interventionsstudien dagegen werden die Patienten gemäß dem Studienprotokoll entweder der Interventionsgruppe oder der Kontrollgruppe zugeteilt. Patient und Arzt haben also keinen Einfluss auf die Therapie.
Interventionsstudien
Randomisierte kontrollierte Studie (RCT): Bei diesem Studientyp wird die Intervention (z. B. ein neues Arzneimittel) mit einer Kontrolle (z. B. Placebo oder Standardtherapie) verglichen. Die Patienten werden nach dem Zufallsprinzip einer der Gruppen zugeordnet (= Randomisierung), um eine möglichst gleichartige Zusammensetzung der Gruppen zu erzielen und einen Zuteilungsbias zu vermeiden [5]. Entscheidend ist, dass die Randomisierung auch wirklich zufällig geschieht und weder für den Arzt noch für den Patienten vorhersehbar ist (s. Kasten). Dies wird auch „verdeckte Zuteilung“ (engl. concealment of allocation) genannt [8]. Um die Qualität der Randomisierung beurteilen zu können, sollte das gewählte Verfahren nachvollziehbar beschrieben sein [9]. Mithilfe einer Tabelle über demografische und klinische Charakteristika der Probanden in den einzelnen Gruppen lässt sich diesbezüglich die Ähnlichkeit der Gruppen abschätzen.
Weitere systematische Fehler – ein Behandlungs- und Detektionsbias – können durch eine Verblindung vermieden werden [5]. Bei einer einfachen Verblindung weiß der Patient nicht, welche Therapie er erhält; bei doppelter Verblindung wissen es weder der Patient noch der Arzt bzw. Untersucher. Auf diese Weise kann sichergestellt werden, dass im Studienverlauf auf die Interventions- und Kontrollgruppe die gleichen Rahmenbedingungen zutreffen. So wird die Adhärenz des Patienten oder die Messung eines subjektiven Endpunktes (z. B. Einschätzung der Schmerzintensität mittels Schmerzskala) nicht beeinflusst. Im Umkehrschluss bedeutet dies: Wenn keine Verblindung möglich ist, sollten möglichst objektive (nicht subjektiv beeinflussbare) Endpunkte gewählt werden (z. B. HbA1c -Wert). Eine Verblindung ist z. B. unmöglich oder sehr schwierig, wenn der Arzneistoff einen starken Geruch hat oder auffällige Nebenwirkungen verursacht. Auch eine intensivere pharmazeutische Betreuung ist nicht verblindbar. Um die Qualität der Verblindung abschätzen zu können, sollte die Art der Verblindung in der Studie beschrieben sein [9]. Liegt keine Verblindung vor, spricht man von einer offenen (open-label) Studie.
Aufgrund der beschriebenen Möglichkeiten, systematische Verzerrungen zu minimieren, wird die randomisierte klinische Studie als „Goldstandard“ für den Nachweis von Wirksamkeit und Verträglichkeit von Arzneimittel und Therapie angesehen [9]. Mit anderen Worten: Andere Studientypen haben für diese Fragestellung eine wesentlich geringere Aussagekraft und sollten nur in gut begründeten Ausnahmefällen Verwendung finden (vgl. die Evidenzgrade in Tab. 3).
Grad |
Studientyp, Publikation usw. |
|---|---|
1a |
systematischer Review von randomisierten kontrollierten Studien mit homogenen Studienergebnissen |
1b |
randomisierte kontrollierte Studien mit kleinem Konfidenzintervall |
2a |
systematischer Review von Kohortenstudien mit homogenen Studienergebnissen |
2b |
Kohortenstudien (und randomisierte kontrollierte Studie geringer Qualität) |
3a |
systematischer Review von Fall-Kontroll-Studien mit homogenen Studienergebnissen |
3b |
Fall-Kontroll-Studie |
4 |
Fallserie (und Kohortenstudie/Fall-Kontroll-Studie geringer Qualität) |
5 |
Expertenmeinung aufgrund von Grundlagenwissen (Physiologie, Wirkmechanismen u. a.) |
Zu den Kritikpunkten an randomisierten klinischen Studien gehört, dass die künstliche Studiensituation nicht mit den Alltagsbedingungen der Patienten übereinstimmt, denn die Adhärenz der Patienten und die ärztliche Betreuung sind höher als es im normalen Praxisalltag der Fall wäre. Ein weiterer Nachteil sind die sehr hohen Kosten dieser Studien [2, 12].
Randomisierte kontrollierte Studien dienen vor allem der Zulassung neuer Arzneimittel. Zudem dienen sie der Optimierung von etablierten Pharmakotherapien. Hier zwei Beispiele:
Auswirkung verschiedener ASS-Dosierungen auf die Rate kardiovaskulärer Ereignisse bei Patienten mit kardiovaskulärer Erkrankung,
Reduzierung mikrovaskulärer Komplikationen bei Patienten mit Diabetes Typ 2 durch eine intensivierte konventionelle Insulintherapie versus konventioneller Insulintherapie.
Warum ist Randomisierung wichtig? – ein Beispiel
In Beobachtungsstudien zur Hormonersatztherapie (HRT) wurde (neben anderen positiven Wirkungen) ein protektiver kardiovaskulärer Effekt gezeigt. Als Folge wurde die HRT auch Frauen ohne Wechseljahrsbeschwerden empfohlen [10]. Durch randomisierte kontrollierte Studien wurde der protektive Effekt allerdings widerlegt. Warum kamen die Beobachtungsstudien und die randomisierten kontrollierten Studien zu unterschiedlichen Ergebnissen? Erklären lässt sich dies wahrscheinlich durch die Unterschiede zwischen Frauen, die eine HRT anwenden, und denen, die dies nicht tun. Erstere haben im Durchschnitt einen höheren sozioökonomischen Status, der mit einem geringeren Risiko für kardiovaskuläre Erkrankungen assoziiert ist [11]. Wird dieser Unterschied im Basisrisiko bei der Auswertung der Beobachtungsstudie nicht berücksichtigt, so wird das Ergebnis zugunsten der HRT verzerrt! Dagegen werden bei randomisierten kontrollierten Studien die Risikofaktoren – auch unbekannte – auf die verschiedenen Gruppen gleichmäßig verteilt.
Cross-over-Design
Falls nicht besonders vermerkt, werden kontrollierte Studien im Paralleldesign durchgeführt, d. h. die Patienten bleiben im ganzen Studienverlauf in ihrer Gruppe. Beim Cross-over-Design hingegen werden die Patienten der Interventions- und Vergleichsgruppen nach einer „Wash-out-Phase“ getauscht: Die ursprüngliche Interventionsgruppe erhält nun die Vergleichsmedikation (oder das Placebo), die Kontrollgruppe das Verum. So ist ein intraindividueller Vergleich möglich, und dadurch reichen kleinere Patientenzahlen aus, um aussagekräftige Ergebnisse zu erhalten [12]. Allerdings kann dieser Studientyp nur bei wenigen Fragestellungen bzw. Rahmenbedingungen angewendet werden: So darf die Intervention nicht zur Heilung führen, und die Erkrankung muss über die Zeit der Studie relativ konstant sein. Die Wash-out-Phase muss so lang sein, dass die Ergebnisse der zweiten Therapie nicht durch die vorgehende Behandlung beeinflusst werden [13]. Hier zwei Beispiele für Studien mit Cross-over-Design:
- Cannabinoide als Schmerzmittel bei Patienten mit multipler Sklerose,
- Wirkung von Duloxetin bei Patienten mit Chemotherapie-induzierter Polyneuropathie.
Beobachtungsstudien
Auch Beobachtungsstudien können eine Art Verum-Gruppe (Exponierte) mit einer Kontrollgruppe (Nicht-Exponierte) vergleichen, allerdings werden die Studienteilnehmer – im Gegensatz zu einer Interventionsstudie – nicht vom Studienleiter den Gruppen zugeteilt, sondern ihre Exposition oder Nicht-Exposition steht schon fest. Die Teilnehmer werden beobachtet und ihre Daten gesammelt [1]. Langfristige Beobachtungsstudien sind Längsschnittsstudien; zu ihnen gehören die Kohortenstudien und die Fall-Kontroll-Studien.
Kohortenstudien
Kohortenstudien untersuchen eine (oft sehr große) Gruppe von Personen mit einem gemeinsamen Merkmal (z. B. die Exposition eines potenziellen Schadstoffs) im Vergleich mit einer Gruppe ohne dieses Merkmal. Sie eignen sich gut, um Ursachen und Risikofaktoren von Erkrankungen sowie Krankheitsverläufe zu untersuchen, und werden oft über Jahre und teilweise Jahrzehnte hinweg durchgeführt [3]. Zudem kommen sie zum Einsatz, wenn randomisierte kontrollierte Studien aus ethischen Gründen nicht durchführbar sind, z. B. bei der Fragestellung, ob Übergewicht das Risiko für eine Krebserkrankung erhöht. Nachteilig an diesem Studientyp ist, dass meistens eine strukturelle Ungleichheit der Gruppen besteht. Zwar können bekannte Störfaktoren (engl. Confounder, s. Kasten) bei der Auswertung berücksichtigt und „herausgerechnet“ werden, doch die Existenz von unbekannten Störfaktoren kann nicht ausgeschlossen werden [14].
Beispiele für Kohortenstudien:
Welche Risikofaktoren und Umwelteinflüsse erhöhen das Risiko, an einer koronaren Herzkrankheit oder Arteriosklerose zu erkranken?
Erhöht Rauchen das Risiko für Lungenkrebs?
Was sind Confounder?
Confounder sind Störfaktoren, die sowohl mit der Intervention/Exposition als auch mit der Zielgröße assoziiert sind und dadurch bei der Interpretation des Ergebnisses „verwirren“ [15]. Untersucht man z. B., ob der Rang eines Kindes in der Geschwisterfolge die Wahrscheinlichkeit für Trisomie 21 (Down-Syndrom) beeinflusst, so scheint es hier einen Zusammenhang zu geben. Das jüngere Kind hat ein höheres Risiko als seine älteren Geschwister. Berücksichtigt man aber das Alter der Mutter während der Geburt, so zeigt sich, dass dies die wahrscheinliche Ursache ist [16].
Ein weiteres Beispiel ist der Einfluss von Kaffeekonsum auf die Mortalität. Eine Beobachtungsstudie ergab, dass mit steigendem Kaffeekonsum die Mortalität ansteigt [17]. Werden bei der statistischen Auswertung jedoch verschiedene Confounder, z. B. Rauchen, berücksichtigt, so zeigt sich sogar ein gegenteiliger Effekt! Allerdings machen die Autoren deutlich, dass auch hier nicht sicher gefolgert werden kann, dass der Kaffeekonsum für dieses Ergebnis ursächlich ist und nicht etwa weitere unbekannte Confounder.
Fall-Kontroll-Studien
Eine Fall-Kontroll-Studie wird für ähnliche Fragestellungen wie die Kohortenstudie eingesetzt; sie geht jedoch vom Ergebnis/Ereignis aus (meist eine bestimmte Erkrankung) und sucht retrospektiv („rückwärts blickend“) nach dessen möglichen Ursachen; zudem kann sie prospektiv („vorwärts blickend“) die weitere Entwicklung des Ereignisses beobachten. Um eine Kontrollgruppe zu bilden, werden den Patienten („Fälle“) gesunde Personen gegenübergestellt, die möglichst ähnliche Merkmale aufweisen (z. B. Alter, Geschlecht, sozialer Hintergrund). Trotzdem bleibt die Strukturgleichheit zwischen der Fallgruppe und der Kontrollgruppe unsicher. Zudem ist bei retrospektiven Studien die Datensammlung fehleranfällig, denn die Patientenakten können lückenhaft sein, oder die Patienten können Sachverhalte fehlerhaft wiedergeben [14]. Die Evidenzstufe der Fall-Kontroll-Studien ist daher recht niedrig. Sie eignen sich, um noch unbekannte Ursachen von Erkrankungen und relativ seltene Nebenwirkungen von Arzneimitteln aufzudecken [2].
Beispiele für Fall-Kontroll-Studien:
- Welche Faktoren erhöhen das Risiko für einen plötzlichen Kindstod?
- Kann Autismus durch eine Masern-Mumps-Röteln-Impfung ausgelöst werden?
- Welchen Einfluss hat Alkoholkonsum in der Schwangerschaft auf die anomale Entwicklung des Kindes?
Querschnittsstudien
Querschnittsstudien sind „Momentaufnahmen“, die die zu untersuchenden Merkmale nur an einem Zeitpunkt erfassen [3] und nicht über einen Zeitabschnitt wie die bisher vorgestellten Studientypen. Da zeitliche Aspekte vernachlässigt werden, ist eine kausale Aussage über Exposition und Wirkung nicht möglich [14]. Dieser Studientyp wird z. B. zur Untersuchung von Krankheitshäufigkeiten eingesetzt [3].
Beispiele für Querschnittsstudien:
- Sind elektromagnetische Felder von Mobilfunkbasisstationen mit gesundheitlichen Beeinträchtigungen assoziiert?
- Wie häufig sind psychiatrische Erkrankungen bei Kindern und Jugendlichen in Deutschland?
Fallberichte und Fallserien
Bei Fallberichten handelt es sich um Berichte von einzelnen Patientenfällen, die in Fallserien zusammengefasst sein können. Selbst dann ist die Patientenzahl sehr klein und eine Verallgemeinerung der Beobachtungen ist praktisch nicht möglich [14]. Früher war es üblich, Arzneimittel oder Therapien durch Fallberichte zu bewerben; heute gilt dies als unseriös und ist typisch für sogenannte Wundermittel. Sehr bedeutsam sind Fallberichte und -serien für die Dokumentation von seltenen unerwünschten Arzneimittelwirkungen, die in Studien aufgrund einer niedrigen Inzidenz nicht entdeckt werden [2].
Beispiele für Fallberichte:
- Meldung unerwünschter Arzneimittelwirkungen bei der Arzneimittelkommission.
- Embryotox (Pharmakovigilanz- und Beratungszentrum für Embryonaltoxikologie) nutzt Fallberichte, um Auswirkungen der Arzneimitteleinnahme von Schwangeren und Stillenden zu erfassen.
Anwendungsbeobachtungen
Anwendungsbeobachtungen sind „Untersuchungen, die dazu bestimmt sind, Erkenntnisse bei der Anwendung zugelassener oder registrierter Arzneimittel zu sammeln“ (AMG § 67, Abs. 6). Dies geschieht – meist auf Veranlassung des Herstellers – multizentrisch in Arztpraxen oder Kliniken, wo Ärzte die Patienten mit dem jeweiligen Arzneimittel behandeln und Beobachtungsprotokolle ausfüllen. Welcher Patient eingeschlossen wird, liegt in der Hand des behandelnden Arztes. Anwendungsbeobachtungen werden oft kritisch gesehen: Da die Ärzte für den Dokumentationsaufwand finanziell entschädigt werden, besteht die Gefahr, dass die Hersteller diese Methode als Marketingstrategie missbrauchen. Aus diesem Grund muss die Durchführung u. a. der zuständigen Bundesoberbehörde (Bundesinstitut für Arzneimittel und Medizinprodukte bzw. Paul-Ehrlich-Institut) gemeldet werden. Geeignet sind Anwendungsbeobachtungen, um Informationen zum Verschreibungsverhalten der Ärzte oder zur praktischen Arzneimittelanwendung der Patienten zu bekommen [13]. |
Die nächste Folge
Teil 2: Qualitätskriterien und Anwendbarkeit von RCT
Literatur
[1] Röhrig B et al. Studientypen in der medizinischen Forschung. Dtsch Ärztebl Int 2009;106(15):262-8
[2] Greenhalgh T. Sich zurechtfinden – worum geht es in diesem Artikel? In: Einführung in die evidenzbasierte Medizin. 3. Auflage; Verlag Hans Huber 2015, 55-74
[3] Günther J. Arzneimittelstudien – Welche Aussagekraft steckt in publizierten Daten? Mehr Schein als Sein? Fortbildungstelegramm Pharmazie 2007;1:75-87
[4] Greenhalgh T. Wurden systematische Fehler vermieden oder minimiert? In: Einführung in die evidenzbasierte Medizin. 3. Auflage; Verlag Hans Huber 2015, 81-85
[5] Hinneburg I. Qualitätskriterien im Design von randomisierten kontrollierten Studien, in: Klinische Studien kritisch lesen. Wissenschaftliche Verlagsgesellschaft Stuttgart 2015; 19-25
[6] Hinneburg I. Evidenzhierarchien, in: Klinische Studien kritisch lesen. Wissenschaftliche Verlagsgesellschaft Stuttgart 2015; 14
[7] Oxford Centre for Evidence-based Medicine. Levels of Evidence (March 2009); www.cebm.net/oxford-centre-evidence-based-medicine-levels-evidence-march-2009
[8] Günther J. Randomisierung, in: Anleitung zur Bewertung klinischer Studien. Deutscher Apotheker Verlag Stuttgart 2001, 144-145
[9] Moher D et al. CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomized trials. BMJ 2010;340:c869
[10] Humphrey LL. Postmenopausal Hormone Replacement Therapy and the Primary Prevention of Cardiovascular Disease. Ann Intern Med 2002;137:273-284
[11] von Elm E, Egger M. The scandal of poor epidemiological research. BMJ 2004;329:868-9
[12] Oxford Centre for Evidence-based Medicine. Study Designs; www.cebm.net/study-designs
[13] Günther J. Studienarten, in: Anleitung zur Bewertung klinischer Studien. Deutscher Apotheker Verlag Stuttgart 2001, 20-43
[14] Hinneburg I. Unterschiede zwischen den Studientypen, in: Klinische Studien kritisch lesen. Wissenschaftliche Verlagsgesellschaft Stuttgart 2015; 8-12
[15] Cochrane Deutschland. Cochrane-Glossar; www.cochrane.de/de/cochrane-glossar
[16] Stark CR, Mantel N. Effects of Maternal Age and Birth Order on the Risk of Mongolism and Leukemia. J Natl Cancer Inst 1966;37:687-698
[17] Freedman ND et al. Association of Coffee Drinking with Total and Cause-Specific Mortality. N Engl J Med 2012;366:1891-1904






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.