
- DAZ.online
- DAZ / AZ
- DAZ 13/2016
- Den Cholesterol-Spiegel ...
Lipidsenker
Den Cholesterol-Spiegel senken
Über die Pharmakologie der Statine, Fibrate und Co.
In der westlichen Welt sind Dyslipidämien von großer klinischer Relevanz. Neben Arteriosklerose, Diabetes mellitus, Hypertonie und Zigarettenkonsum gelten sie als Hauptursache von kardiovaskulären Erkrankungen, der weltweit häufigsten Krankheits- und Todesursache. Hypercholesterolämien als Folge einer Vermehrung der LDL-Lipoproteine im Plasma gelten als Risikofaktor für die koronare Herzkrankheit (KHK) [1]. Zur Prävention von Herz-Kreislauf-Erkrankungen werden in Behandlung der gestörten Blutfettwerte (Dyslipidämien, Dyslipoproteinämien) Lipidsenker erfolgreich eingesetzt. Die Therapieziele orientieren sich dabei am Gesamtrisiko des Patienten. Dieses setzt sich zusammen aus persönlichem Alter und Geschlecht sowie individuellen Risikofaktoren wie Gesamt-, LDL- bzw. HDL-Cholesterol, Komorbiditäten und genetischer Belastung.
Fettstoffwechselstörungen werden traditionell nach Fredrickson nach Art der Lipid- bzw. Lipoprotein-Veränderung unterteilt und können ätiologisch primäre und/oder sekundäre Ursachen haben. Vor der Diagnose von primären Dyslipidämien müssen daher sekundäre Ursachen, wie Diabetes mellitus sowie Nieren-, Leber- oder Schilddrüsenerkrankungen, ausgeschlossen werden. Die alleinige Bestimmung der Gesamtcholesterol-Konzentration reicht zur vollständigen Beurteilung des Risikos für Arteriosklerose sowie zur Ableitung von Therapieentscheidungen jedoch nicht aus. Es ist in jedem Fall erforderlich, die LDL-Cholesterol-, HDL-Cholesterol- als auch Triglycerid-Konzentration zu bestimmen. Auch bei Erreichen eines Zielwerts für das Gesamt-Cholesterol liegt ein erhöhtes Arteriosklerose-Risiko vor, wenn beispielsweise das HDL-Cholesterol unter der Konzentration von 40 mg/dl verbleibt.
Konkretes Behandlungsziel festlegen
Zur Therapie der Fettstoffwechselstörungen ist zunächst das Behandlungsziel zu definieren, wobei hiernach vorrangig LDL-Cholesterol-Zielwerte festgesetzt werden. Das Ausmaß der individuellen Gefährdung für Herz-Kreislauf-Erkrankungen lässt sich, wie bereits zuvor erwähnt, anhand der jeweiligen Risikofaktoren, wie Alter, Geschlecht oder Rauchverhalten, abschätzen. Die Stratifizierung des Zehn-Jahres-Risikos für kardiovaskuläre Ereignisse wird dabei mittels SCORE-Charts (Systematic Coronary Risk Evaluation-Chart) ermittelt. Für die höchste Risikogruppe findet sich in den aktuellen Leitlinien der European Society of Cardiology (ESC) und der European Atherosclerosis Society (EAS) ein LDL-Cholesterol-Zielwert von unter 70 mg/dl (1,8 mmol/l), oder alternativ eine Senkung um über 50%. Bei Hypertriglyceridämien gilt ein Zielwert von unter 150 mg/dl (1,70 mmol/l) [2]. Die im November 2013 veröffentlichte Leitlinie der American Heart Association und des American College of Cardiology (AHA/ACC) zur lipidsenkenden Therapie verfolgt dagegen nicht mehr die Strategie der individuellen, risikoadaptierten LDL-Cholesterol-Zielwerte, wie sie noch in den aktuellen europäischen Leitlinien zu finden sind, sondern einer festen Dosis, vornehmlich von Statinen, ohne Berücksichtigung der erreichten Lipidwerte, was sich in der Potenz der verfügbaren Lipidsenker widerspiegelt [3].
Die klinische Wirksamkeit von medikamentösen sowie nicht-medikamentösen Maßnahmen konnte in nahezu allen Interventionsstudien nachgewiesen werden. Je höher das Gesamtrisiko und je effektiver die LDL-Cholesterol-Senkung, umso effektiver war der Einfluss auf den Verlauf der KHK. Zur Behandlung gehört eine umfassende Patientenberatung, die sich nicht auf die Fettstoffwechselstörung allein beschränken sollte. Regelmäßige körperliche Aktivität, der Ersatz gesättigter durch ein- oder mehrfach ungesättigte Fettsäuren, eine Erhöhung des Ballaststoffanteils und im Falle von Übergewicht eine anhaltende Gewichtsreduktion sind ebenso empfehlenswert wie Alkoholkarenz zur Senkung hoher Triglycerid-Konzentrationen.
Sollten Änderungen der Lebensgewohnheiten nicht effektiv genug sein, ist eine Pharmakotherapie indiziert, wobei körperliche Aktivität sowie die Umstellung der Ernährung beibehalten werden sollten. Bei Patienten mit nachgewiesener arteriosklerotischer Manifestation sollte frühzeitig eine Therapie mit Statinen, Mittel der ersten Wahl zur Senkung der LDL-Cholesterol-Werte, begonnen werden. Die Evidenz für eine Prävention mit Statinen ist klar belegt und in zahlreichen großen Studien überprüft. Die Marktrücknahme von Cerivastatin (Lipobay®) im Jahr 2001 aufgrund letaler Rhabdomyolysen zeigt jedoch, weshalb weiterhin gefordert wird, die pleiotropen Wirkungen sowie vielfältigen unerwünschten Arzneimittelwirkungen (UAW) kritisch zu hinterfragen.
Statine
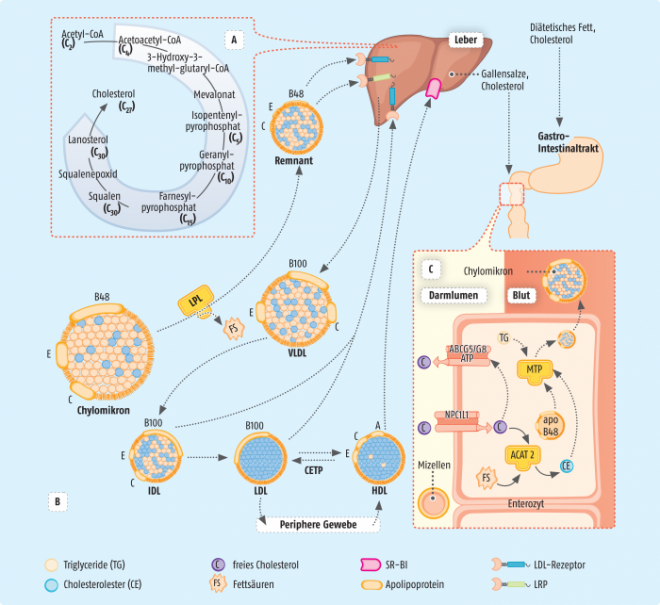
1987 wurde mit Lovastatin (Mevinacor®), isoliert aus dem Bodenpilz Aspergillus terreus, der erste Hydroxy-methyl-glutaryl-CoA (HMG-CoA)-Reduktase-Inhibitor zugelassen. Derzeit finden sich mit Simvastatin (z. B. Zocor®), Pravastatin (z. B. Lipifacil®), Fluvastatin (z. B. Locol®), Atorvastatin (z. B. Sortis®) und Rosuvastatin (z. B. Crestor®) zahlreiche weitere Analogpräparate im Handel. In der Gruppe der Lipidsenker haben Statine andere Arzneimittelklassen wie Fibrate oder Anionenaustauscherharze abgehängt, und auch die Verordnungszahlen von Statinen in Deutschland steigen stetig an [4]. Statine hemmen das Schlüsselenzym der endogenen Cholesterol-Biosynthese, welches HMG-CoA in Mevalonat überführt (siehe Abbildung 1, A) [5]. Sinkt hierdurch die intrazelluläre Cholesterol-Konzentration, stehen vermehrt LDL-Rezeptoren zur Aufnahme zirkulierenden LDL-Cholesterols zur Verfügung. Der Abbau von LDL sowie der Vorläufer VLDL und IDL wird beschleunigt und zusätzlich die Bildung von HDL verstärkt. Die dosisabhängige Senkung des Gesamt- sowie LDL-Cholesterols liegt bei etwa 30 bis 50%, Triglyceride nehmen um 5 bis 10% ab [6]. Die therapeutischen Effekte der Statine definieren sich jedoch nicht allein über die Hemmung der HMG-CoA-Reduktase, sondern auch über vielfältige weitere Mechanismen, die als pleiotrope Effekte bekannt sind. Hierzu gehört die Beeinflussung der Endothelfunktion, der Blutgerinnungsparameter, des Knochenstoffwechsels und Entzündungsreaktionen bis hin zu einer möglichen Prävention von Morbus Alzheimer. Jedoch sind in vielen Fällen relevante Daten nur aus retrospektiven Studien erhoben worden, weshalb Ergebnisse prospektiver Studien abzuwarten sind.
[Mutschler E et al. Arzneimittelwirkungen - Pharmakologie - Klinische Pharmakologie - Toxikologie. Wissenschaftlich Verlagsgesellschaft Stuttgart, 10. Auflage 2013]
Nach oraler Administration werden Statine nur teilweise resorbiert. Die Adsorption von Lovastatin und Simvastatin wird durch gleichzeitige Nahrungsaufnahme verbessert. Diese sollten deshalb mit den Mahlzeiten, Pravastatin hingegen nüchtern eingenommen werden. Auf die anderen Statine hat die Nahrungsaufnahme dagegen keine klinisch relevanten Effekte. Dabei stellen Lovastatin sowie Simvastatin inaktive Prodrugs dar, die in ihrer Lacton-Struktur zunächst hepatisch in die ringoffene Form überführt und somit biologisch aktiviert werden. Die Bioverfügbarkeit der einzelnen Substanzen ist teilweise sehr unterschiedlich und schwankt zwischen 5 und 30%. Die Plasmahalbwertszeit der Statine liegt generell im Bereich weniger Stunden, mit Ausnahme von Atorvastatin und Rosuvastatin (über zehn Stunden). Da die Expression der HMG-CoA-Reduktase einem zirkadianen Rhythmus unterliegt, wird der höchste Effekt bei abendlicher Einnahme erzielt. Dieser Effekt konnte für Atorva-statin und Rosuvastatin jedoch nicht festgestellt werden, was vermutlich an der höheren Halbwertszeit liegt.
Bis auf Pravastatin, welches durch Sulfatierung ausgeschieden wird, werden alle Statine in der Leber mittels CYP3A4 bzw. CYP2C9 (Fluvastatin, Rosuvastatin) metabolisiert und unterliegen so einem ausgeprägten First-pass-Effekt bzw. besitzen entsprechendes Interaktionspotenzial. Warfarin und Phenprocoumon stellen ebenso Substrate des CYP2C9 dar, weshalb Auswirkungen auf deren Plasmaspiegel nicht auszuschließen sind [7]. Für Simvastatin, Lovastatin und Atorvastatin sind Wechselwirkungen mit Makroliden, Calcium-Antagonisten, Benzodiazepinen, Johanniskraut oder Grapefruitsaft möglich. Die Ausscheidung erfolgt nach hepatischer Transformation hauptsächlich über die Galle. Bei Patienten mit Leberzellschaden oder Erhöhung von Transaminasen ist eine Dosisanpassung erforderlich. Eine eingeschränkte Nierenfunktion macht vor allem bei Pravastatin, welches mit 20% die höchste renale Elimination aufweist, eine Dosisanpassung erforderlich.
Die therapeutische Potenz der Statine wird häufig anhand der prozentualen Senkung des LDL-Cholesterols beschrieben (Tabelle 1). Bei Statinen gilt, dass eine Verdopplung der Dosis eine weitere Senkung des LDL-Cholesterols um 6% bewirkt. Dabei steigt jedoch auch das Nebenwirkungsrisiko. Die ESC Pocket Leitlinie weist Rosuvastatin und Atorvastatin als die potentesten Statine aus, mit denen Reduktionen der LDL-Cholesterol-Werte von über 50% vermittelt werden [8]. Das bedeutet, dass diese Vertreter die alternativen Zielwerte der LDL-Cholesterol-Senkung von > 50% bei Hochrisikogruppen erreichen können.
Statin |
Halbwertszeit [h] |
Bioverfügbarkeit [%] |
CYP 450 Metabolismus |
renale Exkretion [%] |
|---|---|---|---|---|
Simvastatin |
2 |
5 |
3A4 |
13 |
Atorvastatin |
14 |
12 |
3A4 |
< 5 |
Pravastatin |
2 |
18 |
wenig |
20 |
Fluvastatin |
1 |
24 |
2C9 |
6 |
Lovastatin |
3 |
5 |
3A4 |
10 |
Rosuvastatin |
19 |
20 |
wenig |
10 |
Achtung Muskelschmerzen!
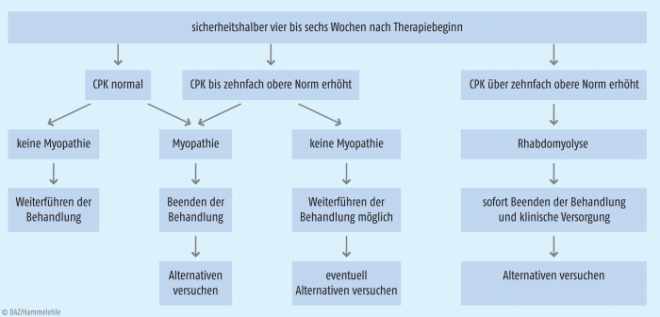
Muskelschmerzen, meistens symmetrisch am Oberschenkel oder Schultergürtel, gehören zu den bekanntesten und häufigsten unerwünschten Wirkungen der Statine [9]. Die seltene Statin-assoziierte Myopathie bezeichnet eine Muskelerkrankung mit Muskelschmerzen, Schwäche oder Krämpfen und einer gleichzeitigen Erhöhung der Kreatinphosphokinase(CPK)-Konzentration im Blut bis zum Zehnfachen der oberen Referenzgrenze. Die gefährlichste Komplikation der Statin-Therapie stellt die Rhabdomyolyse dar, ein Untergang von quergestreifter Muskulatur mit exzessiver CPK-Erhöhung (> zehnfach) und Anstieg des Serum-Kreatinins durch myoglobinurische Nephropathie [10]. Diese schwere, jedoch seltene UAW wird mit 0,44 Fällen pro 10.000 Patientenjahre beziffert, tritt jedoch besonders bei sehr hoher Statin-Dosierung und bei Patienten mit meist identifizierbaren weiteren Risikofaktoren auf [11]. Hierzu gehören geringes Körpergewicht, hohes Alter, Multimorbidität, exzessive Muskelarbeit, Hypothyreose sowie genetische Hintergründe. Aber auch Komedikationen, besonders mit Fibraten, Makrolid-Antibiotika, Amiodaron oder Verapamil, erhöhen die Plasma-Statin-Spiegel durch Interaktion mit CYP3A4 bzw. CYP2C9, wodurch ein deutlicher Anstieg des Risikos für Rhabdomyolysen resultiert. Da sich die verschiedenen Formen der Statin-assoziierten Myopathien über den Anstieg der CPK definieren, berücksichtigen internationale Empfehlungen die CPK-Spiegel durch Blutentnahmen vier bis sechs Wochen nach Beginn einer Statin-Behandlung oder nach Dosissteigerung (siehe Abb. 2).
Abb. 2: Möglicher Algorithmus zur Diagnostik und zum klinischen Management der Statin-assoziierten Muskelprobleme [11]
Hepato- bzw. Myotoxizität sind ebenfalls selten, treten jedoch häufiger bei Komedikation mit CYP-Substraten auf, weshalb hier mit Pravastatin eine therapeutische Alternative besteht. Das Nebenwirkungsspektrum umfasst ferner gastrointestinale Beschwerden, Kopfschmerzen, Müdigkeit, Schlafstörungen, Juckreiz und Mundtrockenheit, ferner Erhöhung von Transaminasen, was bis zum Zweifachen des oberen Normwerts bei Fehlen weiterer Symptome toleriert werden kann [12]. Sicherheitshalber sollten ähnlich wie die CPK-Spiegel auch die Transaminasen zu Therapiebeginn sowie vier bis sechs Wochen nach Statin-Gabe kontrolliert werden. Kontraindikationen für eine Behandlung mit Statinen stellen Muskel- und Lebererkrankungen sowie Überempfindlichkeiten dar. Aufgrund der in Tierversuchen beobachteten Teratogenität sind sie auch in der Schwangerschaft und Stillzeit kontraindiziert. Klinische Daten zur Anwendung der Statine beim Menschen sind zwar kaum vorhanden und die Daten hierzu sind widersprüchlich, dennoch bestehen weiterhin Bedenken gegen ihre Anwendung, da diese in die Cholesterol-Biosynthese eingreifen und Einfluss auf die Entwicklung des Fötus nehmen könnten. Generell gilt daher, dass Statine in der Schwangerschaft nicht verordnet werden sollten, da keine Nachteile für die Mutter durch eine Unterbrechung der Therapie für den Zeitraum der Schwangerschaft zu erwarten sind. Erscheint die Gabe mit Statinen jedoch unumgänglich, sollte Simvastatin gewählt werden, welches am besten untersucht ist.
Neuere Untersuchungen bestätigten zudem ein erhöhtes Risiko für die Manifestation eines Typ-2-Diabetes um ca. 9% bei entsprechenden Risikopatienten mit metabolischem Syndrom [13]. Ein möglicher Mechanismus scheint die Verringerung der Insulin-Sensitivität zu sein, wobei die vergleichsweise geringe Risikoerhöhung durch die eindeutige kardiovaskuläre Prävention, gerade auch bei Typ-2-Diabetikern, aufgehoben scheint [14]. Die aktuellen Leitlinien empfehlen daher weiterhin den Einsatz von Statinen bei metabolischem Syndrom sowie Prädiabetes, wobei eine engmaschige Überprüfung der HbA1c-Werte indiziert ist.
Eine Behandlung mit lipophilen Statinen, wie Simvastatin und Atorvastatin, besitzt möglicherweise auch eine positive Wirkung auf die Entwicklung von Demenz, da neben der Erniedrigung des Cholesterol-Spiegels auch die β-Amyloid-Bildung gesenkt zu werden scheint. Doch Fallberichte über Vergesslichkeit und Verwirrtheit behandelter Personen stellen die postulierten Effekte infrage. Tatsächlich bestätigte eine retrospektive Kohortenstudie ein erhöhtes Risiko für Vergesslichkeit bis zu 30 Tage nach Beginn der Therapie, jedoch unterschied sich das Risiko unter Statin-Therapie nicht von dem anderer Lipidsenker [15]. Doch auch die regelmäßige Konsultation des behandelnden Arztes, v. a. zu Beginn einer Therapie, erleichtert die Detektion kognitiver Beeinträchtigungen, sodass noch nicht abschließend geklärt ist, ob ein grundsätzlicher Bias die klinischen Daten verfälschte. Um diese Möglichkeit auszuschließen, wären nun kontrollierte prospektive Studien nötig.
Statine hemmen durch Blockade des Enzyms HMG-CoA-Reduktase neben der Cholesterol-Synthese auch die Biosynthese von Ubichinon (Coenzym Q10). Dieses ist essenziell für die mitochondriale und extramitochondriale Energiebereitstellung. Die höchsten Q10-Konzentrationen finden sich in Organen mit hohem Energiebedarf wie dem Herzmuskelgewebe [16]. Kritiker warnen bereits seit Längerem vor unerwünschten Langzeitfolgen wie einer verminderten myokardialen Pumpfunktion durch Statine, vor allem bei Patienten mit Herzinsuffizienz. Dagegen wird jedoch argumentiert, dass diese Sorge angesichts der effektiven Reduktion kardiovaskulärer Risiken irrelevant erscheint. Bislang fehlen aussagekräftige Studien, die eine Empfehlung zur generellen Supplementierung aussprechen. In speziellen Fällen mag die Gabe von Coenzym Q10 jedoch sinnvoll erscheinen, zum Beispiel wenn im Rahmen der Statin-Behandlung Muskelbeschwerden auftreten.
Die hier beschriebenen Effekte der Statine sind keineswegs vollständig. Tatsächlich werden diese mit einer Vielzahl weiterer Aspekte in Verbindung gebracht. Es ist somit ersichtlich, dass weiterhin der Bedarf zur Durchführung neuer klinischer Studien besteht, um die bereits vorhandenen, teils widersprüchlichen Daten zu den pleiotropen Wirkungen und UAWs der Statine kritisch und objektiv zu bewerten. Auch fehlen vermehrt Vergleichsstudien, um die verschiedenen Statine bezüglich der einzelnen Effekte zu charakterisieren. Dies würde dabei helfen, im Rahmen einer individualisierten Therapie durch die Auswahl des geeigneten Statins mögliche Patienten-bezogene Risiken zu minimieren. Bislang werden hierzu vor allem pharmakokinetische Parameter sowie die Wirkpotenz herangezogen.
Werden die patientenspezifischen Zielwerte mit Statinen nicht erreicht, besteht weiterhin die Möglichkeit der leitliniengerechten Kombination mit Fibraten, Anionenaustauscherharzen, Cholesterol-Resorptionshemmern oder PCSK9-Inhibitoren, was eine weitere Reduktion der LDL-Cholesterol-Werte ermöglicht. Diese alternativen Lipidsenker sind ebenfalls indiziert, wenn Intoleranzen bzw. Kontraindikationen für eine Statin-Therapie bestehen.
Cholesterol-Resorptionshemmer
Der Lipidsenker Ezetimib (Ezetrol®) ist der bisher einzige Vertreter aus der Gruppe der Cholesterol-Resorptionsinhibitoren. Hierbei wird sowohl die Wiederaufnahme von körpereigenem Cholesterol, welches mit Gallensäuren in den Darm gelangt, wie auch Cholesterol aus der Nahrung vermindert. Nach oraler Einnahme lagert sich Ezetimib an die Bürstensaummembran der Enterozyten des Dünndarms an. Vermutlich hemmt es dort den Transport der Lipide aus dem Darm ins Blut durch die selektive Bindung an das Transportprotein NPC1L1 (Niemann-Pick C1-Like 1) (siehe Abbildung 1, C). Die Aufnahme von Triglyceriden sowie fettlöslichen Vitaminen scheint dabei nicht beeinflusst. Ezetimib und sein Metabolit unterliegen der enterohepatischen Zirkulation, was eine Halbwertszeit von ca. 22 Stunden bedingt und eine einmal tägliche Gabe erlaubt. Nebenwirkungen sind wenig bedeutsam und umfassen Kopfschmerzen sowie Magen-Darm-Beschwerden. Ezetimib ist bei Überempfindlichkeiten sowie aufgrund fehlender Erfahrungen bei Kindern bis sechs Jahre kontraindiziert. Bei Patienten mit eingeschränkter Leber- und Nierenfunktion ist eine Dosisanpassung notwendig. Vor allem Sicherheitsaspekte ließen in der Vergangenheit am klinischen Nutzen von Ezetimib zweifeln, da im Rahmen früherer Studien eine erhöhte Inzidenz von Krebserkrankungen auffiel. Im Jahr 2011 konstatierte das IQWiG zudem, dass es keinen Beleg für einen höheren Nutzen gäbe, wenn Ezetimib zusätzlich zu Statinen zur Herzinfarktprophylaxe angewendet wird. Im Rahmen der IMPROVE-IT-Studie konnte jedoch kürzlich der klinische Zusatznutzen von Ezetimib zur Verhinderung kardiovaskulärer Ereignisse bei Hochrisikopatienten mit Statin-Therapie gezeigt werden, womit auch erstmals die sogenannte LDL-Hypothese Bestätigung fand [17]. Diese besagt, dass erhöhte LDL-Cholesterol-Werte als kausale Faktoren für die Entwicklung arteriosklerotischer Erkrankungen gelten [18]. Ezetimib steht auch als Fixkombination mit Simvastatin (Inegy®, Goltor®, Vytorin®) und in Kombination mit Atorvastatin (Atozet®, Tioblis®) zur Verfügung.
PCSK9-Inhibitoren: wirksam aber teuer
Mit den humanen monoklonalen Antikörpern Evolocumab (Repatha®), Alirocumab (Praluent®) und bald vielleicht auch Bococizumab stehen seit Kurzem Vertreter einer neuartigen Substanzklasse, der Proproteinkonvertase Subtilisin/Kexin-Typ-9(PCSK9)-Inhibitoren, zur Verfügung. Im Jahr 2003 wurde PCSK9 erstmalig beschrieben und ursprünglich in neuronalen Zellen bestimmt [19, 20]. Entscheidend für ihre Identifizierung als medikamentöse Zielstruktur war die Beobachtung, dass genetisch niedrige PCSK9-Konzentrationen mit geringen LDL-Cholesterol-Spiegeln und proportional geringerem kardiovaskulärem Risiko assoziiert sind, erhöhte PCSK9-Level wiederum mit einem erhöhten Herzinfarktrisiko einhergehen [21, 22].
PCSK9 reguliert das Recycling von LDL-Rezeptoren auf der Oberfläche von Hepatozyten. Nach Aufnahme von LDL-Cholesterol aus dem Blut wird der Komplex aus LDL und Rezeptor durch Endozytose internalisiert, wobei die Vesikel sodann mit Lysosomen verschmelzen und saure Lipasen im Anschluss die Cholesterol-Ester in Cholesterol und freie Fettsäuren hydrolysieren. Der Umlauf eines Rezeptors dauert in etwa zehn Minuten, wobei internalisierte LDL-Rezeptoren entweder an die Zelloberfläche zurückkehren oder abgebaut werden. PCSK9 besitzt hierbei eine zentrale Funktion, da die Bindung dieses Proteins an die LDL-Rezeptoren ihren Abbau vermittelt. PCSK9-Hemmer binden selektiv an dieses Protein und inhibieren dessen Funktion, wodurch LDL-Rezeptoren vermehrt an die Zelloberfläche exprimiert und für die erneute Aufnahme von LDL-Cholesterol zur Verfügung stehen. PCSK9-Hemmer können deutlich die LDL-Cholesterol-Werte um durchschnittlich 37 bis 76% senken, sowohl im Rahmen von Kombinationstherapien als auch bei Statin-resistenten bzw. Statin-intoleranten Patientengruppen [23 – 25].
Evolocumab wird dabei entweder einmal alle zwei Wochen (140 mg) oder einmal pro Monat (420 mg) subkutan injiziert und ist zur Selbstinjektion durch den Patienten nach angemessener Schulung vorgesehen. Sollte sich nach zwölf Wochen kein Therapieerfolg einstellen, kann die Dosis auch auf 420 mg alle zwei Wochen erhöht werden. Die empfohlene Anfangsdosis von Alirocumab beträgt 75 mg einmal alle zwei Wochen subkutan. Dabei kann auch direkt mit 150 mg Alirocumab begonnen werden, sollte eine stärkere LDL-Cholesterol-Senkung erforderlich sein. Die Behandlung wird dann je nach Therapieziel und Ansprechen des Patienten individuell angepasst.
Die häufigsten Nebenwirkungen der PCSK9-Hemmer umfassen Reaktionen an der Einstichstelle, Nasopharyngitis, Infektionen der oberen Atemwege, grippeähnliche Symptome, Rückenschmerzen und Arthralgien sowie Übelkeit und Pruritus. Als Gegenanzeigen werden Überempfindlichkeiten gegen die Wirkstoffe gelistet, wobei besondere Vorsichtsmaßnahmen bei schweren Leber- und Nierenfunktionsstörungen nötig sind. Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von PCSK9-Hemmern bei Schwangeren vor, weshalb Evolocumab und Alirocumab während der Schwangerschaft und Stillzeit nicht angewendet werden sollten, es sei denn, der klinische Zustand der Patientin macht dies erforderlich.
Die Therapiekosten von geschätzt über 9000 Euro pro Jahr verdeutlichen die Notwendigkeit eines kosteneffizienten Einsatzes der PCSK9-Hemmer. Seit ihrer Einführung werden Evolocumab und Alirocumab gern als wichtige und innovative Behandlungsoption für Patienten mit unkontrollierbarem LDL-Cholesterol angesehen, die eine zusätzliche Reduktion benötigen. Bisher gibt es jedoch für die PCSK9-Hemmer noch keine statistisch ausreichend evidenten Daten zu kardiovaskulären Endpunkten. Entsprechende Studien laufen derzeit, erste Ergebnisse werden jedoch erst gegen Ende des Jahres erwartet [26]. Aufgrund der derzeitigen Datenlage sieht der Gemeinsame Bundesausschuss (G-BA) daher auch erwartungsgemäß keinen Zusatznutzen für PCSK9-Hemmer. Trotz des negativen Beschlusses zur frühen Nutzenbewertung möchte der G-BA jedoch die Verordnungsfähigkeit von Evolocumab für Hochrisikopatienten beibehalten. Hierzu gehören Patienten mit familiärer, homozygoter Hypercholesterolämie, bei denen medikamentöse und diätetische Optionen zur Lipidsenkung ausgeschöpft sind, sowie Personen mit heterozygoter familiärer oder nicht-familiärer Hypercholesterolämie oder gemischter Dyslipidämie, die eine progrediente vaskuläre Erkrankung sowie Diabetes mellitus oder Herzinsuffizienz NYHA III/IV aufweisen [27].
Anionenaustauscherharze: Interaktionen beachten
Basische Anionenaustauscherharze wie Colestyramin (z. B. Quantalan®), Colestipol (z. B. Colestid®; in Deutschland nicht im Handel) und Colesevelam (z. B. Cholestagel®) besitzen eine hohe Affinität zu Gallensäuren. Nach oraler Gabe werden Austauscherharze aufgrund ihrer geringen Löslichkeit nicht resorbiert, sodass intestinale Gallensäuren an diese binden und sodann mit dem Fäzes ausgeschieden werden. So wird die enterohepatische Zirkulation der Gallensäuren verhindert und als Folge Cholesterol für deren Neusynthese in der Leber verbraucht. Die verringerte hepatische Cholesterol-Konzentration führt zu einer Zunahme der Expression von LDL-Rezeptoren, wodurch eine Senkung des LDL-Cholesterol-Spiegels von maximal 34% innerhalb von zwei Wochen möglich wird. Die Tagesdosis sollte auf zwei bis drei Einzeldosen verteilt werden, die jeweils vor den Mahlzeiten mit reichlich Flüssigkeit einzunehmen sind. Wegen der schlechten Verträglichkeit führen Austauscherharze jedoch häufig zu Complianceproblemen. Als solche Nebenwirkungen gelten Obstipation, Steatorrhö aufgrund der gestörten Fettresorption sowie weitere gastrointestinale Beschwerden (Meteorismus oder Völlegefühl). Das Auslösen oder Verschlimmern einer bestehenden Verstopfung ist insbesondere für Patienten mit KHK und Angina pectoris von Bedeutung, da die Anstrengung beim Stuhlgang das Herz weiter belasten kann. Zudem ist bei längerfristiger Einnahme von Gallensäurebindern mit Hypovitaminosen fettlöslicher Vitamine zu rechnen bzw. auf zahlreiche Wechselwirkungen mit anderen Arzneistoffen zu achten. Bei gleichzeitiger Gabe verringert sich zum Beispiel die Resorption von Schilddrüsenhormonen, Phenobarbital oder Tetracyclinen. Deshalb sollte stets ein zeitlicher Abstand von mindestens einer Stunde vor bzw. vier Stunden nach der Einnahme von Anionenaustauscherharzen eingehalten werden. Doch im Fall von Substanzen wie Digitalis-Glykosiden, die einem enterohepatischen Kreislauf unterliegen, kann auch eine zeitversetzte Einnahme die Interaktion nicht verhindern. Alternativ sollte dann Colesevelam eingesetzt werden, da dieses die Bioverfügbarkeit von Digoxin in Studien an gesunden Probanden nicht veränderte [28]. Anwendungsbeschränkungen umfassen Überempfindlichkeiten, Darmverschluss oder Gallengangverlegung. Die Gabe während der Schwangerschaft und Stillzeit sollte mit dem behandelnden Arzt abgesprochen werden, insbesondere wenn Austauscherharze in Kombination mit Statinen zum Einsatz kommen.
Fazit
Fettstoffwechselstörungen stellen evidente Risikofaktoren für die Entwicklung von kardiovaskulären Erkrankungen dar und lassen sich heutzutage nach der Art der Störung gut behandeln. Vor allem Hypercholesterolämien werden nach Ernährungsumstellung am effektivsten mit Statinen behandelt. Bestehen bereits Anzeichen einer Arteriosklerose, so sollte entsprechend aggressiv therapiert werden, um die immer noch hohen Mortalitätsraten weiter zu senken. Hierzu eignen sich gegebenenfalls Kombinationen mit Ezetimib, PCSK9-Inhibitoren oder Anionenaustauscherharzen. Eine Komedikation mit Fibraten kann bei zusätzlicher Hypertriglyceridämie erwogen werden.
Fibrate: Mittel der zweiten Wahl
Die Substanzklasse der Fibrate (Fenofibrat [z. B. Elipsia®], Bezafibrat [z. B. Cedur®] und Gemfibrozil [z. B. Gevilon®]) entfalten ihre Wirkungen hauptsächlich durch Aktivierung des Peroxisomen-Proliferator-aktivierten Rezeptors alpha (PPAR-α). Die physiologischen Agonisten von PPAR-α stellen Fettsäuren dar, worauf vor allem im Hungerzustand vermehrt Fettsäure-transportierende Proteine sowie Enzyme, die an der β-Oxidation von Fettsäuren beteiligt sind, exprimiert werden und somit eine Umstellung des hepatischen Lipidmetabolismus erfolgt. Fibrate erhöhen die Oxidation freier Fettsäuren in Leber und Muskel, wodurch weniger triglyzeridreiche Lipoproteine in der Leber produziert werden. Im Muskel bewirken sie zudem eine Aktivierung der Lipoproteinlipase, wodurch die periphere Verwertung von Triglyceriden ansteigt [29].
Die lipidsenkende Wirkung der Fibrate ist zwar gut belegt, doch ihr Langzeitnutzen im Hinblick auf kardiovaskuläre Mortalität ist weniger gut dokumentiert als bei Statinen, weshalb Fibrate nur noch als Mittel der zweiten Wahl gelten. Fibrate reduzieren vornehmlich die Triglycerid-Konzentrationen um 30 bis 50% und erhöhen den Spiegel von HDL-Cholesterol um 2 bis 20%. Ihre Wirkung auf LDL-Cholesterol ist dagegen unterschiedlich und reicht von keiner bis zu einer geringfügigen Senkung von etwa 10%. Fibrate werden daher gemäß ihres Wirkungsspektrums laut Leitlinien vorwiegend bei erhöhten Triglycerid-Spiegeln und kombinierter Dyslipidämie eingesetzt.
Fibrate werden nach oraler Gabe nahezu vollständig resorbiert. Die Halbwertszeiten variieren zwischen 1,5 Stunden (Gemfibrozil) und 24 Stunden (Fenofibrat). Die Elimination erfolgt nach Glucuronidierung überwiegend renal und ist bei Patienten mit Niereninsuffizienz vermindert. Unerwünschte Wirkungen der Fibrate umfassen gastrointestinale Beschwerden sowie ein Anstieg von Transaminasen. Auch das vermehrte Auftreten von Gallensteinen wurde beschrieben. Weiterhin werden gelegentlich Potenzstörungen, Kopfschmerzen, Schwindel und Schlafstörungen beobachtet. Als klinisch relevante Interaktion gilt das erhöhte Myopathie-Risiko bei gleichzeitiger Gabe von Statinen. Insbesondere unter Gabe hoher Dosen sind vermehrt Rhabdomyolysen beobachtet worden. Fibrate können aber auch ohne Komedikation eine myotoxische Wirkung entfalten und Myalgien hervorrufen. Trotz des bekannten Interaktionspotenzials können Fibrate mit Statinen kombiniert werden, sofern die Patienten keine prädisponierenden Faktoren für Myopathien besitzen oder ihre Nierenleistung eingeschränkt ist, wodurch gegebenenfalls erhöhte Plasmaspiegel resultieren. Es steht mit Pravafenix® eine Fixkombination (Pravastatin + Fenofibrat) zur Verfügung. Die Patienten müssen bei Komedikation mit Statinen umfassend über die Symptome einer Myopathie informiert und sorgfältig überwacht werden. Als Kontraindikationen gelten Überempfindlichkeiten, Gallenblasenerkrankungen mit oder ohne Cholelithiasis sowie photoallergische oder phototoxische Reaktionen. Auch Dialysepatienten oder Patienten mit nephrotischem Syndrom sollten keine Fibrate erhalten. |
Literatur
[1] Empfehlungen zur Diagnostik und Therapie von Fettstoffwechselstörungen in der Ärztlichen Praxis. Deutsche Gesellschaft zur Bekämpfung von Fettstoffwechselstörungen und ihren Folgeerkrankungen DGFF (Lipid-Liga) e.V., Stand September 2011
[2] Reiner Z, Catapano AL et al. European Association for Cardiovascular Prevention & Rehabilitation. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J 2011;32(14):1769–1818
[3] Stone NJ, Robinson J, Lichtenstein AH et al. 2013 ACC/AHA Guideline on the Treatment of Blood Cholesterol to Reduce Atherosclerotic Cardiovascular Risk in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2013;0735–1097(13):06028–2, doi:10.1016/j.jacc.2013.11.002
[4] Schwabe U, Paffrath D. Arzneiverordnungsreport 2014. Springer Berlin Heidelberg, 2014
[5] Mutschler E et al. Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 10. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2013
[6] Herdegen T et al. Kurzlehrbuch Pharmakologie und Toxikologie. 2. Auflage. Thieme Verlagsgruppe, Stuttgart 2010
[7] Rose O et al. Angewandte Pharmakotherapie. 1. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2014
[8] Diagnostik und Therapie der Dyslipidämien - ESC pocket guidelines. Deutsche Gesellschaft für Kardiologie, 2012
[9] Buettner C, Davis RB, Leveille SG et al. Prevalence of musculoskeletal pain and statin use. J Gen Intern Med 2008;23(8):1182–1186
[10] Was tun bei Statin-Unverträglichkeit? Der Arzneimittelbrief, AMB 2009;43:91
[11] Degen H, Steinmetz A. Wenn Statine krank machen. Der Allgemeinarzt, 2014;36(17):48-52
[12] Behandlung von Fettstoffwechselstörungen. Informationen des Arbeitsbereichs Lipidstoffwechsel der Charité Berlin, www.lipidambulanz.charite.de
[13] Sattar N, Preiss D, Murray HM et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomized statin trials. Lancet 2010;375(9716):735–742
[14] Colhoun HM et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial. Lancet 2004;364(9435):685-696
[15] Strom BL et al. Statin Therapy and Risk of Acute Memory Impairment. JAMA Intern Med 2015;175(8):1399-1405, published online 8. Juni 2015, doi:10.1001/jamainternmed.2015.2092
[16] Mortensen SA, Kumar A, Dolliner P et al. The effect of coenzyme Q15 on morbidity and mortality in chronic heart failure. Results from the QSYMBIO study. Presented at Heart Failure Congress 2013 Final Programme Number 440
[17] Cannon CP et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015;372(25):2387-2397
[18] Jarcho JA, Keaney JF. Proof That Lower Is Better - LDL Cholesterol and IMPROVE-IT. N Engl J Med 2015;372:2448-2450
[19] Schulz R et al. Molecular and cellular function of the proprotein convertase subtilisin/kexin type 9 (PCSK9). Basic Res Cardiol 2015;110:4
[20] Seidah NG et al. The secretory proprotein convertase neural apoptosis-regulated convertase 1 (NARC-1): liver regeneration and neuronal differentiation. Proc Natl Acad Sci USA 2003;100:928-933
[21] Cohen J et al. Low LDL cholesterol in individuals of African descent resulting from frequent nonsense mutations in PCSK9. Nat Genet 2005;37:161-165
[22] Cohen JC et al. Sequence variations in PCSK9, ow LDL, and protection against coronary heart disease. N Engl J Med 2006;354:1264-1272
[23] Blom DJ et al.A 52-week placebo-controlled trial of evolocumab in hyperlipidemia. N Engl J Med 2014;370(19):1809-1819
[24] Robinson JG et al. Effect of Evolocumab or Ezetimibe Added to Moderate- or High-Intensity Statin Therapy on LDL-C Lowering in Patients With Hypercholesterolemia: The LAPLACE-2 Randomized Clinical Trial. JAMA 2014;311(18):1870-1883, doi:10.1001/jama.2014.4030
[25] Stroes E et al. Anti-PCSK9 Antibody Effectively Lowers Cholesterol in Patients With Statin Intolerance: The GAUSS-2 Randomized, Placebo-Controlled Phase 3 Clinical Trial of Evolocumab. J Am Coll Cardiol 2014;63(23):2541-2548, doi:10.1016/j.jacc.2014.03.019
[26] Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elevated Risk (Fourier). ClinicalTrials.gov Identifier: NCT01764633, www. ClinicalTrials.gov
[27] Tragende Gründe zum Beschluss über die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage III – Übersicht über Verordnungseinschränkungen und -ausschlüsse Evolocumab. Gemeinsamer Bundesausschuss, 9. Februar 2016, www.g-ba.de
[28] Cholestagel® 625 mg Filmtabletten – Zusammenfassung der Merkmale des Arzneimittels. www.ema.europa.eu
[29] Freissmuth M et al. Pharmakologie und Toxikologie: Von den molekularen Grundlagen zur Pharmakotherapie. 1. Auflage. Springer, Berlin Heidelberg 2012
[30] Schachter M. Chemical, pharmacokinetic and pharmacodynamic properties of statins: An update. Fundam Clin Pharmacol 2005;19:117–125






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.