
- DAZ.online
- DAZ / AZ
- DAZ 12/2016
- Krank durch Tierkontakt
Tierpharmazie
Krank durch Tierkontakt
Gefährliche Zoonosen: Toxokarose, Tollwut, Hanta- und Borna-Viren
Eine Übersicht über wichtige Zoonosen vermittelt Tabelle 1. Sie enthält relevante Erreger, die in Mitteleuropa durch Säugetiere oder Vögel übertragen werden. Die zahlreichen durch Vektoren (insbesondere Insekten und Spinnentiere) übertragenen Erreger werden dort nicht erwähnt. Doch auch die von Säugetieren übertragenen Zoonosen sind so vielfältig, dass hier in diesem Beitrag nur vier Krankheiten näher betrachtet werden. Auch andere Zoonosen können für den Beratungsalltag wichtig sein, aber beispielsweise die Gefahren durch die Toxoplasmose sind weithin bekannt.
Erkrankung und Erreger |
Reservoir |
Infektionsweg |
Inkubationszeit |
Krankheitsbild beim Menschen |
|---|---|---|---|---|
Bakterien | ||||
|
Bartonellose
„Katzenkratzkrankheit“
Bartonella henselae
|
Katze |
Kratz- oder Bissverletzung,
Katzenflohstich
|
ein bis zwei Wochen |
Papel an Eintrittspforte, regionale Lymphadenitis, selten Fieber, generalisiertes Exanthem, vereinzelt Enzephalopathie, Erblindung |
|
Chlamydiose
Chlamydophila felis
|
Katze |
Kontakt |
ein bis vier Wochen |
Konjunktivitis, von klinisch inapparent über leichte grippale Infekte bis zu „atypischen Pneumonien“ alle Symptome möglich |
|
Leptospirose
Leptospira interrogans (zahlreiche Serovare)
|
Nagetiere, (Hund) |
Kontakt mit Urin infizierter Tiere bzw. kontaminiertem Wasser |
meist sieben bis vierzehn Tage, maximal bis 30 Tage |
sehr vielseitig, oft biphasischer Verlauf
grippeähnliche Symptome, klassische Trias aus Nierenversagen, Ikterus und Splenomegalie (Weil-Krankheit), Meningitis bzw. Meningoenzephalitis, pulmonale Hämorrhagien
|
|
Ornithose/Psittakose „Papageienkrankheit“
Chlamydia psittaci
|
Vögel, besonders Kakadu, Wellensittich u. a. Psittaciden |
aerogene Tröpfcheninfektion, Schmierinfektion |
sechs bis zwanzig Tage |
Fieber, grippeähnliche Symptome, atypische Pneumonie |
|
Pasteurellose
P. multocida u. a.
|
Hund, Katze, Vögel, Nutztiere, Zoo- und Wildtiere |
Biss- oder Kratzverletzung, Schmierinfektion, aerogene Tröpfcheninfektion |
zwei bis vierzehn Tage |
nach Biss: Phlegmone, Abszess, Nekrose
akut und subakut: Bronchitis, Pneumonie, Konjunktivitis, Stomatitis, Enteritis
|
|
Q-Fieber
Coxiella burnetii
|
Schaf, Rind, Ziege, selten Katze, Hund, Kaninchen, Wildtiere und Vögel |
aerogen (Inhalation von kontaminiertem Staub), Kontakt zu infizierten Tieren |
zwei bis drei Wochen |
grippeähnliche Symptome, interstitielle Pneumonie, Hepatitis, selten Myokarditis, Perikarditis oder Meningoenzephalitis,
Abort (v. a. im ersten Trimenon)
|
|
Salmonellose
S. typhimurium, S. enteritidis u. a. Serovare
|
Schlachttiere, Geflügel, Vögel, Hund, Katze, Schildkröte u. a. Reptilien |
oral durch kontaminierte Nahrungsmittel, direkter Kontakt mit ausscheidenden Tieren |
meist fünf bis 72 Stunden, maxi-mal sieben Tage |
plötzliches Erbrechen, Übelkeit, Durchfall, Fieber
Komplikationen: Sepsis, Peritonitis, Harnwegsinfektion, Endokarditis
|
|
Tuberkulose
Mycobacterium tuberculosis, M. bovis, M. africanum
|
Rind, Ziege, Hund, Katze, Zootiere, insbesondere Primaten |
aerogen, Schmierinfektion, über Hautverletzungen, Verzehr von infizierter Rohmilch oder infiziertem Fleisch |
vier bis sechs Wochen |
Primärtuberkulose in der Lunge, Pleuritis exsudativa
hämatogene Streuung: Miliartuberkulose, Meningitis, Knochen-, Gelenk-, Haut- und Genitaltuberkulose
|
Viren | ||||
|
Bunthörnchen-Borna-Virus
Variegated Squirrel Bornavirus 1
|
Bunthörnchen, Schönhörnchen |
Wahrscheinlich durch Kratz- oder Bissverletzung |
? |
tödlich verlaufende Enzephalitis |
|
Hantavirus-Infektion
Puumala-Virus, Dobrava-Belgrad-Virus u.a.
|
Nagetiere, Insektenfresser, Fledermaus |
aerogen, selten durch Biss |
zwei bis vier Wochen, in Ausnahmefällen fünf bis 60 Tage |
Hämorrhagisches Fieber mit renalem Syndrom (HFRS)
hohes Fieber, grippeähnliche Symptome, evtl. Nierenfunktionsstörungen bis zum akuten Nierenversagen (Nephropathia epidemica)
|
Erkrankung und Erreger |
Reservoir |
Infektionsweg |
Inkubationszeit |
Krankheitsbild beim Menschen |
Viren | ||||
|
„Katzenpocken“
Orthopoxvirus bovis
|
Katze, Rind, Nagetiere |
Hautverletzungen |
eine Woche |
Primärpocke an Eintrittspforte
Komplikation: Viruspneumonie
|
|
Tollwut
Rhabdovirus, European-Bat-Lyssaviren Typ 1 und 2, Bokeloh-Bat-Lyssavirus u.a.
|
Fuchs, Hund, Katze, Fledermaus, selten andere Tierarten |
Biss, über Hautverletzung oder Konjunktiven, aerogen möglich |
abhängig von der Eintrittsstelle wenige Tage bis zu einem Jahr |
Parästhesie im Bereich der Verletzung, Unruhe, Tremor, Krämpfe, Hypersalivation, Hydrophobie, Exzitation, Paralyse, Tod |
Parasiten | ||||
|
alveoläre Echinokokkose
Echinococcus multilocularis (Kleiner Fuchsbandwurm)
|
Fuchs, Hund, selten Katze |
oral (Schmierinfektion), kontaminierte Erde oder Nahrungsmittel |
10 bis 15 Jahre |
infiltratives Wachstum der Larve in der Leber, vergleichbar mit dem Wachstum eines malignen Tumors (alveolärer Lebertumor)
|
|
zystische Echinokokkose
Echinococcus granulosus (Kleiner Hundebandwurm)
|
Hund, Katze |
oral (Schmierinfektion), kontaminierte Erde oder Nahrungsmittel |
Monate bis Jahre |
Zysten in Leber (70%) und Lunge (20%), selten zerebral, spinal, kardial, ossär |
|
Giardiasis
Giardia lamblia
|
Katze, Hund, Rind, Schaf |
oral (Schmierinfektion),
Trinkwasser und Nahrungsmittel (Fliegen als mechanische Überträger)
|
sechs bis fünfzehn Tage |
Durchfall, Erbrechen, Anorexie, Flatulenz, Kopfschmerz, leichtes Fieber
chronisch rezidivierender Verlauf möglich
|
|
Toxokarose
Toxocara canis, Toxocara cati
|
Hund, Katze |
enger Kontakt, Spielplätze, Sandkästen, ungenügend erhitztes Fleisch |
Wochen bis Monate |
Larva migrans visceralis: Eosinophilie, Hepatomegalie, Bronchitis, Pneumonie, ZNS-Symptome (Neurotoxokarose)
Larva migrans ocularis: Granulome im Bereich von Choroidea, Retina oder Glaskörper
|
|
Toxoplasmose
Toxoplasma gondii
|
Katze, Schwein, Schaf, Ziege |
Schmierinfektion (Fäzes), oral (rohes Fleisch), diaplazentar |
Wochen bis Monate |
akut: asymptomatisch bis lokalisierte oder generalisierte Lymphadenopathie
Erstinfektion in der Schwangerschaft: Infektion und Fehlbildungen der Neugeborenen
|
Pilze | ||||
|
Mikrosporie
Microsporum canis
|
Katze, Hund, selten Pferd und andere Tierarten |
Kontakt mit erkrankten oder latent infizierten Tieren (bis zu 90% der langhaarigen Katzen sind latent infiziert) |
Tage bis wenige Wochen |
Dermatomykose |
|
Trichophytie
Trichophyton mentagrophytes
|
vor allem Nagetiere |
Kontakt mit erkrankten oder latent infizierten Tieren |
Tage bis wenige Wochen |
Dermatomykose |
Toxokarose – die unbekannte Zoonose
Die Toxokarose (synonym Toxokariasis) wird höchstwahrscheinlich unterdiagnostiziert. Die vielgestaltige Helminthose ist bei Humanmedizinern kaum bekannt und wird daher differenzialdiagnostisch selten betrachtet. Doch für Betroffene kann sie vielfältige und teilweise schwerwiegende Folgen haben. Diese Infektion mit den Larven des weltweit verbreiteten Hunde- (Toxocara canis)- bzw. Katzenspulwurms (Toxocara cati) betrifft besonders häufig Kleinkinder. Etwa 7% aller Kinder in Deutschland besitzen Antikörper gegen Toxocara spp., europaweit bis zu 44%. In bis zu 41% der Sandkästen auf öffentlichen Kinderspielplätzen wurden Toxocara-Eier gefunden. Ein Toxocara-canis-Weibchen legt bis zu 200.000 Eier pro Tag. In den sehr widerstandsfähigen Eiern entwickeln sich infektiöse Larven. Die Eier können direkt peroral oder über Zwischenwirte aufgenommen, sowie galaktogen und beim Hund auch diaplazentar übertragen werden. Menschen können sich beim direkten Kontakt mit Tieren infizieren, über kontaminierte Erde oder Lebensmittel wie unzureichend gewaschenes Gemüse oder auch über ungenügend erhitztes Fleisch, das Toxocara-Larven enthält. Spulwurmeier lassen sich wegen ihrer klebrigen Oberflächen nur durch gründliches Waschen von Gegenständen oder Lebensmitteln lösen. Wegen dieser Eigenschaft können sie beispielsweise auch über Schuhsohlen in Wohnräume gelangen.
Nach Aufnahme des Eis schlüpft die Larve im Dünndarm des Wirts. Im Endwirt (Hund bzw. Katze) kann die Larve nach einer Passage durch Blut, Leber und Lunge über die Trachea zurück zum Dünndarm wandern und sich dort zum adulten Parasiten entwickeln oder sie vollzieht nur eine somatische Wanderung und bleibt als „ruhende“ bzw. hypobiotische Larve im Gewebe. Dort wird sie bei trächtigen Tieren reaktiviert und kann diaplazentar die Feten infizieren oder galaktogen die Welpen. Bei erwachsenen Hunden und Katzen verläuft eine Spulwurminfektion meist asymptomatisch, aber diese Tiere scheiden unerkannt Eier mit dem Kot aus. Bei infizierten Welpen sind Abmagerung, Entwicklungsstörungen, „Wurmbauch“, Erbrechen, Durchfall oder Pneumonie möglich, bei massivem Befall sogar Todesfälle. Da der Mensch für diese Würmer ein Fehlwirt ist, können sich die Larven in ihm nicht zu adulten Würmern entwickeln, sondern sie wandern im menschlichen Körper umher (Larva migrans visceralis). Dabei können sie praktisch alle Organe befallen und führen zu entzündlichen Reaktionen mit eosinophilen Infiltraten. Die Infektion kann asymptomatisch verlaufen oder nach einer Inkubationszeit von Wochen bis Monaten abhängig von der Lokalisation der Larven zu Urtikaria, rheumatoiden oder asthmatoiden Beschwerden, Bronchitis, Hepatomegalie, intraabdomineller Lymphadenopathie, Splenomegalie, Myokarditis, gastrointestinalen Symptomen und bei okulärer Toxokarose zu Sehstörungen, Strabismus, Uveitis, Retinitis oder Endophthalmitis bis hin zum Visusverlust führen. Besonders gefürchtet ist die Neurotoxokarose, die Verhaltensänderungen, Schlafstörungen, neurologische Ausfälle oder epileptische Anfälle auslösen kann. Larven von Toxocara canis präferieren dabei nach aktuellen Untersuchungen das Großhirn, die von Toxocara cati das Kleinhirn.
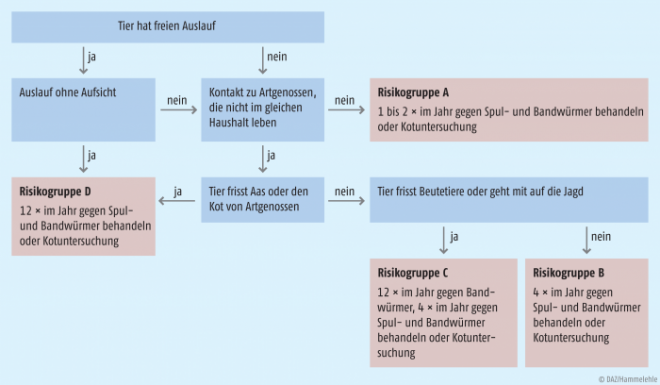
Als Therapie bietet sich Albendazol in der Dosierung von 10 bis 15 mg/kg Körpergewicht für zwei bis vier Wochen an. Die Gabe von Mebendazol, Thiabendazol oder Diäthylcarbamazin ist ebenfalls möglich, aber nicht so effektiv oder mit deutlich mehr Nebenwirkungen verbunden. Leider ist die Therapie auch mit Albendazol nicht immer erfolgreich, weil die im Gewebe sitzenden Larven zwar abgetötet werden, aber nicht „verschwinden“ und die Symptome weiterbestehen können. Daher ist bei okulärem bzw. ZNS-Befall eine Operation Mittel der Wahl. Therapie der zweiten Wahl ist Albendazol kombiniert mit Corticosteroiden und bei ZNS-Befall auch mit Antikonvulsiva. Hunde und Katzen sollten nach individueller Risikobewertung (Abb. 1 ESCCAP-Schema zur individuellen Entwurmung) regelmäßig entwurmt werden, um das Risiko für die Übertragung auf den Menschen zu minimieren. Auch die konsequente Beseitigung von Hunde- und Katzenkot ist eine wichtige Schutzmaßnahme für Mensch und Tier.
Abb. 1: Schema zur individuellen Entwurmung Kann das individuelle Risiko eines Tieres nicht eindeutig eingeschätzt werden, sollte mindestens viermal im Jahr Kot untersucht oder entwurmt werden. Studien haben belegt, dass ein bis drei Entwurmungen im Durchschnitt keinen ausreichenden Schutz bieten [European Scientific Counsel Companion Animal Parasites (ESCCAP), www.esccap.de].
Tollwut – immer tödlich
Im Gegensatz zur Toxokarose ist die Gefahr für die Tollwut fest im Bewusstsein der meisten Menschen verankert, wahrscheinlich weil die Tollwut die Infektionskrankheit mit der höchsten bekannten Sterberate ist. Nach Schätzungen der Weltgesundheitsorganisation sterben weltweit jährlich mehr als 50.000 Menschen daran. Die Lyssa-Viren aus der Familie der Rhabdoviridae werden durch Speichel infizierter Tiere übertragen und führen zu Krampfanfällen, Koma und Tod durch Atemlähmung. Die Inkubationszeit variiert stark zwischen vier Tagen und einem Jahr, meist 20 bis 70 Tage. Die meisten Infektionen des Menschen kommen durch Hunde in Entwicklungsländern vor, viele davon in Indien. Reisende können sich in Afrika, Mittel- und Südamerika, Asien, sowie in ländlichen Gebieten der Türkei und den Balkanländern infizieren.
Während diese klassische Form der Tollwut (Fuchstollwut), hervorgerufen durch das Rabies-Virus (RABV), in Deutschland seit 2006 nicht mehr aufgetreten ist, ist die Fledermaustollwut weiterhin in ganz Europa endemisch. Letztere wird von mindestens drei verschiedenen Lyssa-Viren hervorgerufen: den European-Bat-Lyssa-Viren Typ 1 und 2 (EBLV-1, 2) sowie dem Bokeloh-Bat-Lyssa-Virus (BBLV). Bis 2013 wurden in Europa über 1000 Fälle von Fledermaustollwut festgestellt, davon mehr als 90% in Dänemark, den Niederlanden, Polen und Deutschland. Das Robert Koch-Institut (RKI) rät daher ausdrücklich von direktem Kontakt mit Fledermäusen ab. Aufgefundene Fledermäuse sollten nur mit dicken Handschuhen angefasst werden. Wer engen Kontakt zu Fledermäusen hat, sollte sich gemäß einer Empfehlung der Ständigen Impfkommission (STIKO) vorbeugend gegen Tollwut impfen lassen. Die verfügbaren Tollwutimpfstoffe schützen zuverlässig vor allen in Deutschland vorkommenden Tollwutviren. Da aufgrund der geringen Überwachungsintensität das Vorkommen von Fledermaustollwut nirgendwo ausgeschlossen werden kann, sollen Ungeimpfte nach direktem Kontakt mit Fledermäusen grundsätzlich eine postexpositionelle Immunprophylaxe durchführen (siehe Tabelle 2), auch wenn keine Verletzung erkennbar ist. Bei sofortiger Applikation schützt dies nach peripheren Verletzungen zu 100%. Bei bestehendem Impfschutz wird nach einer Bissverletzung die erneute aktive Impfung am ersten und dritten Tag empfohlen.
Grad der Exposition |
Art der Exposition durch ein tollwutverdächtiges oder tollwütiges Wild- oder Haustier oder eine Fledermaus |
Immunprophylaxe (Fachinformation beachten) |
|---|---|---|
I |
Berühren/Füttern von Tieren, Belecken der intakten Haut |
keine Impfung |
II |
nicht blutende, oberflächliche Kratzer oder Hautabschürfungen, Lecken oder Knabbern an der nicht intakten Haut |
fünf Impfungen, Impfschema gemäß Herstellerangabe. Ein übliches Schema sind Impfungen an den Tagen 0, 3, 7, 14 und 28. |
III |
Bissverletzungen oder Kratzwunden, Kontakt von Schleimhäuten oder Wunden mit Speichel (z. B. durch Lecken), Verdacht auf Biss oder Kratzer durch eine Fledermaus oder Kontakt der Schleimhaut mit einer Fledermaus |
fünf Impfungen, Impfschema gemäß Herstellerangabe, sowie einmalig mit der ersten Impfung simultan Verabreichung von Tollwut-Immunglobulin (20 IE/kg Körpergewicht) |
Durch den illegalen Import von Hunden oder Katzen aus Tollwut-Endemiegebieten in Afrika, Asien, der Türkei oder dem Balkan besteht auch hierzulande eine latente Tollwutgefahr. Bei Reisen in Risikogebiete sollte vor allem für Kinder und bei besonderer Gefährdung durch Trekkingtouren, Höhlenwanderungen oder Arbeit im Tierschutz eine Impfung vor der Abreise erwogen werden. Allerdings gibt es immer wieder Lieferengpässe bei Tollwutimpfstoffen (DAZ 2013, Nr. 25, S. 23: „Tollwut-Impfstoff gesucht“). Gegen Vorlage einer ärztlichen Verschreibung können Apotheken üblicherweise auf das Notkontingent beim Hersteller zugreifen. Die Postexpositionsprophylaxe ist jederzeit durch die Notfalldepots der Apothekerkammern gesichert.
Hanta – Vorsicht vor Mäusen
Weniger gefährlich und weniger bekannt, aber in Deutschland weit häufiger als die Tollwut ist eine Infektion mit dem Hanta-Virus. Hierzulande manifestiert sie sich oft als milde Form des hämorrhagischen Fiebers mit renalem Syndrom (HFRS). Leitsymptome sind hohes Fieber, grippeähnliche Beschwerden und akutes Nierenversagen. 2012 wurden 2825 Erkrankungsfälle gemeldet, doch da viele Infektionen asymptomatisch bzw. mit unspezifischen Symptomen verlaufen, muss von einer deutlich höheren Zahl ausgegangen werden. Der Name „Hanta-Virus“ leitet sich vom koreanischen Fluss Hantangang ab. Während des Koreakrieges Anfang der 1950er Jahre erkrankten mehr als 3000 Soldaten an einem schwer verlaufenden hämorrhagischen Fieber.
Die bekanntesten Spezies der weltweit vorkommenden Hanta-Viren sind Hantaan-, Puumala-, Dobrava-Belgrad-, Seoul-, Sin-Nombre- und Andes-Virus, wobei in Deutschland nach Untersuchungen des Konsiliarlaboratoriums für Hanta-Viren und des RKI Infektionen mit dem Puumala-Virus (vor allem im Süden und Westen des Landes) und einer Form des Dobrava-Belgrad-Virus (vor allem im Osten und Norden) vorherrschen. Jede Hanta-Virus-Spezies hat ihren eigenen spezifischen Reservoirwirt, der nur eine oder mehrere eng verwandte Nagerspezies umfasst. Das Reservoir des Puumala-Virus ist die Rötelmaus (Myodes glareolus), beim Dobrava-Belgrad-Virus sind es verschiedene Apodemus-Spezies: Brandmaus (Apodemus agrarius), Gelbhalsmaus (Apodemus flavicollis) und Schwarzmeerwaldmaus (Apodemus ponticus).
Die Viren werden von asymptomatisch infizierten Nagetieren über Speichel, Urin und Kot ausgeschieden und können darin mehrere Tage, auch in getrocknetem Zustand, infektiös bleiben. Der Mensch infiziert sich durch Inhalation virushaltiger Aerosole (z. B. aufgewirbelter Staub), durch Kontakt der verletzten Haut mit kontaminierten Materialien, durch Bisse oder durch Lebensmittel, die mit Ausscheidungen infizierter Nagetiere kontaminiert wurden. Die Inkubationszeit beträgt üblicherweise zwei bis vier Wochen, in Ausnahmefällen zwischen fünf und 60 Tagen.
Je nach Virustyp können Hanta-Viren unterschiedlich schwere Krankheitsbilder hervorrufen. Asiatische und europäische Hanta-Virus-Stämme sind Auslöser des hämorrhagischen Fiebers mit renalem Syndrom. In Deutschland sind echte hämorrhagische Verläufe selten und es stehen grippeähnliche Symptome und Nierenbeteiligung im Vordergrund. Einige Autoren bezeichnen diese Verlaufsform auch als Nephropathia epidemica (NE). Die Behandlung erfolgt symptomatisch. In einzelnen Fällen erwies sich der frühzeitige Einsatz von Ribavirin als erfolgreich. Eine überstandene Infektion führt wahrscheinlich zu einer lebenslangen, Virustyp-spezifischen Immunität.
Der wirksamste Schutz vor einer Infektion besteht darin, den Kontakt mit den Ausscheidungen von Nagetieren zu vermeiden. Im Umfeld menschlicher Wohnbereiche (insbesondere Keller, Dachböden, Schuppen) sollten Nagetiere intensiv bekämpft werden. Bei zu erwartender Staubentwicklung sind Atemschutzmasken und Handschuhe zu tragen. Mäusekadaver und Exkremente sollten vor der Entsorgung mit einem Desinfektionsmittel benetzt werden.
Toxoplasmose-Risiko wird unterschätzt
Toxoplasmose ist eine durch Toxoplasma gondii verursachte Infektionskrankheit. Sie ist besonders für Schwangere gefährlich, da eine unbehandelte Infektion der Mutter im ersten Drittel der Schwangerschaft unter Umständen den Embryo schwer schädigen oder zum Abort führen kann. Infiziert sich die Schwangere im zweiten oder dritten Drittel der Schwangerschaft, können beim Neugeborenen Retinochorioiditis, Hydrozephalus und intrakranielle Verkalkungen auftreten. Der Erreger wird über Katzenkot übertragen, denn Katzen sind die Endwirte der Toxoplasmen. In ihrem Darmepithel kann die geschlechtliche Vermehrung der Parasiten stattfinden. Nach Angaben des Robert Koch-Instituts kann in Deutschland die durchschnittliche Durchseuchung der Bevölkerung nur geschätzt werden, da bisher zum Anteil der Infizierten (Seroprävalenz) und auch zur Art der Infektionswege und dem Risiko für die Bevölkerung und für Schwangere keine belastbaren Daten vorlagen, zumal nur die kongenitale Toxoplasmose (seit 2001) meldepflichtig ist. Seit 2008 erhebt das RKI bundesweit in einer kombinierten Quer- und Längsschnitterhebung (DEGS-Studie) Daten zur Gesundheit der in Deutschland lebenden Erwachsenen. Die Daten wurden auch für eine Schätzung der T.-gondii-Seroprävalenz, eine Bestimmung von potenziellen Risikofaktoren für eine Infektion mit T. gondii und die Schätzung der jährlichen Anzahl von Infektionen während der Schwangerschaft herangezogen. Von insgesamt 6663 Personen waren 3602 seropositiv. Aus den ermittelten Zahlen zur jährlichen Inzidenz von Serokonversionen und den geschätzten jährlichen Serokonversionen bei Frauen während der Schwangerschaft kommt das RKI zu dem Schluss, dass es jährlich 345 Neugeborene mit klinischen Symptomen geben müsste, weil sich ihre Mütter während der Schwangerschaft infiziert haben. Gemeldet werden dem RKI aber nur acht bis 23 Fälle kongenitaler Toxoplasmose pro Jahr. Dies weist auf eine starke Untererfassung dieser Erkrankung bei Neugeborenen hin. Mit einer Seroprävalenz von fast 50% bei Erwachsenen liegt Deutschland deutlich über den Werten von Holland (26%), wo vergleichbare Daten vorliegen. Außerdem sind die Seroprävalenzen im Osten Deutschlands deutlich höher als im Westen. Diese Ergebnisse lassen sich durch die Unterschiede bei der Katzenhaltung (Gefahr der Infektion durch Oozysten) und durch die Häufigkeit und Art des Fleischkonsums (im Osten wird deutlich mehr rohes Schweinehackfleisch und Rohwurst verzehrt) erklären.
Quelle
Wilkung H et al. Prevalence, incidence estimations, and risk factors of T. gondii infection in Germany. Scientific Reports 2016;6:22551, doi: 10.1038/srep22551
Vorkommen und Bedeutung von T. gondii in Deutschland. Ergebnisse der serologischen Untersuchungen innerhalb der Studie zur Gesundheit Erwachsener in Deutschland. Informationen des RKI vom 3. März 2016, www.rki.de
Borna – spektakuläre Einzelfälle
Für Schlagzeilen sorgte eine neu entdeckte Zoonose, nachdem zwischen 2011 und 2013 in Sachsen-Anhalt drei Züchter von Bunthörnchen an Enzephalitis gestorben waren. Die aus Mittelamerika stammenden Bunthörnchen zählen zur Gattung der Eichhörnchen und werden hierzulande als Zoo- und Haustiere gehalten. Mittlerweile wurde bei den verstorbenen Züchtern und bei mehreren Bunt- und Schönhörnchen das Bunthörnchen-Borna-Virus 1 (Variegated Squirrel Borna-Virus 1, VSBV-1) nachgewiesen. Nach molekularbiologischen und immunhistologischen Untersuchungen am Friedrich-Loeffler-Institut (FLI) handelt es sich dabei um einen neuen zoonotischen Erreger. Noch ist unklar, ob VSBV-1 auch in anderen Tieren vorkommt und woher das Virus stammt. Das neu entdeckte VSBV-1 gehört zur Gattung Borna-Virus in der Familie Bornaviridae und ist genetisch eng verwandt mit Borna-Viren der Art Mammalian 1 borna-virus, die bei verschiedenen Säugetieren ebenfalls Erkrankungen mit zentralnervöser Symptomatik auslösen. Der Übertragungsweg ist bisher unbekannt, allerdings erscheinen Biss- oder Kratzverletzungen wahrscheinlich. Die mit VSBV-1 infizierten Bunt- und Schönhörnchen zeigten keine Krankheitssymptome. Die betroffenen Hörnchen-Züchter erkrankten an einer schweren Enzephalitis und starben zwei bis vier Monate nach Auftreten der ersten klinischen Symptome. Das FLI empfiehlt, alle Bunt- und Schönhörnchen zu beproben und positiv getestete Hörnchen einzuschläfern. Bis zum Vorliegen weiterer Erkenntnisse sollte vorbeugend der direkte Kontakt zu Bunt- und Schönhörnchen vermieden werden. |
Quelle
Tollwut – RKI-Ratgeber für Ärzte, Informationen des Robert Koch-Instituts, Stand: Juli 2013, www.rki.de
Tollwut. Informationen des Privaten Tropeninstitut Dr. Gontard GbR, www.tropeninstitut.de
Hantavirus-Erkrankung – RKI-Ratgeber für Ärzte, Informationen des Robert Koch-Instituts, Stand: Juli 2015, www.rki.de
Steckbrief Bunthörnchen-Borna-Virus 1 – Variegated squirrel bornavirus 1 (VSBV-1)
Informationen des Friedrich-Loeffler-Instituts (FLI) Bundesforschungsinstitut für Tiergesundheit, Stand März 2016, www.fli.de
Von Katzen übertragene Zoonosen, Laboklin aktuell 09/2007
Steckbrief Hantavirus-Infektionen. Informationen des Friedrich-Loeffler-Instituts (FLI) Bundesforschungsinstitut für Tiergesundheit, Stand Mai 2015, www.fli.de
Echinokokkose – RKI-Ratgeber für Ärzte. Informationen des Robert Koch-Institus, Stand: November 2005, www.rki.de
Q-Fieber – RKI-Ratgeber für Ärzte. Informationen des Robert Koch-Instituts, Stand: Mai 2012, www.rki.de
Leptospirose – RKI-Ratgeber für Ärzte. Informationen des Robert Koch-Instituts, Stand: Oktober 2015, www.rki.de
Webinar von Elanco Animal Health vom 30. September 2015: Auer A. Toxokarose – eine vielgestaltige und weithin unbekannte Helminthose in Mitteleuropa, sowie Strube C. Wenn der Wurm drin ist
European Scientific Counsel Companion Animal Parasites (ESCCAP) www.esccap.de






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.