
- DAZ.online
- DAZ / AZ
- DAZ 10/2016
- MS-„Therapiedurchbruch...
Arzneimittel und Therapie
MS-„Therapiedurchbruch“ mit Ocrelizumab?
FDA will CD20-Antikörper beschleunigt zulassen
Die Autoimmunkrankheit Multiple Sklerose (MS) ist vor allem über autoreaktive T-Zellen vermittelt: Myelin-reaktive TH1- und TH17-Zellen schütten proinflammatorische Zytokine aus, und auch zytotoxische T-Zellen sind in MS-Herden vermehrt anzutreffen. Ebenso spielen B-Zellen eine wichtige Rolle in der Pathogenese der MS als antigenpräsentierende Zellen und Aktivatoren für autoreaktive T-Zellen sowie in Form der Plasmazellen als Produzenten von Antikörpern. Eine interessante Therapiemaßnahme bei MS richtet sich deshalb auch gezielt gegen B-Zellen.
Angriff über CD20-Antigen
Bereits 1998 wurde in der EU mit Rituximab ein erster Antikörper zugelassen, der für eine Depletion von B-Zellen sorgt. Rituximab ist ein chimärer IgG1-Antikörper, der an das CD20-Oberflächenprotein auf B-Zellen bindet und das körpereigene Immunsystem dazu bringt, diese derart markierten Zellen zu eliminieren. Zunächst wurde der Antikörper für die Behandlung von Non-Hodgkin-Lymphomen zugelassen, um die übermäßig vermehrten B-Zellen zu eliminieren. Bald realisierte man, dass der Antikörper aber auch bei all jenen Autoimmunerkrankungen eingesetzt werden kann, bei denen eine Überproduktion autoreaktiver Antikörper zur Pathogenese beiträgt, wie bei der rheumatoiden Arthritis.
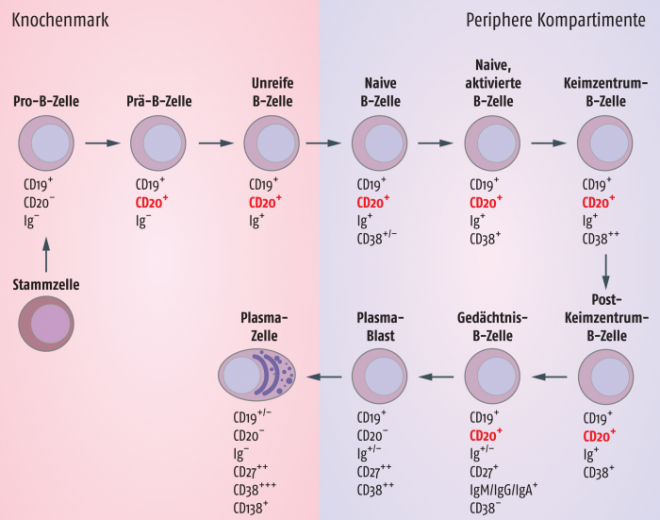
CD20 ist ein glykosyliertes Phosphoprotein, das auf B-Zellen verschiedener Entwicklungsstadien exprimiert ist (Abb.). Während es auf Stammzellen und Pro-B-Zellen nicht vorhanden ist, steigt die Konzentration auf Prä-B-Zellen bis zu den Gedächtnis-Zellen. Auf reifen Plasmazellen, die im Körper für die Antikörperproduktion zuständig sind, ist CD20 dann nicht mehr zu finden.
Abb.: Entwicklung der B-Zellen. Die Stadien der B-Zell-Entwicklung sind anhand der verschiedenen, exprimierten Oberflächenmarker wiedergegeben. Das Vorhandensein von CD20 ist rot hervorgehoben.
Mit dem gewünschten Effekt der Elimination von übermäßig produzierten B-Zellen in bestimmten pathologischen Konstellationen erkauft man sich allerdings bis zur Erholung des natürlichen B-Zell-Pools eine massive Immunsuppression. Deshalb sollte beispielsweise eine Impfung möglichst vier Wochen vor einer Therapie mit einem gegen CD20 gerichteten Antikörper abgeschlossen sein und Impfungen mit lebend-attenuierten Impfstoffen unbedingt vermieden werden.
Rituximab – ein alter Antikörper
Rituximab (MabThera®) ist ein chimärer Antikörper gegen CD20. Somit besitzt dieser Antikörper noch signifikante Mengen Maus-Proteinanteile im Molekül, die die Bildung entsprechender Antikörper gegen das Therapeutikum induzieren könnten. Ein anderer Nachteil von Rituximab aus unternehmerischer Sicht ist jedoch, dass der Patentschutz in Europa bereits im Februar 2013 ausgelaufen ist und in den USA im September 2016 endet. Verschiedene Hersteller sind bereits sehr weit mit der Entwicklung eines Biosimilars fortgeschritten, unter anderem Amgen mit ABP 798, Boehringer Ingelheim mit BI 695500, Sandoz mit GP2013 und der Hersteller des Infliximab-Biosimilars Celltrion/Hospira mit CT-P10. Die europäische Zulassungsbehörde sieht für Biosimilars unter bestimmten Voraussetzungen vor, dass sie, nachdem sie die Nachweise für die Vergleichbarkeit erbracht haben, für alle Indikationen zugelassen werden, für die auch das Originatormolekül eine Zulassung hat (Extrapolation der Indikation). Erste Studien mit Rituximab zur Behandlung der MS zeigten vielversprechende Resultate und deuteten an, dass vor allem jüngere Patienten (unter 50 Jahre) mit progressiver MS vom Antikörper profitieren könnten. Aber: Lohnt es sich für die Firma Roche wirklich, noch eine Zulassungsstudie für Rituximab durchzuführen, wenn ihr die Biosimilars quasi schon im Nacken sitzen und vor allem, wenn man mit Ocrelizumab einen zweiten, neueren Antikörper gegen CD20 in der Schublade hat, der noch vollen Patentschutz genießt?
Ocrelizumab – ein Antikörper der zweiten Generation
Ocrelizumab wird oftmals als „Antikörper der zweiten Generation“ bezeichnet. Ocrelizumab ist ein humanisierter IgG1-Antikörper, der im direkten Vergleich zu Rituximab an ein etwas anderes, aber überlappendes Epitop bindet und in vitro eine stärkere Antikörper-abhängige zelluläre Zytotoxizität (ADCC) und eine geringere Komplement-abhängige Zytotoxizität (CDC) gegenüber B-Zellen induziert als der chimäre Antikörper. Ein Grund für diesen Effekt könnte sein, dass Ocrelizumab besser an niedrig affine Varianten des FcγRIIIa-Rezeptors bindet, der auf natürlichen Killerzellen für die Bindung des Antikörpers und in Folge für die ADCC verantwortlich ist. In den Phase-III-Studien von Ocrelizumab bei der Indikation rheumatoide Arthritis waren – wenig überraschend – signifikant mehr schwere und opportunistische Infektionen in der Verum-Gruppe als in der Placebo-Gruppe beobachtet worden. Daraus leitete man ab, dass das Nutzen-Risiko-Profil von Ocrelizumab für die Therapie der rheumatoiden Arthritis keinen Vorteil gegenüber den bereits vorhandenen Wirkstoffen bringt. Aus diesem Grund wurde die Entwicklung von Ocrelizumab als Antirheumatikum eingestellt.
Positive Ergebnisse bei primär progredienter MS
Für die Therapie der MS war der Nutzen hingegen sehr viel deutlicher: Im Oktober 2015 wurden auf dem Kongress des European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS) die Ergebnisse von drei Phase-III-Studien mit Ocrelizumab bei schubförmig-remittierender (RRMS) bzw. primär progredienter MS (PPMS) vorgestellt, die die Experten begeisterten. Im Vergleich zur Therapie mit Interferon beta-1a war während der zweijährigen Studie zur RRMS die Schubrate um 47% und das Risiko der fortschreitenden Behinderung um 40% reduziert, wobei die Anzahl der schweren Infektionen ähnlich häufig war. Auch Irritationen an der Einstichstelle kamen ähnlich häufig vor wie in der Vergleichs-Gruppe. Für die Therapie der primär progredienten MS (PPMS) zeigt die Studie mit 732 Patienten ein um 25% geringeres Risiko einer fortschreitenden Beeinträchtigung über 24 Wochen im Vergleich zur Placebo-Gruppe. Diese positiven Ergebnisse, vor allem bei der primär progredienten Verlaufsform, für die es bisher noch keine zugelassene Immuntherapie gibt, waren wahrscheinlich der Grund dafür, dass die US-amerikanische Zulassungsbehörde dem Antikörper kürzlich den Status „Therapiedurchbruch“ verliehen hat. Die Wirksamkeit des CD20-Antikörpers bei MS scheint nicht nur in der Depletion der B-Zellen, sondern in der gleichzeitig fehlenden Aktivierung autoreaktiver T-Zellen zu liegen. Somit werden offensichtlich die Pathomechanismen nachhaltig unterbrochen.
Ausblick
Mit dem monoklonalen Antikörper Ocrelizumab könnte neben Natalizumab und Alemtuzumab bald ein dritter Antikörper für die Behandlung der MS verfügbar sein, und mit weiteren innovativen Wirkstoffen kann zeitnah gerechnet werden. Darunter ist auch der vollständig humane CD20-Antikörper Ofatumumab, der in Phase-II-Studien bei RRMS getestet wird. Bisher gibt es keine Head-to-Head-Studien eines CD20-Antikörpers gegen Natalizumab oder Alemtuzumab. Immunsuppressive Wirkungen zeigen allerdings alle diese Antikörper, so dass ein erhöhtes Risiko für Infektionen in jedem Fall besteht und beachtet werden muss. Auch die gefürchtete Aktivierung eines JC-Virus mit dem Risiko einer progressiven multifokalen Leukenzephalopathie (PML), die vor allem durch den Einsatz von Natalizumab ins Rampenlicht rückte, wurde beim Einsatz von Anti-CD20-Antikörpern beobachtet, wohingegen diese Gefahr bei Verwendung des Anti-CD52-Antikörpers Alemtuzumab wohl deutlich geringer ist.
Allerdings sind Krankheiten, die durch ein überschießendes Immunsystem hervorgerufen werden, in nachvollziehbarer Weise am erfolgreichsten mit immunsuppressiven Wirkstoffen therapierbar, so dass man kalkulierbare Risiken, darunter auch Infektionen, in Kauf nehmen muss und kann. |
Quelle
Sorensen PS, Blinkenberg M. The potential role for ocrelizumab in the treatment of multiple sclerosis: current evidence and future prospects. Ther Adv Neurol Disord 2016;9:44-52
Biosimilars of rituximab. Generics and Biosimilars Initiative, www.gabionline.net/Biosimilars/General/Biosimilars-of-rituximab, abgerufen am 19. Februar 2016
Multiple Sklerose. Informationen der Deutschen Multiple Sklerose Gesellschaft Bundesverband e.V., www.dmsg.de/multiple-sklerose-infos/index.php?kategorie=mserforschen&kategorie2=einleitung, abgerufen am 21. Februar 2016
Straus Farber R, Harel A, Lublin F. Novel Agents for Relapsing Forms of Multiple Sclerosis. Annu Rev Med 2016;67:309-321
Avivi I, Stroopinsky D, Katz T. Anti-CD20 monoclonal antibodies: beyond B-cells. Blood Rev 2013;27:217-223
Emery P, Rigby W, Tak PP, Dörner T, Olech E et al. Safety with ocrelizumab in rheumatoid arthritis: results from the ocrelizumab phase III program. PLoS One 2014;9:e87379
Edwards JC, Cambridge G. B-cell targeting in rheumatoid arthritis and other autoimmune diseases. Nat Rev Immunol 2006;6:394-403





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.