
- DAZ.online
- DAZ / AZ
- DAZ 1/2016
- Nichtalkoholische ...
Medizin
Nichtalkoholische Fettlebererkrankung
Die hepatische Manifestation des metabolischen Syndroms
Wenn sich lichtmikroskopisch eine Akkumulation von Lipiden, vor allem Triglyceriden, im Zytoplasma der Hepatozyten nachweisen lässt, spricht man allgemein von einer Leberzellverfettung (Steatose). Morphologisch lassen sich hierbei eine kleintropfige (mikrovesikuläre) und eine großtropfige (makrovesikuläre) Lipideinlagerung unterscheiden. Bei einer blanden Steatosis hepatis beträgt der Fettanteil mehr als fünf bis zehn Prozent des Lebergewichts bzw. speichern mehr als 50 Prozent der Hepatozyten Fett. Ausgelöst wird dieser Prozess durch unterschiedliche Ursachen, wobei zum einen Mischformen möglich sind, zum anderen sich im Einzelfall keine sichere Kausalität herstellen lässt:
- Alkohol (oberhalb einer definierten Schwellendosis),
- metabolisches Syndrom (ist Thema dieses Beitrags) oder
- andere Erkrankungen und Einflussfaktoren (zusammengefasst als sekundäre Steatose, s. Tab. 1).
-
Tab. 1: Sekundäre Steatosen. Hepatische Steatosen, die nicht im Zusammenhang mit Alkoholabusus oder metabolischem Syndrom entstehen, werden unter dem Begriff der sekundären Steatosen zusammengefasst. Bei den Ursachen unterscheiden die amerikanischen Leitlinien, ob sich dabei eine groß- oder kleintropfige Leberverfettung entwickelt. Makrovesikuläre Steatose- Hepatitis C (v. a. Genotyp 3)
- Morbus Wilson (erbliche Stoffwechselstörung mit pathologischer Ablagerung von Kupfer in verschiedenen Organen, v. a. in der Leber)
- Fettstoffwechselstörungen, z. B. Lipodystrophie, Abetalipoproteinäme
- ernährungsbedingte Ursachen, z. B. Hungerzustände, parenterale Ernährung
- Medikamente, z. B. Amiodaron, Methotrexat, Tamoxifen, Corticosteroide
Mikrovesikuläre Steatose- Reye-Syndrom (akute Steatohepatitis mit nachfolgender Enzephalopathie bei Kindern und Jugendlichen nach viralen Atemwegsinfekten oder nach Einnahme von ASS)
- akute Schwangerschaftsfettleber
- HELLP-Syndrom
- Stoffwechselstörungen, z. B. Lecithin-Cholesterol-Acyltransferase(LCAT)-Mangel
- Medikamente, z. B. Valproinsäure, Tetracycline, antiretrovirale Substanzen (Didanosin, Stavudin)
Ohne erhöhten Alkoholkonsum
Eine nichtalkoholische Fettlebererkrankung (NAFLD = nonalcoholic fatty liver disease) besteht per definitionem dann, wenn – anamnestisch glaubhaft – die Steatosis hepatis nicht maßgeblich durch einen erhöhten Alkoholkonsum bedingt ist. Hierbei liegt die Schwellendosis für Männer bei 30 g und für Frauen bei 20 g Alkohol täglich. Da sich die alkoholische und die nichtalkoholische Form histologisch gleich präsentieren, lassen sie sich – falls keine anderen Zeichen einer Alkoholkrankheit vorliegen – letztendlich nur anamnestisch abgrenzen.
Progression: NAFLD > NASH > Fibrose
Sind bei einer NAFLD zusätzlich noch entzündliche Veränderungen nachweisbar, handelt es sich um eine nichtalkoholische Steatohepatitis (NASH = nonalcoholic steatohepatitis). Charakteristische Zeichen sind entzündliche Infiltrate in den Leberläppchen und Leberzellschäden in Form einer Zellschwellung (Ballonierung) zumeist in der Nachbarschaft verfetteter Hepatozyten. Zwischen fünf und 20 Prozent der Fettleberpatienten entwickeln eine NASH.
Während die reine Steatose im Prinzip reversibel ist und in den meisten Fällen einen indolenten, nicht schwerwiegenden Krankheitsverlauf zeigt, muss die Steatohepatitis als progredienter Prozess gewertet werden. Je nach erhobenen Verlaufsdaten geht eine NASH in zehn bis 20 Prozent der Fälle in eine höhergradige Fibrose über, und zum Zeitpunkt der Diagnose finden sich bei zehn bis 15 Prozent der Patienten bereits Zeichen einer Leberzirrhose. Im Spätstadium erkranken etwa zwei Prozent der Betroffenen an einem hepatozellulären Karzinom (HCC).
Metabolische Ursachen
In Europa und in den USA ist die nichtalkoholische Fettlebererkrankung mittlerweile die am häufigsten festgestellte Ursache einer chronischen Lebererkrankung. So beträgt in Europa die Häufigkeit der NAFLD in der Gesamtbevölkerung im Schnitt zwischen 20 und 30 Prozent, wobei die Prävalenz nicht nur bei Männern, sondern auch bei Jungen mit Übergewicht zugenommen hat. Gemäß den Daten des amerikanischen National Health and Nutrition Examination Survey (NHANES) stieg der Anteil der NAFLD an den chronischen Lebererkrankungen in den 20 Jahren von 1988 bis 2008 von 47 auf 75 Prozent.
Neben der steigenden Lebenserwartung gilt als Hauptursache dieser Entwicklung die Zunahme der metabolischen „Lifestyle“-Risikofaktoren in den Industrienationen. Es gilt als gesichert, dass eine positive Korrelation zwischen der NAFLD und verschiedenen metabolischen Parametern besteht, etwa dem Bauchumfang, dem arteriellen Blutdruck, den Blutzucker- und Triglyceridwerten. So wird die nichtalkoholische Fettlebererkrankung als hepatische Manifestation des metabolischen Syndroms angesehen, auch wenn sie je nach Ursache auch unabhängig davon auftreten kann (s. Kasten „Das metabolische Syndrom“). Allerdings wurde in den letzten Jahren auch eine starke Zunahme der NAFLD bei Jugendlichen beobachtet; überraschenderweise lag in einer australischen Studie die Prävalenz bei Mädchen höher als bei Jungen.
Insulinresistenz wichtigster Einflussfaktor
Die genaue Pathogenese der NAFLD ist noch nicht abschließend geklärt. Als wesentlicher Faktor gilt die Insulinresistenz. Hierbei ist die Wirkung von Insulin in den peripheren Geweben vermindert, vor allem in der Muskulatur, dem Fettgewebe und der Leber. Daraus folgen eine verminderte Glucoseaufnahme in Muskel- und Fettzellen und eine verminderte Glykogensynthese in Leber- und Muskelzellen. Um den dadurch erhöhten Blutzuckerspiegel zu senken, schüttet die Bauchspeicheldrüse mehr Insulin aus, es kommt zur Hyperinsulinämie.
Trotz erhöhter Insulinspiegel ist bei Insulinresistenz die Lipolyse im Fett- und Muskelgewebe gesteigert (statt normalerweise gehemmt). Nach der Multiple-hit-Theorie kommt es dadurch zu einem hohen Einstrom freier Fettsäuren ins Blut, die dann von der Leber aufgenommen werden. Zusätzlich führt die Hyperinsulinämie über verschiedene Mechanismen zu einer Zunahme der Triglyceridsynthese in der Leber – bei gleichzeitiger Hemmung ihres Abtransports als „very low density lipoproteins“ (VLDL) aus den Hepatozyten. Durch die vermehrte Fettspeicherung entsteht die Steatosis hepatis.
Zellschädigung durch Inflammation
Darüber hinaus verstärken freie Fettsäuren in der Leber die Lipidperoxidation, sie generieren hochreaktive Sauerstoffspezies (ROS) und stimulieren die Expression etwa von Tumornekrosefaktor α (TNF‑α). Eine Reihe komplexer Interaktionen zwischen Hepatozyten, Kupffer-Zellen (Makrophagen des Lebergewebes), Entzündungsmediatoren wie TNF‑α und Interleukinen sowie Sauerstoffradikalen unterhält einen inflammatorischen und zellschädigenden Prozess: Es kommt zur Steatohepatitis (NASH).
Für die weitere Entwicklung einer Fibrose spielen wahrscheinlich auch extrahepatische Faktoren eine Rolle, vor allem Produkte von Darmbakterien und sogenannte Adipokine aus viszeralen Fettgewebszellen. Adiponectin z. B. ist ein antidiabetisch und antiinflammatorisch wirkendes Polypeptid, dessen Spiegel bei NAFLD und vor allem NASH vermindert ist.
Erhöhtes kardiovaskuläres Risiko
Das Risiko, andere mit dem metabolischen Syndrom assoziierte Erkrankungen zu entwickeln, ist bei Patienten mit NAFLD oder NASH deutlich erhöht (das Diabetesrisiko zum Beispiel 2,5-fach). Zudem konnte mehrmals nachgewiesen werden, dass NAFLD und NASH auch unabhängige Risikofaktoren für eine erhöhte kardiovaskuläre Morbidität und Mortalität sind. So haben betroffene Patienten ein zweifach höheres Risiko, an kardiovaskulären Erkrankungen zu versterben. In verschiedenen Untersuchungen wiesen NAFLD-Patienten ein höheres Risiko für Koronararteriosklerose sowie für eine erhöhte Intima-Media-Dicke der Arteria carotis auf.
Häufig mit Typ-2-Diabetes verknüpft
Ebenso ließ sich feststellen, dass bis zu 74 Prozent der Patienten mit Diabetes mellitus Typ 2 eine Steatose aufweisen. Auch das Risiko, dass eine bestehende NAFLD zur NASH fortschreitet, wird durch einen bestehenden Typ-2-Diabetes erhöht. So leiden bis zu 40 Prozent der Patienten mit Adipositas und Diabetes Typ 2 an einer NASH. Zudem steigen bei Patienten mit NAFLD oder NASH die Mortalitätsraten, wenn sie an Diabetes mellitus Typ 2 erkrankt sind.
Umgekehrt zeigen Patienten mit NAFLD ein stark erhöhtes Risiko, an einem Prädiabetes oder Diabetes mellitus Typ 2 zu erkranken. Man nimmt inzwischen an, dass die Verfettung der Hepatozyten ein wesentlicher Faktor ist, der ebenfalls über proinflammatorische Mechanismen die Insulinsensitivität in den Zielorganen Leber und Muskulatur herabsetzt.
Erhöhte Transaminasen
Die klinische Symptomatik der NAFLD ist in der Regel unspezifisch. Zum Zeitpunkt der Diagnosestellung haben die meisten Patienten keine Beschwerden oder Anzeichen einer Lebererkrankung, manche klagen über vermehrte Müdigkeit und rechtsseitige Oberbauchbeschwerden. Verdächtig sind erhöhte Werte der Leberenzyme Aspartat-Aminotransferase (AST; früher Glutamat-Oxalacetat-Transaminase, GOT) und Alanin-Aminotransferase (ALT; früher Glutamat-Pyruvat-Transaminase, GPT), wobei die GPT meist führend oder auch isoliert erhöht ist. Allerdings können normale Werte der Transaminasen eine NAFLD (oder sogar eine Zirrhose) nicht ausschließen.
Um auf nichtinvasivem Weg eine Leberverfettung zu erkennen, gilt die transabdominelle Ultraschalluntersuchung heute als die am besten geeignete Methode. Doch lassen sich die NAFLD und die NASH sonografisch nicht unterscheiden, und die Genauigkeit nimmt bei geringerer Ausprägung der Steatose ab. Goldstandard in der Diagnostik ist daher nach wie vor die invasive Leberbiopsie, mit der die einzelnen Stadien zwischen Steatose, Entzündungsaktivität und Fibrose nachgewiesen werden können.
Vom „Wohlstandsbäuchle“ zum metabolischen Syndrom
Unter dem metabolischen Syndrom – angloamerikanisch auch „deadly quartet“ (tödliches Quartett) genannt – versteht man eine Konstellation von vier Parametern, die (auch unabhängig vom Rauchen) mit einem erhöhten kardiovaskulären Risiko verbunden sind. Gemeinsame Endstrecke ist eine Arteriosklerose, die zu Herzinfarkt und Schlaganfall führen kann.
Nach der derzeitigen pathogenetischen Vorstellung basiert dieser Prozess im Wesentlichen auf einer Insulinresistenz der insulinabhängigen Gewebe. Als deren wichtigster Promotor gilt das viszerale (intraabdominelle) Fettgewebe bei Adipositas. Verschiedene Untersuchungen belegen, dass der Bauchumfang hierbei ein besseres Maß zur Risikostratifizierung darstellt als der Body-Mass-Index.
Bis heute wurden international mehrere Definitionen des metabolischen Syndroms etabliert. Am gebräuchlichsten dürfte die Definition der American Heart Association (AHA) und des National Heart, Lung, and Blood Institute (NHLBI) sein, in der die vier Risikofaktoren folgende Grenzwerte haben:
- stammbetonte Adipositas: Taille ≥ 102 cm (Männer) bzw. ≥ 88 cm (Frauen)
- Dyslipoproteinämie:- Triglyceride ≥ 150 mg/dl und- HDL-Cholesterol ≤ 40 mg/dl (Männer) bzw. ≤ 50 mg/dl (Frauen)
- Blutdruck ≥ 130 mmHg systolisch bzw. ≥ 85 mmHg diastolisch
- Nüchternglucose ≥ 100 mg/dl (im kapillären Venenblut)
Sind mindestens drei dieser Risikofaktoren nachweisbar, besteht ein metabolisches Syndrom. Ein manifester Diabetes mellitus Typ 2 kann, muss aber nicht vorliegen.
Inzwischen weiß man, dass auch das Fettgewebe hormonell und regulatorisch relevante Stoffe produzieren und sezernieren kann. Nimmt das Bauchfett zu, werden z. B. mehr inflammatorisch wirkende Substanzen wie Tumornekrosefaktor alpha (TNF‑α), Interleukin-6 (IL-6), Leptin und C-reaktives Protein (CRP) freigesetzt. Daher geht man heute davon aus, dass es sich beim metabolischen Syndrom wie bei der Arteriosklerose um einen inflammatorischen Prozess handelt.
Abnehmen ist das A und O
Nach wie vor stehen keine langfristig wirksamen Medikamente zur Verfügung, die den Übergang zur Fibrose verhindern würden. Daher beschränken sich die Therapieempfehlungen bei der NAFLD und NASH derzeit auf die Bereiche Ernährung und Lebensstil.
Im Vordergrund steht zunächst die Gewichtsreduktion. Zielvorgabe für übergewichtige und adipöse Patienten ist, die tägliche Ernährung so zu modifizieren, dass eine Abnahme des Körpergewichts um wöchentlich 0,5 bis 1 kg erreicht wird. Sinnvoll erscheint hierbei, die Gesamt-Kohlenhydrataufnahme auf ca. 50 bis 55 Energieprozent zu begrenzen und möglichst wenig von den Monosacchariden Fructose und Glucose aufzunehmen. Daher sollte auch auf Limonaden und Colagetränke verzichtet werden, die aufgrund von Süßungsmitteln wie Maissirup viel Fructose und Glucose enthalten. Dass der Konsum von Fructose die Entwicklung der Insulinresistenz fördert, konnte in letzter Zeit mehrfach nachgewiesen werden. Demgegenüber ließen sich NAFLD- und NASH-Befunde in Studien verbessern, wenn die Betroffenen – diätetisch und durch Substitution – Fett mit einem höheren ω-3:ω-6-Verhältnis verzehrten.
Über einen Zeitraum von sieben Jahren konnte gezeigt werden, dass bereits eine moderate Gewichtsabnahme von bis zu vier Prozent ausreicht, damit sich bei 56 Prozent der Patienten die Leberverfettung wieder zurückbildet. Um auch die Inflammation einzudämmen, wird allerdings ein Gewichtsverlust von mindestens neun Prozent für erforderlich gehalten.
Alkohol: Schutz oder schädlich?
Interessant in diesem Zusammenhang sind zwei Studien aus dem Jahr 2012, nach denen sich sowohl der Genuss von Kaffee (nicht jedoch Espresso) als auch von (geringen) Mengen Alkohol günstig auszuwirken scheint. So erwies sich coffeinhaltiger Filterkaffee bei Patienten mit NASH als protektiv gegenüber einem Fibroseverlauf, und mäßiger Alkoholkonsum (< 20 g/Tag) reduzierte bei NAFLD-Patienten das Risiko für die Entwicklung einer NASH.
Andererseits wurde in einer über zehn Jahre andauernden Untersuchung beobachtet, dass es bei Patienten mit einer Fettleber zu einer beschleunigten progredienten Fibrose kam, wenn sie mehr als einmal pro Monat über 60 g (Männer) beziehungsweise über 48 g (Frauen) Alkohol zu sich nahmen. Nicht zuletzt aufgrund dieser Studie findet sich in der aktuellen deutschen Leitlinie keine Empfehlung zugunsten kleiner Mengen Alkohol – wohl aber zugunsten Kaffee „aufgrund hepato- und kardioprotektiver Effekte“.
Wie so oft von Nutzen: Sport
Die zweite Säule der „life style modification“ ist der Sport. So wird für Patienten mit einer nichtalkoholischen Fettlebererkrankung explizit eine regelmäßige körperliche Aktivität in Form von Ausdauer- oder Krafttraining empfohlen. Sogar bei fortgeschrittener Erkrankung sollen die Patienten motiviert werden, sich körperlich zu betätigen,
- bei geringgradiger (kompensierter) NASH-Zirrhose im Rahmen eines Sportprogramms unter Anleitung,
- bei fortgeschrittener (dekompensierter) NASH-Zirrhose im Rahmen physiotherapeutischer Maßnahmen.
Der Benefit konnte mehrmals nachgewiesen werden. Beispielsweise führte eine gesteigerte körperliche Aktivität von etwa 200 Minuten pro Woche bei mäßiger Intensität innerhalb von 48 Wochen nicht nur zu einem Gewichtsrückgang um neun Prozent, sondern auch zu einer signifikanten histologischen Verbesserung der Steatose- und Inflammationszeichen.
Dass die nichtalkoholische Fettleber auch als hepatische Manifestation des metabolischen Syndroms verstanden wird, findet seinen Niederschlag auch in den Therapiezielen aus eher kardiologischer Sicht. Neben der Gewichtsabnahme und körperlichen Aktivität sollten die Patienten – je nach Konstellation – mit Antihypertensiva, Lipidsenkern, Antidiabetika und Thrombozytenaggregationshemmern behandelt werden.
Metformin ohne eindeutigen Benefit
Derzeit gibt es keine für die Indikation NAFLD zugelassenen Medikamente. Da das Biguanid Metformin bei Diabetes mellitus Typ 2 mit begleitender (Prä-)Adipositas mit Erfolg eingesetzt wird, wurde auch mehrfach seine Wirksamkeit bei NAFLD untersucht. Hierbei war auch ein Aspekt, dass Metformin die Rate kardiovaskulärer Ereignisse bei Typ‑2-Diabetikern senken kann. Dennoch sind die Resultate bei NAFLD bislang nicht eindeutig:
- Einerseits wurde nachgewiesen, dass die Gabe von Metformin – allerdings flankiert durch eine gesteigerte körperliche Aktivität – die Gefäßsteifigkeit reduzierte und die Mikrozirkulation verbesserte.
- Andererseits ergab eine Metaanalyse, dass eine sechs- bis zwölfmonatige Behandlung mit Metformin, kombiniert mit einer Lebensstilintervention, im Vergleich zu einer alleinigen Lebensstilintervention weder Transaminasenwerte noch histologische Befunde verbesserte.
- Möglicherweise zeigt Metformin, wie eine weitere Metaanalyse andeutet, einen günstigen Effekt auf die Inzidenz des Leberzellkarzinoms.
Die derzeitige Empfehlung lautet, dass Metformin bei manifestem Typ-2-Diabetes bis zum Stadium A Child-Pugh (= geringgradige oder kompensierte Zirrhose) als orales Antidiabetikum der ersten Wahl auch bei erhöhten Transaminasenwerten eingesetzt werden kann.
Weniger Bauchfett durch Glitazone
Zusätzlich zu einer verminderten Insulinresistenz konnte in mehreren Studien nachgewiesen werden, dass Glitazone (Pioglitazon und Rosiglitazon) eine „Umverteilung“ bewirken: Das viszerale Fettgewebe nimmt ab und das subkutane nimmt zu. Beide Effekte sprechen für einen Einsatz dieser Substanzen bei NAFLD und NASH. Während vor allem unter Pioglitazon signifikante Verbesserungen der Steatose sowie der entzündlichen Aktivität nachgewiesen werden konnten, ist der Effekt auf die Fibrose umstritten. Außerdem zeigte sich nach Therapieende ein Rebound der NAFLD- bzw. NASH-Aktivität.
Vitamin E gegen Inflammation
Da bei der Leberzellschädigung im Rahmen einer Steatohepatitis der oxidative Stress wahrscheinlich eine zentrale Rolle spielt, wurde auch der Einfluss des Antioxidans Vitamin E auf den Erkrankungsverlauf untersucht. So konnte Vitamin E bei nichtdiabetischen Patienten die Transaminasenwerte senken und histologisch auch die Steatose und Inflammation verbessern, nicht jedoch den Fibrosegrad. Allerdings stiegen nach Absetzen der Therapie die AST- und ALT-Werte wieder auf die Ausgangswerte an, d. h. dass wohl nur eine Dauertherapie eine langfristige Verbesserung erzielt. Auch wurde in drei Endpunktstudien eine Assoziation von erhöhter Mortalität und hochdosierter Vitamin-E-Gabe beobachtet.
Restmagen als Nahrungsbremse
Haben bei stark adipösen Patienten (BMI > 40) die etablierten Maßnahmen zur Gewichtsreduktion versagt, kommt als Ultima Ratio ein bariatrischer Eingriff infrage. Hierbei handelt es sich um chirurgische oder interventionelle Verfahren am Magen-Darm-Trakt mit dem Ziel, die Kalorienaufnahme zu senken.
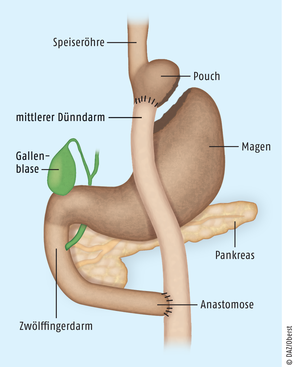
Bei der Magenresektion mit Roux-Y-Rekonstruktion (Abb. 1) wird wenige Zentimeter unterhalb des Mageneingangs ein Vormagen („Pouch“) abgetrennt, der nur 15 bis 20 ml fasst und die Nahrungsaufnahme „bremst“. Auch der Dünndarm wird durchgetrennt, worauf
- sein unteres Ende nach oben gezogen und an den Pouch angeschlossen wird (alimentäre Schlinge) und
- sein oberes Ende (biliodigestive Schlinge) 100 bis 150 cm tiefer an den mittleren Dünndarm angeschlossen wird (Anastomose).
Abb. 1: Roux-Y-Magenbypass, der häufigste Typ einer bariatrischen Operation. Der Pouch (kleiner Teil des Magens, 15 – 20 ml) wird direkt mit dem mittleren Dünndarm verbunden, sodass die Nahrung den eigentlichen Magen und den Zwölffingerdarm umgeht (Bypass). Bei der Anastomose vereinigen sich beide Darmsegmente.
Dadurch umgeht die Nahrung den Magen und den daran anschließenden Zwölffingerdarm (= „Bypass“) und kommt mit deren Verdauungssäften (auch aus Gallenblase und Bauchspeicheldrüse) erst bei der Anastomose in Kontakt. Da erst ab hier die Nahrungsbestandteile aufgespalten werden können, kann auch nur ein Teil davon resorbiert werden.
Bei Patienten mit schwerer Adipositas und bestehender NASH hatte eine bariatrische Operation nicht nur einen deutlichen Gewichtsverlust zur Folge, sondern verbesserte auch die Steatose und Entzündung. Dennoch sollte hieraus keine allgemeingültige Empfehlung abgeleitet werden, sondern die Indikation muss individuell und sorgfältig gestellt werden. Eine fortgeschrittene Leberzirrhose (Stadium B oder C Child-Pugh) etwa schließt diese Therapieoption aus. |
Literatur
[1] Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. S2k-Leitlinie Nicht-alkoholische Fettlebererkrankungen. AWMF Register Nr. 021-025. Januar 2015
[2] Weiß J, Rau M, Geier A. Nichtalkoholische Fettlebererkrankung. Dtsch Ärztebl 2014;111:447-452
[3] Dancygier H. Pathogenese und Therapie der nichtalkoholischen Fettlebererkrankungen. Dtsch Ärztebl 2006;103:A1301-A1307
[4] Bernsmeier C, Heim MH. Nicht-alkoholische Fettleber und Steatohepatitis. Schweiz Med Forum 2011;11(4):53-57
[5] Wirth A, Pfeiffer A, Steinmetz A, et al. Das Metabolische Syndrom. Herzmedizin 2006;23(3):140-144
[6] Schattenberg JM. Nicht-alkoholische Fettleber (NAFLD) und nicht-alkoholische Steatohepatitis (NASH): Pathophysiologie und Ernährungsaspekte. Ernährungs Umschau 2015;62(2):M92-M99























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.