
- DAZ.online
- DAZ / AZ
- DAZ 6/2015
- Transporter mit ...
Prisma
Transporter mit Doppelfunktion
Influx von Glutamat und Chlorid
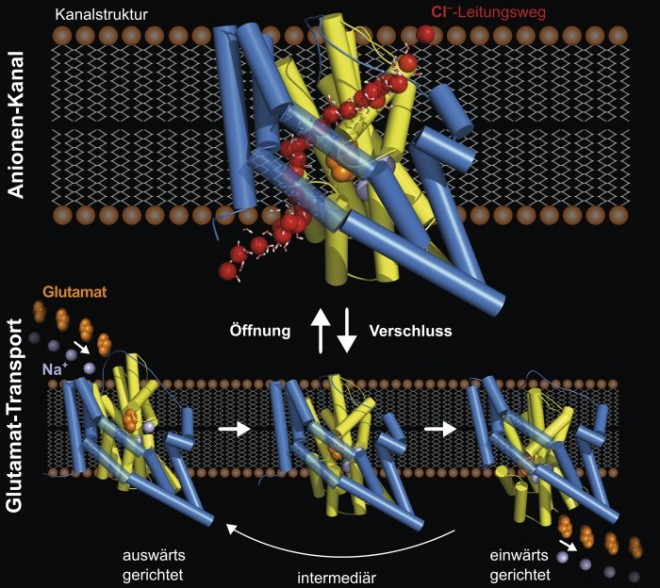
Glutamat-Transporter in verschiedenen Konformationen in der Membran von Neuronen. Er transportiert einerseits Glutamat (orange) und Natriumionen aus dem synaptischen Spalt (Mitte) in die Zelle (unten), wobei sich bestimmte Teile des Transporters (gelb) durch die Membran von außen nach innen bewegen. Andererseits dient der Transporter in seiner intermediären Struktur auch als Chloridkanal (oben).
Mediziner und Biophysiker um Christoph Fahlke am Forschungszentrum Jülich untersuchten mithilfe von Computersimulationen die Dynamik der beiden exzitatorischen Aminosäurentransporter EAAT2 und EAAT4. Es sind transmembranäre Proteine in Zellen, die bei Neuronen Glutamat transportieren (EAAT2 heißt deshalb auch Glt-1). An der äußeren Zellmembran der Neuronen nehmen sie Glutamat zusammen mit Natriumionen auf, die durch den Spanungsunterschied die für den Transport erforderliche Energie liefern. Während ein Teil des Proteins bei dem Transportvorgang unverändert bleibt, schiebt sich ein anderer Teil, der sowohl Glutamat als auch Natrium gebunden hat, ein Stück von außen nach innen, was die Autoren mit einem Fahrstuhl verglichen haben. Wenn der „Fahrstuhl“ am Ziel angekommen ist, entlässt er seine Fracht ins Zytosol.
Bei seiner intermediären Stellung kann das Protein auch als spannungsabhängiger Anionenkanal fungieren, durch den Chloridionen aus dem synaptischen Spalt in die Nervenzelle einströmen. Nach Aussage der Autoren ist eine solche Doppelfunktion von transmembranären Proteinen schon früher postuliert worden, aber von ihnen erstmals im Detail dargestellt worden. Nach der Computersimulation haben sie die Ergebnisse mithilfe der Patch-clamp-Technik und der Fluoreszenzspektroskopie an dem Glutamattransporter GltPh des Archäbakteriums Pyrococcus horikoshii bestätigt. |
Quelle: Machtens J-P, et al. Mechanisms of Anion Conduction by Coupled Glutamate Transporters. Cell 2015;160:542-553

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.