
- DAZ.online
- DAZ / AZ
- DAZ 50/2015
- Giftige „Heilpflanzen...
Toxikologie
Giftige „Heilpflanzen“ bei Hildegard von Bingen
Gefahr durch toxische Pyrrolizidinalkaloide
Vor etwa 30 Jahren gerieten einige altbekannte Arzneipflanzen ins Blickfeld von Naturstoffchemikern und Pharmakologen, weil sie toxische Pyrrolizidinalkaloide (PA) enthalten. Daraufhin wurden PA-Höchstgrenzen in Arzneimitteln festgelegt und Pflanzensorten gezüchtet, die frei von diesen Inhaltsstoffen sind. Eine Gefahr besteht jedoch weiterhin, wenn man wiederholt PA-haltige Pflanzen wild sammelt, um daraus z. B. einen „Gesundheitstee“ zu bereiten.
Was sind Pyrrolizidinalkaloide?
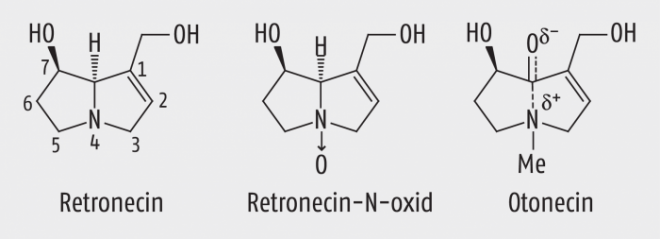
Pyrrolizidinalkaloide sind Ester von sog. Necinbasen mit verschiedenen Necinsäuren oder Essigsäure. Necin ist das 1-Hydroxymethyl-pyrrolizidin (der Name „Necin“ ist von „Senecio“ = Greiskraut abgeleitet). Necin-Derivate mit einer Doppelbindung in Position 1,2 und einer Hydroxylgruppe in Position 7 (7,9-Necindiole) bilden die Grundstruktur der toxischen Pyrrolizidinalkaloide (Abb. 1). Als Necinsäuren kommen zahlreiche aliphatische, verzweigte Mono- und Dicarbonsäuren vor. In vielen Fällen ist eine Necinbase mit einer Dicarbonsäure über zwei Esterbindungen verknüpft, wodurch ein 11- bis 14-gliedriges Ringsystem entsteht (Abb. 2). Wegen der Vielfalt der Säuren sind etwa 650 Alkaloide bekannt.
Abb. 1: Diese 1,2-ungesättigten Necinbasen mit OH-Gruppen am C7 und C9 bilden die Grundstrukturen der toxischen Pyrrolizidinalkaloide.
Abb. 2: Drei doppelt veresterte toxische Pyrrolizidinalkaloide (oben). Bausteine sind die Necinbasen Retronecin und Otonecin (s. Abb. 1) und zwei Dicarbonsäuren (unten).
Toxizität der Pyrrolizidinalkaloide
Etwa 95 dieser Alkaloide sind hepatotoxisch, pneumotoxisch, genotoxisch, teratogen, mutagen und karzinogen. Ihre Lebertoxizität äußert sich akut im Verschluss von Lebervenen (venöse okklusive Leberkrankheit), langfristig in der Ausbildung einer Leberzirrhose und von Lebertumoren [7]. Die hierbei auftretenden chemischen Reaktionen sind im Wesentlichen aufgeklärt [7, 8].
Zur Abwehr von Arzneimittelrisiken – Stufe 2 – hat die Kommission B6 verfügt, dass bei PA-haltigen Arzneizubereitungen die tägliche Exposition nicht mehr als 100 μg bei externer Anwendung, und nicht mehr als 1 μg bei interner Anwendung betragen darf [1, 2].
PA-haltige Pflanzen bei Hildegard
Auch einige der von Hildegard von Bingen (HvB) beschriebenen Heilpflanzen, mit denen sich schon Pfäffl eingehend befasst hat [18], enthalten toxische Pyrrolizidinalkaloide. Sie sollen im Folgenden besprochen werden.
Huoflatecha minor (HvB), Huflattich (Tussilago farfara, Compositae). Er ist von Europa und Nordafrika bis Ostasien heimisch und in Nordamerika eingebürgert. Angewendet wurden und werden seine Blätter bei Husten, Asthma und Bronchitis. Sie enthalten ätherische Öle, Bitterstoffe, Gerbstoffe, Tannine und die Pyrrolizidinalkaloide Senkirkin (3) [4] und in geringeren Mengen Senecionin (2) [24] (Abb. 2).
Über Vergiftungen durch Huflattich wurde wiederholt berichtet [19, 25, 26]. In Tierversuchen konnte bei hohen Dosierungen auch Karzinogenität nachgewiesen werden [11]. Auch durch Verwechslung mit Pestwurz (s. u.) sind Intoxikationen eingetreten [28]. Daher sollte man Huflattichblätter nicht selbst sammeln. Die in Apotheken erhältliche Droge und ihre Zubereitungen stammen aus autorisiertem Anbau von Sorten, die keine Pyrrolizidinalkaloide enthalten oder bei denen die PA durch geeignete Trennverfahren abgetrennt wurden. Nur diese können unbesorgt verwendet werden [16].
Huoflatecha maior (HvB), d. h. „großer Huflattich“, Pestwurz (Petasites hybridus syn. P. officinalis, Compositae). Sie ist in Europa bis Schottland und vor allem in Nordwestdeutschland weit verbreitet. Die Blätter werden in der Volksheilkunde als schleimlösendes Hustenmittel eingesetzt. Die Pflanze enthält die Sesquiterpene Petasin, Neopetasin und Isopetasin, Furanoeremophilane und Eremophilanlactone, aber auch die sehr toxischen Pyrrolizidinalkaloide Integerrimin (1), Senecionin (2) und Senkirkin (3) [4, 13] (Abb. 2).
Naturbelassene Pestwurzrhizome und -blätter können bei innerlichem Gebrauch je nach Dosierung schwere Intoxikationen der Leber auslösen (venöse okklusive Leberkrankheit, s. o.). Eine Intoxikation durch Pestwurz bei einem Neugeborenen ist in der Literatur dokumentiert [25]. Pestwurz kann im Frühling leicht mit Huflattich verwechselt werden; eine Intoxikation durch diese Verwechslung ist bekannt geworden [27].
Es sollte auf keinen Fall wildwachsende Pestwurz gesammelt und als Heilpflanze verwendet werden. Fertigpräparate, die bei Migräne, Heuschnupfen und krampfartigen Schmerzen des Magen-Darm-Systems verwendet werden, enthalten keine Pyrrolizidinalkaloide.
Lungwort (HvB), Geflecktes Lungenkraut (Pulmonaria officinalis, Boraginaceae). Es ist in weiten Teilen Europas verbreitet, vor allem in Mitteleuropa. Hildegard empfahl die „Lungenwurz“ zur Behandlung von Atemwegs- und Lungenerkrankungen. Das Kraut wurde und wird in der Volksmedizin bei Erkrankungen der Brust und der Lunge empfohlen. Es enthält Allantoin, Flavonoide, Catecholgerbstoffe, Gallotannine und Kieselsäure. Wegen der Zugehörigkeit der Pflanze zur Familie der Boraginaceae wurde zunächst vermutet, dass sie Pyrrolizidinalkaloide enthält. Dies ist nach den Untersuchungen von Lüthy nicht der Fall [14]. Die Verwendung wild gesammelter Pflanzenteile zur Selbstmedikation gilt als unbedenklich.
Wallwurtz (HvB), Echter Beinwell (Symphytum officinale, Boraginaceae). Sein Verbreitungsgebiet reicht von Südspanien und England bis nach Westasien. In Nordamerika wurde er eingebürgert und ist dort als Comfrey bekannt. Hildegard empfahl die Wurzeln als Wundheilmittel, bei Knochenbrüchen, Wunden, Geschwüren und Sehnenscheidenentzündungen. Sie werden auch heute bei denselben Indikationen eingesetzt. Ferner werden die Blätter als Salat verwendet.
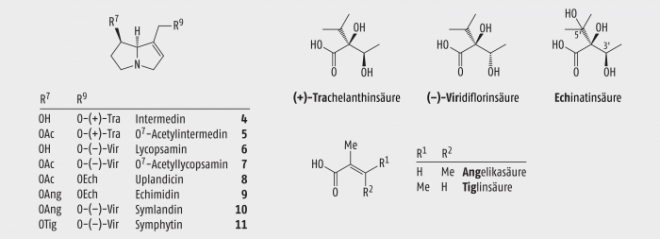
Neben Allantoin, Rosmarinsäure, Schleim- und Gerbstoffen, Asparagin, Flavonoiden, ätherischen Ölen, Harz und Kieselsäure enthält Beinwell eine Reihe von Pyrrolizidinalkaloiden. Als toxische PA sind zu nennen: Intermedin (4), 7-Acetyl-Intermedin (5), Lycopsamin (6), 7-Acetyl-Lycopsamin (7), Uplandicin (8), Echimidin (9), Symlandin (10) und Symphytin (11) [3, 9, 10, 17, 22, 23, 27] (Abb. 3). Ferner treten ihre ebenfalls toxischen N-Oxide auf.
Abb. 3: Toxische Pyrrolizidinalkaloide im Beinwell (u. a.), die durch Veresterung von Retronecin mit einer Necinsäure (4, 6),mit einer Necinsäure und Essigsäure (5, 7, 8) oder mit zwei Necinsäuren (9 – 11) entstanden sind.
Zahlreiche Vergiftungen durch Beinwell sind dokumentiert [15, 20, 21, 29 – 31]. Besonders empfindlich sind Neugeborene, Babys und Kinder bis zu drei Jahren. In Tierversuchen hat sich S. officinale als karzinogen erwiesen [12].
Man sollte Beinwell wegen der toxischen PA nicht wild sammeln oder im eigenen Garten anbauen, um ihn als Heilpflanze oder als Salat zu verwenden. Zur Herstellung von Fertigpräparaten wird nur PA-freier Beinwell verwendet [16].
Russischer Beinwell(Symphytum × uplandicum syn. S. peregrinum) wird sehr oft mit Echtem Beinwell verwechselt, zumal er ebenfalls als „Comfrey“ bezeichnet wird, und er besitzt auch ähnliche Wirkungen; deshalb sei er hier mit angeführt. Russischer Beinwell ist eine Hybride aus Symphytum officinale und S. asperum (Rauer Beinwell) und stammt aus Sibirien. Er wurde in zahlreichen europäischen Ländern und in Nordamerika, vornehmlich in Kanada, angebaut, teils als Futterpflanze für Rinder, Pferde und Schweine („Futter-Beinwell“), teils als Heil- und Salatpflanze.
Seitdem seine Toxizität für Weidetiere in Zusammenhang mit einer Vielzahl von Todesfällen erkannt ist, wird Russischer Beinwell nicht mehr als Futterpflanze und Heilpflanze verwendet. Die Pflanze ist aber in allen ehemaligen Anbaugebieten verwildert und kommt in Europa und Kanada auf vielen Ruderalflächen vor.
Russischer Beinwell enthält die gleichen Pyrrolizidinalkaloide wie Echter Beinwell (Verbindungen 4 bis 11) [5, 6]. |
Literatur
[1] Kommission B6, Abwehr von Arzneimittelrisiken – Stufe 2 (BAnz v. 17. Juni 1992, S. 4805). Zitiert in: Dtsch Apoth Ztg 1992;132:1406
[2] jb. Grenzwerte für Pyrrolizidinalkaloide. Dtsch Apoth Ztg 2015;155(31):32-33
[3] Brauchli J, et al. Pyrrolizidine alkaloids from Symphytum officinale L. and their percutaneous absorption in rats. Experientia 1982;38:1085-1087
[4] Culvenor CCJ, et al. The occurrence of senkirkine in Tussilago farfara. Aust J Chem 1976;29:229-230
[5] Culvenor CCJ, et al. The alkaloids of Symphytum × uplandicum (Russian Comfrey). Aust J Chem 1980;33:1105-1113
[6] Culvenor CCJ, et al. Structure and toxicity of the alkaloids of Russian comfrey (Symphytum × uplandicum Nyman), a medicinal herb and item of human diet. Experientia 1980;36:377-379
[7] Fu PP, et al. Genotoxic Pyrrolizidine Alkaloids-Mechanism Leading to DNA Adduct Formation und Tumorigenicity. Int J Mol Sci 2002;3:948-964
[8] Fu PP, et al. Pyrrolizidine Alkaloids – Genotoxicity, Metabolism Enzymes, Metabolic Activation, and Mechanisms. Drug Metabol Rev 2004;36:1-55
[9] Furuya T, Araki K. Studies on Constituents of Crude Drugs. I. Alkaloids of Symphytum officinale Linn. Chem Pharm Bull 1968;16:2512-2516
[10] Furuya T, Hikichi M. Alkaloids and Triterpenoids of Symphytum officinale. Phytochemistry 1971;10:2217-2220
[11] Hirono I, Mori H, Culvenor CCJ. Carcinogenic activity of coltsfoot, Tussilago farfara L. Gann 1976;67:125-129
[12] Hirono I, Mori H, Haga M. Carcinogenic activity of Symphytum officinale. J Natl Cancer Inst 1978;61:865-869
[13] Lüthy J, et al. Pyrrolizidine alkaloides in Petasites hybridus L. and P. albus L. Pharm Acta Helv 1983;58:98-100
[14] Lüthy J, et al. Pyrrolizidin-Alkaloide in Arzneipflanzen der Boraginaceen; Borago officinalis L. und Pulmonaria officinalis L. Pharm Acta Helv 1984;59:242-246
[15] Mei N, et al. Metabolism, Genotoxicity, and Carcinogenicity of Comfrey. J Toxicol Environ Health 2010;B13:509-526
[16] Mütterlein R, Arnold CG. Untersuchungen zum Pyrrolizidinalkaloidgehalt und Pyrrolizidinalkaloidmuster in Symphytum officinale L. Versuche zur Gewinnung pyrrolizidinalkaloidarmer Pflanzen bzw. Pflanzenteile. Pharm Ztg Wiss 1993;138:119-125
[17] Pedersen E. Pyrrolizidine Alkaloids in Danish species of the family Boraginaceae. Arch Pharm Chem Sci Ed 1975;3:55-64
[18] Pfäffl, A. Die pharmazeutische Botanik der hl. Hildegard von Bingen. Diss med, München 1951
[19] Rasenack R, et al. Veno-Occlusive Disease in a Fetus Caused by Pyrrolizidine Alkaloids of Food Origin. Fetal Diagn Ther 2003;18:223-225
[20] Ridker PM, et al. Hepatic Venoocclusive Disease Associated with the Consumption of Pyrrolizidine-Containing Dietary Supplements. Gastroenterology 1985;88:1050-1054
[21] Ridker PM, McDermott WV. Comfrey herb tea and hepatic veno-occlusive disease. Lancet 1989;335:657-658
[22] Roeder E, Neuberger V. Pyrrolizidinalkaloide in Symphytum-Arten. Dtsch Apoth Ztg 1988;128:1991-1994
[23] Roeder E, Bourauel T, Neuberger V. Symviridine, a new pyrrolizidine alkaloid from Symphytum species. Phytochemistry 1992;31:4041-4042
[24] Rosberger DF, Resch JF, Meinwald JF. The Occurrence of Senecionine in Tussilago farfara. Mitt Gebiete Lebensm Hyg 1981;72:432-436
[25] Roulet M, et al. Hepatic veno-occlusive disease in newborn infant of a woman drinking herbal tea. J Pediatr 1988;112:433-436
[26] Sperl W, et al. Reversible hepatic veno-occlusive disease in an infant after consumption of pyrrolizidine-containing herbal tea. Eur J Pediatr 1995;154:112-116
[27] Stengl P, Wiedenfeld H, Roeder E. Lebertoxische Pyrrolizidin-Alkaloide in Symphytum-Präparaten. Dtsch Apoth Ztg 1982;122(16):851-855
[28] Stuppner H, et al. Verwechslung von Tussilago farfara mit Petasites hybridus – Ein aktueller Fall von Pyrrolizidinalkaloid-Intoxikation. Sci Pharm 1992;60:160
[29] Weston CFM, et al. Veno-occlusive disease of the liver secondary to ingestion of comfrey. Br Med J 1987;295:183
[30] Winship KA. Toxicity of comfrey. Adverse Drug React Toxicol Rev 1991;10:47-59
[31] Yeong ML, et al. Hepatic veno-occlusive disease associated with comfrey ingestion. J Gastroenterol Hepatol 1990;5:211-214























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.