
- DAZ.online
- DAZ / AZ
- DAZ 45/2015
- Temporarily not available
Thema Impfstoffe
Temporarily not available
Zur Problematik der Lieferengpässe bei Impfstoffen

Die Liste der nicht lieferbaren Impfstoffe
Seit dem 9. Oktober 2015 ist auf der Internetseite des Paul-Ehrlich-Instituts (PEI) eine Liste derjenigen Humanimpfstoffe zu finden, die derzeit nicht lieferbar sind. Erstaunlicherweise ist die Liste relativ lang (Tab. 1, in einer modifizierten Version), und die Defekte betreffen vor allem die beiden großen Impfstoffhersteller GlaxoSmithKline GmbH & Co. KG und Sanofi Pasteur MSD GmbH. Neben tetravalenten Influenza-Impfstoffen und einigen Einzelkomponenten-Impfstoffen wie eine Hepatitis-A-, eine Typhus-, eine Tollwut- und eine Polio-Vakzine sind vor allem die komplexer zusammengesetzten Kombinationsimpfstoffe nicht lieferbar. Diese Kombinationsimpfstoffe bestehen aus vier bis sechs Komponenten und sollen gleichzeitig vor Diphtherie, Tetanus, Pertussis, Poliomyelitis und eventuell Hepatitis B sowie einer Haemophilus-influenzae-Typ-b-Infektion schützen. Zugelassen sind einige dieser Impfstoffe bereits für Kleinkinder im Alter von sechs Wochen.
Impfstoff |
Stoff- oder Indikationsgruppe |
Verfügbarkeit |
Zusatzinformationen |
PU, Kontakt |
|---|---|---|---|---|
|
Begripal®
1 × 0,5 ml/10 × 0,5 ml
Fertigspritze
|
Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen (Virusimpfstoff, inaktiviert)
intramuskulär
Verwendung ab einem Lebensalter von sechs Monaten
|
in Saison 2016/17 wieder lieferbar |
alternative Impfoption:
andere inaktivierte saisonale Influenzaimpfstoffe (Altersindikation beachten)
|
Hexal AG |
Boostrix® Polio 1 × 0,5 ml/10 × 0,5 ml Fertigspritze |
TdPa-IPV-Impfstoff
Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)-, Poliomyelitis (inaktiviert)-Adsorbat-Impfstoff
Verwendung ab einem Lebensalter von vier Jahren
|
geprüfte Chargen für Q4 2015 bereits vollständig in den Großhandel abverkauft, nächste Lieferung durch den Hersteller Q1 2016 |
Handlungsempfehlung der STIKO unter www.rki.de: Repevax® (Tdap-IPV) (wenn verfügbar);
oder:
Boostrix® (Tdap) oder TdaP-Immun und Verschiebung der Polio-Impfung auf nächstmöglichen Termin
bei dringender Polio-Impfindikation monovalente IPV-Impfung (sobald verfügbar) oder Revaxis® (Td-IPV)
|
GSK GlaxoSmithKline GmbH & Co. KG |
Fluenz® Tetra 1 × 0,2 ml/10 × 0,2 ml Nasenapplikator |
Influenza Virus Type A, H1N1/Influenza Virus A, H3N2/Influenza Virus Type B (Victoria lineage)/Influenza Virus, Type B (Yamagata lineage)
Verwendung ab einem Lebensalter von zwei Jahren bis einschließlich 17 Jahren
|
in Saison 2016/17 wieder lieferbar |
alternative Impfoption:
andere inaktivierte saisonale Influenzaimpfstoffe (Altersindikation beachten)
|
Astra Zeneca GmbH |
|
Havrix® 1440
1 × 1 ml/10 × 1 ml Fertigspritze
|
Hepatitis-A-Impfstoff (Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von 16 Jahren
|
wieder lieferbar ab Q1/2016 |
alternative Impfstoffoptionen:
Vaqta® Kinder (15 bis 17 Jahre) oder
Vaqta (ab 18 Jahre)
|
GSK GlaxoSmithKline GmbH & Co. KG |
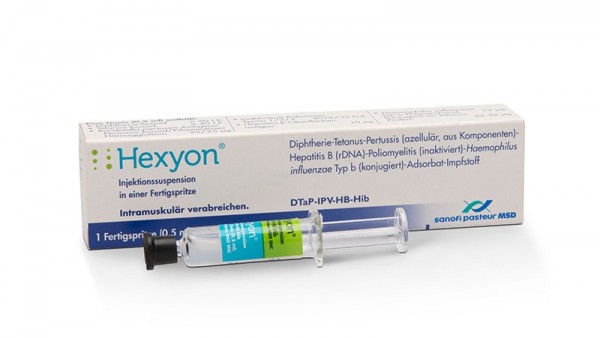
Hexyon®1 × 1/10 × 1/50 × 1 Fertigspritze |
DTPa-HepB-IPV + Hib-Impfstoff
Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)-, Hepatitis-B(rDNA)-, Poliomyelitis (inaktiviert)-, Haemophilus-influenzae-Typ-b(konjugiert)-Adsorbat-Impfstoff
Verwendung ab einem Lebensalter von sechs Wochen
|
ab voraussichtlich Januar 2016 lieferbar |
alternative Impfstoffoption:
Infanrix® Hexa
|
SPMSD Sanofi Pasteur MSD GmbH |
Infanrix® IPV+HIB (1 oder 10 Fertigspritzen + 1 Durchstech-flasche) |
DTPa-IPV + Hib-Impfstoff
Diphtherie-, Tetanus-, Pertussis(azellulär)-, Poliomyelitis(inaktiviert)- und Haemophilus-influenzae-Typ-b-Konjugat-Impfstoff
Verwendung ab einem Alter von zwei Monaten
|
bis voraussichtlich Ende 2015 nicht lieferfähig |
Handlungsempfehlung der STIKO unter www.rki.de: Impfung mit einem sechsvalenten Impfstoff (DTaP-IPV-Hib-HepB), z. B. Infanrix® Hexa |
GSK-GlaxoSmithKline GmbH & Co. KG |
Influsplit® Tetra 1 × 0,5/10 × 0,5 ml Fertigspritze |
Influenza-Spaltimpfstoff
(Virusimpfstoff, inaktiviert) intramuskulär
Verwendung ab einem Lebensalter von drei Jahren
|
in Saison 2016/17 wieder lieferbar |
alternative Impfoption:
andere inaktivierte saisonale Influenzaimpfstoffe (Altersindikation beachten)
|
GSK GlaxoSmithKline GmbH & Co. KG |
|
IPV Merieux®
1 × 0,5 ml/10 × 0,5 ml Fertigspritze
|
Poliomyelitis-Impfstoff (Virusimpfstoff, inaktiviert)
Verwendung ab einem Lebensalter von drei Monaten
|
lieferbar voraussichtlichDezember 2015 |
Handlungsempfehlung der STIKO unter www.rki.de: Verwendung von verfügbaren Kombinationsimpfstoffen mit IPV-Komponente |
SPMSD Sanofi Pasteur MSD GmbH |
Pentavac®1 × 1/10 × 1 Durchstech-flasche + Fertigspritze |
DTPa-IPV + Hib-Impfstoff
Diphtherie-, Tetanus-, azellulärer Pertussis-, inaktivierter Poliomyelitis (adsorbiert)- und Haemophilus-influenzae-Typ-b-Konjugat-Impfstoff
Verwendung ab einem Lebensalter von zwei Monaten
|
lieferbar voraussichtlich Januar 2017 |
Handlungsempfehlung der STIKO unter www.rki.de: Impfung mit einem sechsvalenten Impfstoff (DTaP-IPV-Hib-HepB), z. B. Infanrix® Hexa, zugelassen bis 36 Monate |
SPMSD Sanofi Pasteur MSD GmbH |
Repevax®1 × 1/10 × 1 Fertigspritze |
TdPa-IPV-Impfstoff
Diphtherie-, Tetanus-, Pertussis (azellulär, aus Komponenten)-, Poliomyelitis (inaktiviert)-Adsorbat-Impfstoff
Verwendung ab einem Lebensalter von drei Jahren
|
lieferbar voraussichtlich November 2015 |
Handlungsempfehlung der STIKO unter www.rki.de: Boostrix® Polio (Tdap-IPV) (wenn verfügbar);
oder:
Boostrix® (Tdap) oder TdaP-Immun und Verschiebung der Polio-Impfung auf einen nächstmöglichen Termin;
bei dringender Polio-Impfindikation monovalente IPV-Impfung (sobald verfügbar) oder Revaxis® (Td-IPV)
|
SPMSD Sanofi Pasteur MSD GmbH |
|
Tollwut-Impfstoff HDC®
1 × Pulver mit Lösungsmittel
|
Tollwut-Impfstoff
(Virusimpfstoff, inaktiviert)
Verwendung ab der Geburt
|
lieferbar voraussichtlich Dezember 2015 |
alternative Impfstoffoption:
Rabipur® (60a/84, PEI.H.11793.01.1)
|
SPMSD Sanofi Pasteur MSD GmbH |
Typherix®1 Fertigspritze |
Typhus-Polysaccharid-Impfstoff
Verwendung ab einem Lebensalter von zwei Jahren
|
nicht lieferfähig bis voraussichtlich Ende 2016 |
alternative Impfstoffoption:
Typhim® Vi
|
GSK GlaxoSmithKline GmbH & Co. KG |
Typhim® Vi |
Typhus-Polysaccharid-Impfstoff
Verwendung ab einem Lebensalter von zwei Jahren
|
Ende Dezember 2015/Januar 2016 |
Handlungsempfehlung der STIKO unter www.rki.de |
SPMSD Sanofi Pasteur MSD GmbH |
ViATIM®
|
Typhus-Vi-Kapselpolysaccharid- und Hepatitis-A-Kombinationsimpfstoff, gereinigt, inaktiviert
Verwendung ab einem Lebensalter von 16 Jahren
|
März 2016 |
Handlungsempfehlung der STIKO unter www.rki.de |
SPMSD Sanofi Pasteur MSD GmbH |
Hinweis: Diese Auflistung macht keine Aussage über die Marktverfügbarkeit. Bedingt durch die Handelskette der Impfstoffe über den Großhandel in die Apotheke besteht die Möglichkeit, dass in einzelnen Apotheken oder Regionen ein Impfstoff nicht vorhanden ist, obwohl kein Lieferengpass erkennbar ist. | ||||
Impfstoffe – eine besondere Kategorie von Arzneimitteln
Sechs Wochen alten Babies, die eigentlich gesund sind, etwas zu injizieren – da muss man sich schon sehr sicher sein, dass diese Injektion keinen Schaden anrichtet und ausreichend Nutzen bringt. Auch ältere Impflinge sollten sich fit und gesund fühlen, wenn sie eine Vakzine verabreicht bekommen – schließlich wird bei einer aktiven Immunisierung das Immunsystem mobilisiert. Sind die körpereigenen Abwehrkräfte jedoch schon anderweitig gefordert, kann eine Impfung hier eher störend wirken und zu heftigen Reaktionen oder gar zu Erkrankungen führen. Impfstoffe werden prinzipiell also Gesunden verabreicht, weshalb sich andere Nutzen-Risiko-Fragen stellen mit einem sehr viel stärkeren Fokus auf Qualität und Sicherheit als bei Wirkstoffen zur Therapie einer (schwerwiegenden) Krankheit: Der Nutzen der Vakzinierung bleibt für die Impflinge zunächst relativ vage – ist doch unsicher, ob es überhaupt zu einer Infektion kommen wird. Umso schwerer wiegt ein mögliches Risiko durch schädigende Bestandteile, Verunreinigungen, unzureichende Inaktivierung der Pathogene etc. Wie relevant diese Nutzen-Risiko-Abwägung ist, sieht man daran, dass in vielen Ländern von der sehr preiswert herstellbaren Polio-Schluckimpfung auf sicherere Impfstoffe gewechselt wurde, die inaktivierte Viren enthalten – kam und kommt es doch immer wieder zu seltenen Fällen einer Impfvirus-Poliomyelitis nach einer Schluckimpfung.
Impfstoffe müssen also besonders sicher und qualitativ hochwertig sein. Gleichzeitig sind die Moleküle, die typischerweise verimpft werden, biogenen Ursprungs und stammen aus einer sehr komplexen Matrix. Unter diesen Umständen ein reines Antigen für Impfstoffe zu isolieren, ist eine große Herausforderung. Kein Wunder also, dass jede Produktionscharge einer Vakzine vom Paul-Ehrlich-Institut im Rahmen der staatlichen Chargenprüfung geprüft und freigegeben werden muss.
Die Influenza-Impfstoffe
Drei verschiedene Influenza-Impfstoffe sind laut Liste des PEI bereits ausverkauft: zum einen die trivalente Vakzine Begripal® von Hexal (laut Rote Liste 1 Fertigspritze zu 18,49 Euro, 10 Fertigspritzen zu 86,08 Euro) und zum anderen die beiden tetravalenten Impfstoffe Fluenz® Tetra von Astra Zeneca (laut Rote Liste 1 Nasenapplikator zu 36,09 Euro, 10 Nasenapplikatoren zu 249,94 Euro) und Influsplit® Tetra von GSK (laut Rote Liste 1 Fertigspritze zu 23,00 Euro, 10 Fertigspritzen zu 131,09 Euro).
Jedes Jahr im Februar gibt die Weltgesundheitsorganisation WHO die Empfehlung heraus, welche Influenza-Virusstämme für die Impfstoffherstellung verwendet werden müssen. Basis dafür sind die Meldedaten der auf der Nord- bzw. Südhalbkugel aufgetretenen Grippefälle. Für die Saison 2015/2016 wurden die Stämme A/California/07/2009 (H1N1) pdm 09-ähnlich, A/Switzerland/9715293/2013 (H3N2)-ähnlich und B/Phuket/3073/2013-ähnlich (Yamagata-Linie) für die trivalenten Impfstoffe und eventuell zusätzlich noch B/Brisbane/60/2008 (Victoria-Linie) für eine tetravalente Vakzine empfohlen. Mit dieser im Vergleich zum Vorjahr etwas modifizierten Zusammensetzung wurde einerseits darauf reagiert, dass die Virus-A-H3N2-Komponente in der letzten Saison keinen ausreichenden Schutz geliefert hat. Zusätzlich wurde der B-Virusstamm im Vergleich zum Vorjahr ausgetauscht.
Seit 2013 werden neben trivalenten Influenza-Impfstoffen auch tetravalente Influenza-Impfstoffe angeboten.
Sobald die empfohlenen Virusstämme zur Verfügung stehen, kann mit der Produktion der Impfstoffe begonnen werden, die mehrere Monate in Anspruch nimmt. Allein der Schritt, ausgehend von ca. 1 ml zur Verfügung gestelltem Saat-Virusmaterial ausreichende Mengen Viren für die Produktion herzustellen, dauert mindestens vier Wochen.
Die besondere Situation bei Influenza-Impfstoffen
Nach wie vor werden die Influenza-Impfstoffe in angebrüteten Hühnereiern hergestellt, die von spezifiziert pathogenfreien Herden stammen. Unter optimalen Bedingungen kann aus einem Ei Virusmaterial für ein oder zwei Impfdosen gewonnen werden – wohlgemerkt pro Stamm. Für den tetravalenten Impfstoff werden also auch vier statt nur drei „Ansätze“ Hühnereier für eine bestimmte Impfdosismenge benötigt. Bei neuen Virusstämmen besteht zudem die Unsicherheit, ob sie sich gut in Hühnereiern vermehren lassen. In der Vergangenheit kam es immer wieder einmal zu Lieferengpässen bei Grippe-Impfstoffen, weil nicht ausreichende Mengen Hühnereier der geforderten Qualität zur Verfügung standen oder weil Virusstämme zu aggressiv waren und die Hühnereier zu sehr schädigten, wodurch die Ausbeute dramatisch reduziert wurde.
Zu Beginn der Produktion muss also die Entscheidung getroffen werden, wie viele Impfdosen hergestellt werden sollen. Wird die Produktionsmenge zu hoch angesetzt, bleiben die Hersteller auf den Impfstoffen sitzen. Wird die Menge zu niedrig angesetzt, kommt es im Laufe der Impfsaison zu Lieferengpässen und die Verbraucher beschweren sich.
Laut Herstellerangaben hat GSK die Produktion des tetravalenten Influenza-Impfstoffes im Vergleich zum Vorjahr um mehr als die Hälfte gesteigert und an die verschiedenen Länder, die bereits vorab bestellt hatten, wie USA, Brasilien, Südkorea, Belgien, Italien und natürlich auch Deutschland ausgeliefert.
Für die Saison 2015/2016 wurden seit Anfang August – also nur sechs Monate nachdem die Empfehlung der WHO ausgesprochen wurde – vom Paul-Ehrlich-Institut fast 21 Millionen Impfdosen freigegeben. Das sind ungefähr drei Millionen Dosen mehr als für die Vorjahressaison und das, obwohl 2014 selbst die knapp 18 Millionen Impfdosen nicht komplett abgerufen wurden und noch Reste vernichtet werden mussten. Und dennoch sind jetzt bestimmte, vor allem tetravalente, Grippe-Impfstoffe bereits ausverkauft. Offensichtlich haben die Hersteller GSK für Influsplit® Tetra und Astra Zeneca für Fluenz® Tetra den Bedarf an tetravalentem Impfstoff in Deutschland unterschätzt. Die Nachfrage war deutlich größer, obwohl die gesetzlichen Krankenkassen für ihre Kunden nur die wesentlich billigere trivalente Vakzine bezahlen. Aber nachdem in der letzten Grippesaison sehr viele Krankheitsfälle aufgetreten waren – zum Teil auch trotz Impfung – wollten offensichtlich in dieser Saison viele „auf Nummer sicher“ gehen und sich vorsichtshalber den tetravalenten Impfstoff verabreichen lassen. Zumal bereits darauf hingewiesen wird, dass in Australien eine Grippe-Epidemie durch ein Influenza-B-Virus ausgelöst wurde, das im dortigen Impfstoff nicht enthalten war und in Europa nur den tetravalenten Vakzinen beigemischt ist. Auf derartige, recht spontane Entscheidungen der Verbraucher können Hersteller nicht mehr rechtzeitig reagieren. Eine Nachproduktion für die laufende Saison ist durch die lange Herstellungszeit nicht mehr möglich. Allerdings stehen nach wie vor 17 verschiedene trivalente Impfstoffe zur Verfügung, die auch einen gewissen Schutz vor einer echten Grippe bieten.
Die Kombinationsimpfstoffe mit bis zu sechs Komponenten
Die derzeit nicht lieferbaren Kombinationsimpfstoffe setzen sich alle aus Diphtherie-Toxoid, Tetanus-Toxoid, Pertussis-Antigenen und inaktivierten Polioviren zusammen, eventuell noch zusätzlich versetzt mit Haemophilus-influenzae-Typ-b-Antigen und rekombinant hergestelltem Hepatitis-B-Oberflächenprotein. Jede Komponente muss gesondert hergestellt werden und stellt ganz unterschiedliche Ansprüche an die Produktion. Für die Toxoide müssen die grampositiven Bakterien Clostridium tetani und Corynebacterium diphtheriae kultiviert und das Exotoxin isoliert und inaktiviert werden. Vom gramnegativen Bakterium Bordetella pertussis werden drei verschiedene Antigene isoliert: das filamentöse Hämagglutinin, das inaktivierte Exotoxin Pertussistoxin und das Membranprotein Pertactin. Die Poliomyelitis-Komponente besteht aus inaktivierten Viren dreier unterschiedlicher Stämme der Typen 1 (Mahoney), 2 (MEF 1) und 3 (Saukett), die jeweils separat in Vero-Zellen angezüchtet und isoliert werden müssen. Ist zusätzlich das Haemophilus-influenzae-Typ-b-Antigen enthalten, müssen Polysaccharide aus der Zellhülle der gramnegativen Bakterien isoliert werden. Da diese Moleküle jedoch selbst nicht ausreichend immunogen sind, werden sie in einem weiteren Produktionsschritt an das Tetanus-Toxoid konjugiert. Vergleichsweise „einfach“ ist demgegenüber die Herstellung der Hepatitis-B-Komponente: Hierfür wird das Oberflächenantigen HBsAg rekombinant in Hefezellen exprimiert und aufgereinigt.
Wenn die Komplexität zum Problem wird
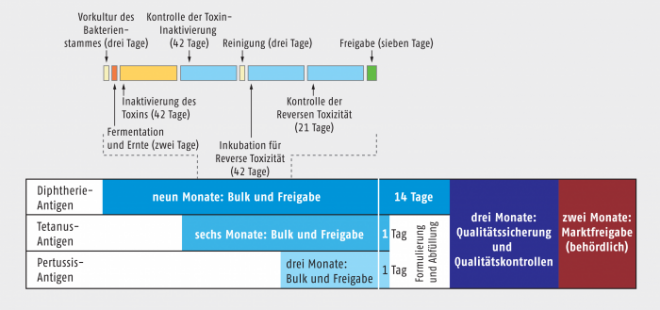
Allein schon, wenn man diese Aufzählung liest, kann man sich vorstellen, dass die Herstellung eines entsprechenden Impfstoffes nicht ganz trivial und relativ zeitaufwändig ist (Abb. 1). Fällt eine Komponente wegen irgendeines Problems aus, ist die Produktion dieses Impfstoffs komplett gestoppt.
Und es können Probleme auftreten! Jedes biologische System ist anfällig gegen kleine Änderungen und so müssen alle Ausgangsmaterialien, alle Zusatzstoffe, Reinigungsmittel, Maschinen, Räume und Ausrüstungen immer wieder sorgfältig kontrolliert werden. Auf diese Weise addieren sich für jeden Impfstoff mehrere hundert Kontrollen, die zeitlich relevant zu Buche schlagen. Dauert die Herstellung im Schnitt zehn Monate für monovalente Impfstoffe und bis zu 25 Monate für komplexere Vakzine, entfällt nur 30% dieser Zeit auf die eigentliche Produktion der Antigene. 70% der Herstellungszeit muss für Maßnahmen zur Qualitätssicherung und Qualitätskontrolle veranschlagt werden!
Abb. 1: Für Kombinationsimpfstoffe sind lange Produktionszeiten zu veranschlagen (Beispiel Tdpa-Vakzine) [Quelle: GSK, Foliensatz „Impfstoffentwicklung – Ein Meilenstein in der Medizingeschichte“]
Bei weltweit agierenden Herstellern wie GSK und Sanofi Pasteur MSD werden diese einzelnen Komponenten zudem an unterschiedlichen Standorten produziert, und wiederum an anderer Stelle abgefüllt und verpackt, was eine große logistische Herausforderung darstellt. Somit lassen sich auch Kombinationsimpfstoffe nicht einfach mal eben „auf die Schnelle“ nachproduzieren. Liefert irgendein Kontrollschritt ein negatives Resultat, muss die komplette Produktion neu gestartet werden. Offensichtlich ist das nicht allzu oft der Fall, aber es passiert: 2012 kam es beispielsweise zum Rückruf einiger Chargen von Infanrix® Hexa aufgrund der Möglichkeit einer mikrobiellen Kontamination. Auch für den derzeitigen Lieferengpass bei Boostrix® Polio und Infanrix® IPV + Hib gibt der Hersteller GSK als Grund „Verzögerungen bei der internen Qualitätskontrolle“ bekannt. Ein weiterer Grund für die Lieferengpässe liegt in einem erhöhten Bedarf: Durch die weltweit gestiegene Nachfrage nach Pertussis- und Polioimpfstoffen reicht die derzeitige Produktionskapazität zum Teil nicht aus, um die entsprechenden Kombinationsimpfstoffe auch in vollem Umfang mit diesen Komponenten zu bedienen. Insofern spüren wir jetzt etwas die Folgen der eigentlich sehr positiv zu wertenden weltweiten Initiative zur Ausrottung der Poliomyelitis: In einigen Ländern, zum Beispiel in Afrika, wird die Mono-Impfung empfohlen, und diese Länder werden derzeit bevorzugt von den Herstellern mit Impfstoffen beliefert. Demgegenüber ist der Zustrom an Asylanten mit unklarem Impfstatus nach Mitteilung der Hersteller (noch?) nicht für eine gestiegene Nachfrage und damit in Konsequenz für einen Lieferengpass der Impfstoffe verantwortlich.
Jahr |
Dauer |
Entwicklungsphase |
Ziele |
Erfolgswahr-scheinlichkeit für den Markteintritt |
|---|---|---|---|---|
1 |
2 bis 5 Jahre |
Forschung |
Identifikation und Produktion der Antigene |
1‰ |
2 | ||||
3 |
Produktionsverfahren* |
Entwicklung des industriellen Produktionsverfahrens, Bau der Produktionsanlage |
||
4 | ||||
5 | ||||
6 |
1 bis 2 Jahre |
präklinische Entwicklung |
Erprobung der Wirksamkeit, Toxikologie mit Labortests, Tierversuche |
|
7 | ||||
8 |
1 bis 2 Jahre |
Phase I (klinische Entwicklung) |
Erprobung der Sicherheit,
20 bis 80 Probanden
|
39% |
9 | ||||
10 |
1 bis 2 Jahre |
Phase II (klinische Entwicklung) |
Erprobung der Wirksamkeit, Sicherheit, Verträglichkeit; 100 bis 300 Probanden |
54% |
11 | ||||
12 |
1 bis 5 Jahre |
Phase III (klinische Entwicklung)** |
Erprobung der Wirksamkeit, Sicherheit, Verträglichkeit; 1000 bis 70.000 Probanden |
68% |
13 | ||||
14 | ||||
15 | ||||
16 | ||||
17 |
1 bis 3 Jahre |
Zulassung |
behördliche Prüfung der Wirksamkeit, Sicherheit, Verträglichkeit |
96% |
18 | ||||
19 | ||||
20 – 35 |
1 bis 15 Jahre |
Phase IV (Post-Marketing-Suveillance) |
Monitoring Pharmakovigilanz; Zulassungsänderungen |
|
* hohe Investitionen erforderlich bei hohem Risiko, Kenntnis und Erfahrung ** hohe Kosten durch außergewöhnlich große Studien | ||||
Betrachtung der Gesamtsituation
Mit der neuen Liste des PEI zu Lieferengpässen bei Impfstoffen ist nun ein sehr schneller Überblick möglich, der einem durchaus einen Schrecken einjagen kann. Allerdings kann hier ein Mehr an Transparenz auch ein falsches Bild zeichnen. Denn bekanntlich ist es auch in der Vergangenheit immer wieder zu Lieferengpässen gekommen, die deutlich weniger prominent wahrgenommen wurden, weil die Versorgung dennoch gewährleistet war. Bisher ist das Thema „Drohende Infektionsgefahr durch fehlende Impfstoffe“ noch nicht bei „Spiegel online“, „Focus online“ oder „Bild online“ angekommen. In Fachkreisen wird jedoch darüber diskutiert, dass die Rabattierung der Impfstoffe einerseits und die Monopolisierung der Herstellung andererseits auf lange Sicht die Versorgung beeinträchtigen können. Im Moment scheint die Versorgung noch nicht wirklich gefährdet zu sein, da es immer noch Alternativen und Ausweichmöglichkeiten gibt, die in den Zusatzinformationen der PEI-Liste aufgeführt werden. Hinsichtlich der Monopolisierung der Produktion ist es natürlich durchaus auffällig, dass GSK und Sanofi Pasteur MSD inzwischen die beiden großen Impfstoffhersteller sind, die den Markt dominieren. Auf der anderen Seite können es sich nur wenige Firmen leisten, über Monate hinweg aufwändige und qualitativ sichere Impfstoffe herzustellen, um dann eventuell feststellen zu müssen, dass die gesetzlichen Krankenkassen einem anderen Hersteller den Zuschlag erteilen.
Noch ein Aspekt in eigener Sache: Für diesen Artikel erwies sich die Recherche deutlich mühsamer als das gemeinhin der Fall ist. Man spricht offensichtlich nicht gern über vermeintliche Schwächen, und schon gar nicht schreibt man darüber. Vielmehr zeigen sich die Hersteller sehr zurückhaltend und etwas zugeknöpft, wenn man detailliertere Informationen nachfragt. Das ist ein erhebliches Handicap für denjenigen, der möglichst objektiv informieren möchte. Zurückgehaltene Fakten lassen Platz für Spekulationen, und die fallen hierzulande leider meist negativ aus. Es wäre daher wünschenswert, wenn dem von vielen Deutschen als negativ wahrgenommenen Image der Pharmaindustrie an geeigneter Stelle mit einer angemessenen Informations-Offensive für Fachleute und Laien begegnet würde. |
Quelle
Übersicht zu Lieferengpässen von Human-Impfstoffen gegen Infektionskrankheiten, Paul-Ehrlich-Institut, www.pei.de
Impfstoffentwicklung – Ein Meilenstein in der Medizingeschichte. GlaxoSmithKline GmbH & Co. KG
The Complex Journey of a Vaccine – The manufacturing chain, regulatory requirements and vaccine availability. International Federation of Pharmaceutical Manufacturers & Associations
PhRMA Vaccine FactBook 2013. Pharmaceutical Research and Manufacturers of America.
Einblicke in die Impfstoffproduktion. Dr. Peter Schu, GlaxoSmithKline Biologicals
Reaktive Stellungnahme „Tetravalenter Grippe-Impfstoff von GSK ist ausverkauft“. GlaxoSmithKline GmbH & Co. KG
Reaktive Stellungnahme „Lieferengpässe Impfstoffe im Zusammenhang mit Asylsuchenden in Deutschland“. GlaxoSmithKline GmbH & Co. KG


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.