
- DAZ.online
- DAZ / AZ
- DAZ 18/2015
- Brauchen Dicke mehr
Dosisanpassung
Brauchen Dicke mehr?
Bei Adipösen kann sich die Pharmakokinetik einzelner Arzneistoffe ändern

Die Zahl der Menschen mit Adipositas hat sich seit 1980 weltweit verdoppelt. In Deutschland sind über die Hälfte der Erwachsenen und 15 Prozent der Drei- bis Siebzehnjährigen übergewichtig; fast jeder vierte Erwachsene und sechs Prozent der Kinder und Jugendlichen sind sogar adipös, so die Deutsche Adipositas-Gesellschaft (www.adipositas-gesellschaft.de). Bei täglich 3,6 Millionen Kunden in den deutschen Apotheken müsste sich also etwa 1,8 Millionen-mal am Tag die Frage stellen, ob die Arzneimitteltherapie wegen des Übergewichts verändert werden muss, bei gut 20.600 Apotheken in Deutschland also in jeder Apotheke gut 80-mal jeden Tag.
Für viele dieser Fälle kann Entwarnung gegeben werden: Etliche Wirkstoffe, zumal in der Selbstmedikation, haben eine wenig kritische Indikation, eine große therapeutische Breite, oder es ist aus medizinischer Sicht möglich, sich an die optimal wirksame Dosis langsam heranzutasten. Wenn es aber darauf ankommt, schnell eine therapeutische Wirkung zu erreichen und dabei unerwünschte Wirkungen zu vermeiden (z. B. Gerinnungshemmung, antiinfektive Therapie), oder wenn die therapeutische Wirkung und damit die „richtige“ Dosis schwer feststellbar sind (z. B. Zytostatika, psychiatrische Arzneimittel), ist es wichtig, die passende Dosis sofort und sicher zu treffen.
Laut World Obesity Federation (www.worldobesity.org) erhöht Übergewicht das Risiko für folgende Erkrankungen: Typ-2-Diabetes, Hypertonie, Koronarerkrankung, diverse Krebsformen, Erkrankungen der Gallenblase, nicht-alkoholische Steatohepatitis, Schlafapnoe und Osteoarthritis. Auch chronischer Schmerz und nosokomiale Infektionen werden als überdurchschnittlich häufige Begleiter der Adipositas diskutiert [1]. Für Wirkstoffe mit diesen Indikationen ist die Frage nach einer Dosisanpassung also zuallererst zu beantworten.
Wie viel wovon ist zu viel?
Es gibt verschiedene Parameter, um die Körpermaße zu beschreiben und in Normal- und Übergewicht einzuteilen.
Der wichtigste Parameter ist der Body Mass Index (BMI), also der Quotient aus dem tatsächlichen Körpergewicht (Total Body Weight, TBW) und dem Quadrat der Körperlänge, gemessen in kg/m². Er wurde bereits 1832 von Adolphe Quetelet aus anthropometrischen Messungen entwickelt.
- Als normal gilt ein BMI von 18,5 bis unter 25.
- Ab 25 beginnt das Übergewicht.
- Ein BMI über 30 fällt in die Kategorie „Adipositas“, die in „Grad 1“ (bis 35), „Grad 2“ (35 bis 40) und „Grad 3“ (> 40) eingeteilt wird.
Da der BMI nicht berücksichtigt, welcher Anteil des Körpergewichts Fett und welcher Anteil Muskelmasse ist, sagt er eher etwas über die Form des Körpers aus als über dessen Zusammensetzung.
Das Idealgewicht (Ideal Body Weight, IBW) wird für Männer und Frauen nach unterschiedlichen Gleichungen berechnet, die 1974 erstmals von Ben Devine in einem Fallbericht zur Dosierung von Gentamicin bei einem übergewichtigen Patienten beschrieben wurden (s. Kasten „Körpermaße“). Ein tatsächliches Körpergewicht von 80 bis 124 Prozent des IBW gilt als normal.
Körpermaße
Idealgewicht in kg (IBW, Ideal Body Weight, nach Devine): Männer: IBW = 50 + 0,91 × (L - 152,4); Frauen: IBW = 45,5 + 0,91 × (L - 152,4)
Adjustiertes Idealgewicht in kg (AIBW): AIBW = IBW + 0,4 × (TBW - IBW)
Lean Body Weight in kg (LBW, nach Hume): Männer: LBW = 0,3281 × TBW + 0,33929 × L - 29,5336; Frauen: LBW = 0,29569 × TBW + 0,41813 × L - 43,2933
Körperoberfläche in m2 (KOF, nach DuBois): KOF = TBW0,425 × L0,725 × 0,007184
Körperoberfläche in m2 (KOF, nach Mosteller): KOF = L × TBW ÷ 3600
Weitere Abkürzungen: L = Körperlänge in cm; TBW = Total Body Weight (reales Körpergewicht in kg)
Es gibt etliche Websites zur Berechnung der Körpermaße, z. B.: www.mdcalc.com/bmi-and-body-surface-area-bsa, www.globalrph.com/ibw_calc.htm.
Auf dem IBW basiert das adjustierte Idealgewicht (AIBW). Es trägt der Annahme Rechnung, dass ein Teil der zusätzlichen Körpermasse metabolisch (also auch pharmakokinetisch) aktiv ist.
Das fettfreie Körpergewicht (Lean Body Weight, LBW) ist das geschätzte Gewicht von Knochen, Muskeln, Organen und Haut und wird gelegentlich auch als „Magermasse“ bezeichnet.
Die Körperoberfläche (KOF, engl. Body Surface Area, BSA) wird entweder berechnet nach der Formel von DuBois (1916) oder nach der Formel von Mosteller (1987).
Übergewichtige sind anders als normalgewichtige Patienten
Warum müssen wir uns überhaupt damit beschäftigen, wie die physiologischen Besonderheiten bei Adipositas die Pharmakokinetik beeinflussen? Warum können wir nicht einfach der Fachinformation eine Dosierungsempfehlung für diese Patientengruppe entnehmen?
Ganz einfach: Die Fachinformationen können keine Dosierungsempfehlung geben, weil die klinischen Zulassungs- und auch die großen Nachzulassungsstudien in aller Regel mit normalgewichtigen Patienten stattfinden, um die Variabilität des Kollektivs möglichst gering zu halten und so zu statistisch belastbaren Aussagen für den durchschnittlichen Patienten zu kommen. Wie für andere Patientengruppen (Kinder, Senioren, Schwangere, Multimorbide etc.) gibt es auch für Übergewichtige einen Mangel an klinischen Daten, der uns zwingt, zu überlegen, welche grundsätzlichen Abweichungen es zum Normalpatienten gibt und wie sich diese Abweichungen auf die benötigte Dosis auswirken.
Das bei Adipositas vermehrte Körpergewicht ist größtenteils Fettgewebe und zu geschätzten 20 bis 40 Prozent „fettfreies“ Gewebe. Um das zusätzliche Gewebe zu versorgen, nehmen bei Adipositas das Blutvolumen und das Herzzeitvolumen zu. Besser durchblutet werden dadurch vor allem Niere, Leber und Gastrointestinaltrakt, während das Fettgewebe selbst eher schlecht durchblutet ist.
Hinsichtlich der gastrointestinalen Funktion sind bei Übergewichtigen außerdem eine beschleunigte Magenentleerung und eine erhöhte intestinale Permeabilität beschrieben.
Die Nieren- und Leberfunktion nimmt durch die gesteigerte Durchblutung tendenziell zunächst zu. Machen sich allerdings Folgeschäden der Adipositas wie diabetische oder hypertensive Nephropathie bzw. Steatohepatitis bemerkbar, wird die Zunahme zunächst kompensiert, bevor die Funktion dann immer mehr eingeschränkt wird. Hiervon sind vor allem unverändert renal bzw. hepatisch eliminierte Wirkstoffe mit hoher Extraktionsrate und sogenannter flusslimitierter Kinetik betroffen. Zu erkennen sind diese Wirkstoffe an einem (bei gesunder Leber) hohen First-pass-Effekt. Beispiele sind Propranolol, Metoprolol, Labetalol, Verapamil, Prazosin, Pentoxifyllin, Paclitaxel, Lidocain, Fentanyl, Sufentanil, Morphin oder Glyceroltrinitrat. In der Leber kann zudem die Enzymaktivität infolge des Übergewichts verändert sein. Typisch und deutlich scheinen eine Hemmung von CYP3A4 und eine Aktivierung von CYP2E1 zu sein, ebenso wie eine beschleunigte Glucuronidierung. CYP1A2-, -2C9-, -2C19- und -2D6-Substrate zeigen ebenfalls einen Trend zu beschleunigter Elimination [2].
BMI – von der Abstraktion zur Vorstellung
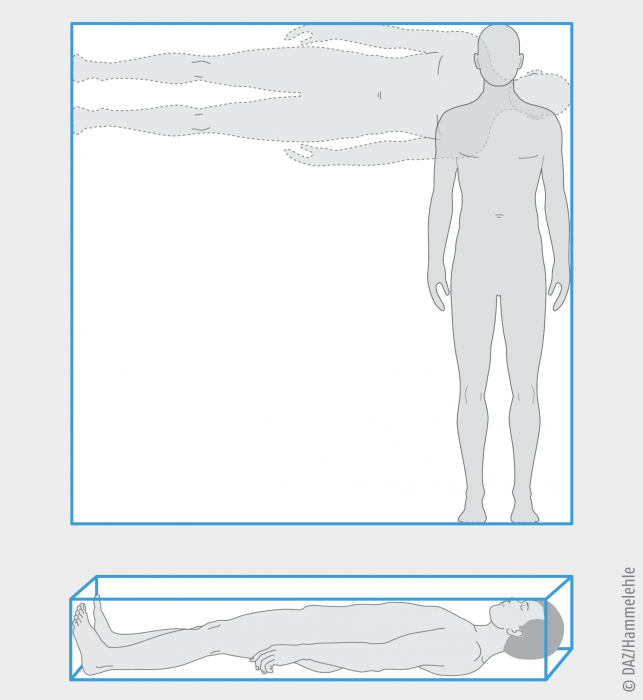
Das Prinzip des BMI: Die Körpermasse wird gleichmäßig auf dem Quadrat der Körpergröße verteilt (oben). Entwurf: cae
Seit der Antike haben sich Künstler immer wieder mit den realen und idealen Proportionen des Menschen befasst. Dabei spielte das Körpergewicht zumindest in der Theorie keine Rolle. Erst der belgische Statistiker Adolphe Quetelet (1796 – 1874) setzte es in eine Beziehung zur Körperlänge, als er im Jahr 1832 den Body Mass Index (BMI) entwickelte. Er atomisierte gleichsam den gesamten Körper und verteilte ihn gleichmäßig auf einer Fläche, die dem Quadrat der Körperlänge entspricht (kg/m2).
Hierzu ein einfaches Beispiel: Eine 2 m große Person wiegt 100 kg. Wird die Körpermasse gleichmäßig auf 4 m2 verteilt, ergeben sich 25 kg/m2; dies ist der BMI.
Wenn man eine Dichte des Körpers von 1 annimmt, beträgt das Volumen 25 L/m2, d. h. die gleichmäßig verteilte Körpermasse ist 25 mm hoch. Tatsächlich beträgt die Dichte des Menschen, der etwa zur Hälfte aus Wasser besteht, knapp 1,05 – mit geringen Schwankungen. Relativ schwer sind die Knochen, Muskeln und das Gehirn, relativ leicht ist das Fettgewebe.
Verteilt man die Körpermasse auf einem Rechteck, das der Körperlänge mal Schulterbreite entspricht, vervierfacht sich die Höhe (im Beispiel auf 10 cm) – und das Verfahren erscheint nicht mehr ganz so abstrakt. Man könnte sich einen Toten in einem Sarg vorstellen. Praktische Volumenmessungen kann jeder an sich selbst anstellen, indem er in die Badewanne steigt. cae
Von der Physiologie zur Pharmakokinetik: die wichtigsten Parameter
Die pharmakokinetischen Parameter, die durch diese physiologischen Veränderungen potenziell beeinflusst werden, sind die Bioverfügbarkeit, die Verteilung und die renale und hepatische Clearance.
Die Bioverfügbarkeit gibt an, wie viel Prozent des Wirkstoffs wie schnell im zentralen Kreislauf ankommen und für die systemische Wirkung zur Verfügung stehen. Von ihr hängen Höhe und Zeitpunkt des Spitzenplasmaspiegels (Cmax, tmax), der Zeitpunkt des Wirkungseintritts und die Wirkungsstärke (berechnet als AUC) ab.
Bei der Verteilung ist zwischen dem realen Verteilungsraum und dem pharmakokinetischen Verteilungsvolumen VD zu unterscheiden. Da im lebenden System gemeinhin nicht nachvollziehbar ist, wohin die applizierten Wirkstoffmoleküle sich in welchen Anteilen verteilen, können wir uns nur mit dem berechneten Verteilungsvolumen behelfen, das sich als Quotient aus der Dosis und der gemessenen Plasmakonzentration des Wirkstoffs ergibt. Je größer VD , desto höher muss eine Initialdosis sein, um eine therapeutische Plasmakonzentration zu erzielen.
Die Eliminationshalbwertszeit ist bei erhöhtem VD verlängert, weil das „Reservoir“, aus dem der Wirkstoff in den zentralen Kreislauf zurückkehren muss, größer wird.
Die Clearance ist die zweite Determinante der Halbwertszeit – für renal eliminierte Wirkstoffe also die Nieren-, für hepatisch eliminierte die Leberfunktion.
Sowohl die Halbwertszeit als auch die Clearance bestimmen (zusammen mit der Bioverfügbarkeit) die Wirkungsstärke (AUC). Je länger die Halbwertszeit, desto länger kann das Dosierungsintervall sein, und desto später wird bei mehrfacher Gabe die Gleichgewichtskonzentration des Wirkstoffs im Blut (steady state) erreicht, die beim therapeutischen Drug Monitoring angestrebt wird. Je größer die Clearance, desto größer ist die benötigte Erhaltungsdosis.
Intuitiv möchte man vermuten, dass bei Adipositas der reale Verteilungsraum und infolgedessen das Verteilungsvolumen vergrößert sind. Ferner sollte bei erhöhter Perfusion des Gastrointestinaltraktes, der Nieren und der Leber die Clearance erhöht sein, sofern noch keine Folgeschäden vorliegen. Leider zeigt uns alle Erfahrung mit Studien zu diesem Thema, dass die Wahrheit weit von diesen theoretischen Überlegungen entfernt sein kann.
Zunächst einmal müssen die pharmakokinetischen Veränderungen durch Adipositas aufgrund der unterschiedlichen physikochemischen Eigenschaften der Wirkstoffe, v. a. Hydrophilie/Lipophilie und Molekülgröße, für jeden Wirkstoff einzeln untersucht werden. Aber selbst wenn sich unterschiedliche Studien auf denselben Wirkstoff beziehen, gibt es widersprüchliche Ergebnisse, die nur den Schluss zulassen, dass die Variabilität innerhalb der Adipösen zu groß ist, als dass die Körpermaße allein eine Aussage über die Besonderheiten der Pharmakokinetik zulassen.
Tatsächliche Auswirkungen von Übergewicht auf die Pharmakokinetik einzelner Arzneistoffe
Bei Adipösen ist die Bioverfügbarkeit für Propranolol vermutlich leicht erhöht, für Midazolam ist sie hingegen nicht verändert. Auch für Trazodon, Ciclosporin und Moxifloxacin scheint Übergewicht keinen Einfluss auf die Bioverfügbarkeit zu haben.
Dass das Verteilungsvolumen nicht per se für lipophile Substanzen vergrößert ist, zeigt das Beispiel von Propofol, auf dessen Verteilungsvolumen Übergewicht keinen Einfluss hat. Je nach Indikation kann der reale Verteilungsraum eine wichtige Rolle spielen: Beispielsweise ist die Gewebekonzentration von Cefazolin bei Adipositas um 30 Prozent reduziert. Da für die Wirkung essenziell ist, wie lange die lokale Konzentration über der minimalen Hemmkonzentration liegt, ist unter Umständen eine höhere Dosis erforderlich, wenn z. B. eine Wundinfektion behandelt werden soll.
Niedermolekulare Heparine (Enoxaparin, Certoparin, Dalteparin, Nadroparin u. a.) sind hydrophile sulfaltierte Glycosaminoglycan-Gemische mit einer Molekularmasse um 5000 Da. Ihr Verteilungsvolumen entspricht in etwa dem Plasmavolumen [3], und Übergewicht hat kaum einen Einfluss darauf [4].
Die Clearance kann bei Übergewichtigen durch einen beschleunigten Metabolismus oder eine erhöhte Eliminationsrate gesteigert sein, was für folgende Wirkstoffe beschrieben wurde: Theophyllin (CYP1A2), Phenytoin und Ibuprofen (CYP2C9), Diazepam (CYP2C19), Nebivolol (CYP2D6), Lorazepam und Oxazepam (UGT) sowie Vancomycin, Enoxaparin, Tinzaparin, Dalteparin (glomeruläre Filtration) und Procainamid, Cisplatin, Topotecan, Ciprofloxacin, Digoxin (teils tubuläre Sekretion) (zitiert in [2]). Jedoch ist das nicht zwingend der Fall, wie die Gegenbeispiele Carbamazepin, Lithium, Remifentanil, Glimepirid, Glipizid und Cefazolin zeigen [5].
Wie erwähnt, ist die CYP3A4-Aktivität bei Übergewichtigen eher reduziert, was sich beispielsweise an einer etwa halbierten Alfentanil-Clearance manifestiert. Dies ist auch von Bedeutung, wenn eine Gewichtsabnahme oder eine chirurgische Maßnahme (z. B. ein Magen-Bypass) erfolgt: Für die CYP3A4-Substrate Ciclosporin, Tacrolimus und Mycophenolat stieg danach die zum Erreichen wirksamer Plasmaspiegel erforderliche Dosis an (zitiert in [2]).
Von den Körpermaßen zur angepassten Dosis
Im folgenden Abschnitt wird berichtet, wie einzelne Körpermaße zur Dosisanpassung bestimmter Arzneistoffe genutzt werden.
Das reale Körpergewicht (TBW). Es wird am häufigsten als Bezugsgröße für die Dosisindividualisierung vorgeschrieben. Setzt man es bei Adipositas konsequent ein, resultieren allerdings sehr hohe Dosierungen: So lautet die Dosierungsvorschrift für Amphotericin B bei Erwachsenen 1 – 3 mg/kg Körpergewicht pro Tag (per Infusion). Für einen „normal schweren“ Patienten von 80 kg ergibt sich daraus eine Tagesdosis von maximal 240 mg, für einen 200 kg schweren Patienten eine Tagesdosis von 600 mg. Falls der Dosisbedarf doch nicht linear mit dem realen Körpergewicht ansteigt, wären Überdosierung und eventuell Toxizität die Folge. Daraus resultiert der „vorsichtigere“ Ansatz, die Dosis nicht anzupassen oder nur anhand des IBW oder LBW anzupassen – mit dem Risiko, dass der Patient unterdosiert wird.
Zytostatika. Für Zytostatika wird meistens die Körperoberfläche als Bezugsgröße herangezogen. Da die KOF auf dem realen Körpergewicht beruht, gilt für sie genauso, dass die Skalierung der Dosis anhand der KOF bei Übergewichtigen möglicherweise eine Überdosierung bedeutet. Darum war es über lange Zeit üblich, die KOF bei 2 m² zu „kappen“, also bei der Dosisberechnung maximal 2 m² anzusetzen, auch wenn die KOF darüberlag. Diese Praxis birgt aber die Gefahr, dass besonders große oder eben auch übergewichtige Menschen unterdosiert werden, sodass sich ihr Tumor weiter ausbreiten kann und/oder das Rezidivrisiko steigt. Dies wurde im Jahr 2012 durch die Leitlinie zur Dosierung der Chemotherapie bei übergewichtigen Krebspatienten der American Society of Clinical Oncology (ASCO) unterstrichen [6]. Sie empfiehlt, klassische zytotoxische Chemotherapeutika (mit Ausnahme von Carboplatin, Bleomycin und Vincristin) auf Basis der mit dem vollen Körpergewicht berechneten Körperoberfläche zu dosieren. Gerade in der Krebstherapie mit Zytostatika sind die Dosierungsgewohnheiten allerdings erstaunlich heterogen, wie jüngst eine Studie zur Dosierung von Busulfan zeigte: Von den befragten Zentren nutzten 29 Prozent das TBW, 18 Prozent das IBW, 29 Prozent das AIBW, fünf Prozent andere Methoden, und 20 Prozent passten die Dosierung dem Körpergewicht nicht an [7].
Antiinfektiva. Für Antiinfektiva hängt es von der Substanzklasse ab, welches Körpermaß am besten geeignet ist: Für Aminoglykoside wurde vorsichtig das LBW oder AIBW, für Vancomycin und Fluconazol das TBW, für Cephalosporine eventuell die KOF, für Flucytosin und Aciclovir das IBW empfohlen. Die Standard-Erwachsenendosis kann für Piperacillin/Sulbactam, Co-trimoxazol und Fludarabin verwendet werden. Für Carbapeneme, Linezolid und Fluorchinolone legen die verfügbaren Daten nahe, dass Übergewichtige höhere Dosierungen benötigen, ein verlässlicher Bezugsparameter wurde allerdings noch nicht gefunden [8 – 10].
Antidiabetika. Bei Übergewichtigen scheint der Dosisbedarf von Antidiabetika erhöht zu sein, aber es ist weder ein geeigneter Gewichtsparameter gefunden noch bekannt, ob es sich hier um einen rein pharmakokinetischen Effekt handelt [11]. Da die Dosiseinstellung anhand des Blutzuckerspiegels erfolgt, ist man glücklicherweise weniger auf pharmakokinetische Überlegungen und Studiendaten angewiesen, sollte aber im Blick behalten, dass sich der Dosisbedarf auch mit dem Gewicht ändern kann.
Sonstige Medikamente. Bei Betablockern sollte die Initialdosis anhand des LBW angepasst werden. Die benötigten Erhaltungsdosen variieren bei den einzelnen Wirkstoffen, da deren Pharmakokinetik in sehr unterschiedlicher Weise durch das Körpergewicht beeinflusst wird.
Hinsichtlich der analgetischen Therapie mit Morphin gibt es Hinweise, dass zur Dosisanpassung bei Übergewichtigen das AIBW geeignet ist [12].
Für niedermolekulare Heparine, z. B. Nadroparin, Enoxaparin, wird zunehmend das LBW als Bezugsgröße empfohlen [4].
Anpassung der Dosis an die Nierenfunktion
Hydrophile, vor allem unverändert renal eliminierte Wirkstoffe werden am besten anhand der Nierenfunktion dosiert. Diese wird in aller Regel aus der Creatinin-Konzentration im Blut, dem Alter, dem Geschlecht, der ethnischen Zugehörigkeit und dem Körpergewicht berechnet. Selbst bei Gleichungen, die die Nierenfunktion standardisiert auf die durchschnittliche KOF von 1,73 m² angeben und daher zunächst ohne die Angabe des realen Körpergewichts auskommen, fließt es letztlich bei der Übertragung auf die tatsächliche KOF des Patienten doch mit ein. Dass das Gewicht zur Berechnung der Nierenfunktion berücksichtigt wird, trägt der Tatsache Rechnung, dass größere Menschen mehr Muskelmasse und daher eine höhere Creatinin-Konzentration haben als kleinere, schmächtige Menschen. Nun produziert aber das Fettgewebe kein Creatinin, weshalb man die Nierenfunktion eines Übergewichtigen überschätzen würde, wenn man das tatsächliche Körpergewicht in die Berechnung einfließen lassen würde. Häufig wird daher das AIBW bei der Abschätzung der glomerulären Filtrationsrate verwendet.
Interessant ist der Vorschlag, bei Verwendung der Cockcroft-Gault-Gleichung einen Bereich für die Creatinin-Clearance zu ermitteln anstelle eines einzelnen Wertes. Die Untergrenze dieses CC-Bereichs ergibt sich aus der Berechnung mit dem IBW, die Obergrenze aus der Berechnung mit dem TBW. Daraus erhält man einen Dosierungsbereich und kann sich dann – je nach Nutzen-Risiko-Verhältnis – für eine Dosis im oberen oder unteren Bereich entscheiden. Dieses Vorgehen trägt auch dem Umstand Rechnung, dass die Schätzgleichungen für die Nierenfunktion insgesamt keine wissenschaftlich exakten, sondern empirisch entstandene und daher unvollkommene Formeln sind [13].
Schlussfolgerung für die Fachinformationen
Die Dosisanpassung für Patienten mit Übergewicht und Adipositas ist noch ein großer weißer Fleck auf der Landkarte der Dosisindividualisierung. Angesichts der zunehmenden Prävalenz dieser Bevölkerungsgruppe wäre es höchst wünschenswert, wenn die Fachinformationen neben den Angaben für Patienten mit Eliminationsstörungen und verschiedener Altersgruppen auch Angaben zur Berücksichtigung von Übergewicht gäben. Dazu braucht es allerdings robuste Studiendaten, die derzeit nur für wenige Wirkstoffe und Wirkstoffklassen vorliegen. Für alle anderen Wirkstoffe gilt, die Parameter gut im Blick zu behalten, die die therapeutischen und unerwünschten Wirkungen anzeigen. |
Literatur
[1] Knibbe CAJ, et al. Drug disposition in obesity: toward evidence-based dosing. Annu Rev Pharmacol Toxicol 2015;55:149
[2] Brill MJ, et al. Impact of obesity on drug metabolism and elimination in adults and children. Clin Pharmacokinet 2012;51(5):277-304
[3] Nadroparin AHFS Monograph, über Drugs.com
[4] Diepstraten J, et al. Population pharmacodynamic model for low molecular weight heparin nadroparin in morbidly obese and non-obese patients using anti-Xa levels as endpoint. Eur J Clin Pharmacol 2015;71(1):25-34
[5] Mahmood I. Prediction of clearance and volume of distribution in the obese from normal weight subjects: an allometric approach. Clin Pharmacokinet 2012;51(8):527-42
[6] Griggs JJ, et al. Appropriate chemotherapy dosing for obese adult patients with cancer: American Society of Clinical Oncology clinical practice guideline. Clin Oncol 2012;30:1553-1561
[7] Shem-Tov N, et al. Chemotherapy dose adjustment for obese patients undergoing hematopoietic stem cell transplantation: a survey on behalf of the acute leukemia working party of the European society for blood and marrow transplantation. Oncologist 2015;20(1):50-55
[8] Pai MP, et al. Antimicrobial dosing considerations in obese adult patients. Pharmacotherapy 2007;27(8):1081-91
[9] Langebrake C, et al. Drug dosing and monitoring in obese patients undergoing allogenic stem cell transplantation. Int J Clin Pharm 2011;33(6):918-24
[10] Payne KD, et al. Dosing of antibacterial agents in obese adults: does one size fit all? Expert Rev Anti Infect Ther 2014;12(7):829-54
[11] Sankaralingam S. The impact of obesity on the pharmacology of medications used for cardiovascular risk factor control. Can J Cardiol 2015;31(2):167-176
[12] Grodofsky SR, et al. The association of gender and body mass index with postoperative pain scores when undergoing ankle fracture surgery. J Anaesthesiol Clin Pharmacol 2014;30(2):248-52
[13] Brown DL, et al. Functional range of creatinine clearance for renal drug dosing: a practical solution to the controversy of which weight to use in the Cockcroft-Gault equation. Ann Pharmacother 2013;47(7-8):1039-44
Autorin
Dr. Dorothee Dartsch studierte Pharmazie in Hamburg und wurde dort im Fach Pharmakologie und Toxikologie promoviert. Von 2002 bis 2012 war sie Hochschullehrerin für Klinische Pharmazie an der Universität Hamburg. In dieser Zeit leitete sie auch den klinisch-pharmazeutischen Teil eines EU-Projekts zur Entwicklung postgradualer berufsbegleitender Online-Kurse für Apotheker. Seit 2012 leitet sie die Fortbildungsinstitution Campus Pharmazie GmbH.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.