
- DAZ.online
- DAZ / AZ
- DAZ 39/2014
- Gefährliche Deos
Toxikologie
Gefährliche Deos?
Zum Risikopotenzial von Aluminium in Kosmetika und Impfstoffen
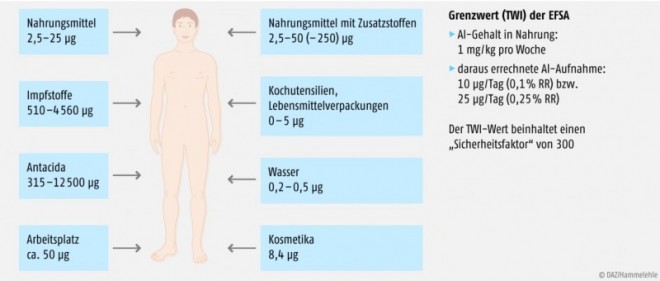
Aluminium in der Nahrung
Aluminium ist ubiquitär verbreitet und in unserer Nahrung nachweisbar. Die meisten unverarbeiteten Lebensmittel enthalten weniger als 5 mg Aluminium/kg. Höhere Konzentrationen (durchschnittlich 5 bis 10 mg/kg) sind oft in Brot, Kuchen, Keksen und anderen Backwaren, einigen Gemüsearten – mit den höchsten Konzentrationen bei Pilzen, Spinat und Kopfsalat – sowie in Milchprodukten und Meeresfrüchten enthalten. Sehr hohe Durchschnittskonzentrationen finden sich u.a. in Teeblättern, Kräutern, Kakao und Kakaoprodukten sowie Gewürzen [4].
Neben dem natürlich vorkommenden Aluminium können aluminiumhaltige Lebensmittelzusatzstoffe den Aluminiumgehalt der Nahrung erhöhen. Aluminium oder Aluminiumverbindungen werden z.B. als Farbstoffe bei Überzügen von Zuckerwaren oder als Backtreibmittel eingesetzt, aber auch um ein Verkleben von Käsescheiben zu vermeiden oder als Festigungsmittel bei kandierten Früchten und anderen Obstprodukten. Aluminiumsulfat wird in der Trinkwasseraufbereitung als Antiflockungsmittel eingesetzt. Der Grenzwert in der Trinkwasserverordnung beträgt 0,2 mg/l (Abb. 1).
Grenzwert: Der von der EFSA berechnete TWI (tolerable weekly intake) von 1 mg Aluminium/kg Lebensmittel pro Woche bedeutet für einen Erwachsenen mit durchschnittlichem Körpergewicht (70 kg) eine Resorption von nur 10 µg (EFSA [4]) bzw. 25 µg täglich [15], je nach der zugrunde gelegten Resorptionsrate (RR). Der Wert steigt bei zusätzlicher Aufnahme von Aluminium am Arbeitsplatz sowie insbesondere bei der Anwendung von aluminiumhaltigen Antacida oder Impfstoffen.
Resorption, Verteilung und Elimination
Unser Organismus nimmt kaum Aluminium aus der Nahrung auf: Mehr als 99 Prozent werden direkt mit dem Stuhl wieder ausgeschieden. Die geringen Mengen, etwa 0,1 bis 0,3 Prozent, die aus der Nahrung ins Blut gelangen, werden rasch über die Niere wieder eliminiert. Die Resorption kann erhöht sein bei Anwesenheit von Citrat oder Ascorbat. Bei hohen aufgenommenen Mengen ist mit einer Abnahme der Bioverfügbarkeit zu rechen (ca. 0,01%). Konzentrationen im Blutplasma, die bei durchschnittlicher Ernährung gemessen werden, liegen bei 1 bis 3 µg Aluminium/l. In den 1960er Jahren wurden sehr viel höhere Werte publiziert, die vermutlich auf fehlerhafte Probennahmen und Verunreinigungen während der Analytik zurückzuführen sind.
Im Blutplasma wird Aluminium an Transferrin gebunden. Es verteilt sich im Organismus und wird im Skelettsystem gespeichert. Neben den Knochen finden sich auch relativ hohe Aluminiumkonzentrationen in der Lunge, wahrscheinlich aufgrund zusätzlicher inhalativer Exposition mit Stäuben. Von der gesamten Menge des Aluminiums im Organismus befindet sich etwa die Hälfte in den Knochen und ein Viertel in der Lunge.
Die Elimination aus den meisten Geweben erfolgt rasch, mit einer Halbwertszeit von weniger als zwei Tagen. Das Hauptausscheidungsorgan ist die Niere, mehr als 95 Prozent werden renal eliminiert. Nur die Abgabe aus dem Knochengewebe erfolgt langsam über einen Zeitraum von einigen Jahren. Damit zeigt Aluminium ein ähnliches kinetisches Verhalten wie andere polyvalente Metalle. Wegen des neurotoxischen Potenzials sind die Konzentrationen im Hirngewebe von besonderem Interesse. Hier werden niedrigere Konzentrationen als in vielen anderen Organen gemessen, was durch die Schutzfunktion der Blut-Hirn-Schranke erklärt werden kann.
Normale und toxische Konzentrationen
Der menschliche Organismus benötigt zahlreiche Metalle in geringen Konzentrationen als sogenannte Spurenelemente, etwa Zink, Kupfer und Cobalt. Aluminium gehört nicht dazu. Toxische Wirkungen des Aluminiums in höheren Konzentrationen und längerer Einwirkung betreffen hauptsächlich das Nervensystem. Werte von Aluminium im Serum bis zu 10 µg/l gelten als normal, Werte über 60 µg/l werden als deutlicher Hinweis auf eine Aluminiumexposition betrachtet. Im Bereich von 100 µg/l ist eine ärztliche Überwachung angezeigt, bei Konzentrationen oberhalb von 180 µg/l sind klinische Symptome zu befürchten. Im Urin werden Normalwerte zwischen 0,6 und 8 µg/l gemessen, entsprechend einer Ausscheidung von etwa 2 bis 12 µg/Tag. Unter Expositionsbedingungen am Arbeitsplatz (MAK-Wert: 1,5 mg/m3 Luft, alveolengängige Fraktion) ist eine renale Ausscheidung von bis zu 60 µg Aluminium pro Gramm Kreatinin akzeptabel.
Wie einige Kasuistiken zeigen, können hohe Belastungen mit aluminiumhaltigen Stäuben zur Lungenfibrose führen. In den USA wurde vor einigen Monaten der Fall eines Heimwerkers publiziert, der etwa 16 Jahre lang einen aluminiumhaltigen Acrylkunststoff verarbeitet hatte. Als Ursache seiner schweren Lungenerkrankung wurde das langfristige Einatmen der Stäube angesehen [12].
Intoxikationen bei Dialysepatienten
Bei Personen mit normaler Nierenfunktion sind Aluminiumintoxikationen extrem ungewöhnlich. Informationen über das klinische Bild einer Vergiftung mit dem Metall kommen hauptsächlich aus den Erfahrungen mit Dialysepatienten. In den 1970er Jahren wurde in England und den USA eine zunehmende Demenz bei Dialysepatienten beobachtet, die mit den Aluminiumgehalten des Wassers in Verbindung gebracht wurde. Dabei ist zu bedenken, dass das Blut von Dialysepatienten jährlich mit etwa 18.000 bis 36.000 Litern Dialyseflüssigkeit ausgetauscht wird. Geringe Konzentrationen können daher schon zu problematisch hohen Expositionen führen. Heute darf der Aluminiumgehalt in Dialyseflüssigkeiten einen Grenzwert von 10 µg/l nicht überschreiten.
Zu den häufigsten Symptomen der Dialyse-verursachten Enzephalopathie zählen neben Demenz und Sprachstörungen auch Krampfanfälle und psychotische Symptome [14].
Besitzt Aluminium ein kanzerogenes Potenzial?
In der Öffentlichkeit heftig diskutiert werden die Spekulationen, dass aluminiumhaltige Deodorants Brustkrebs verursachen könnten, obwohl weder tierexperimentelle Untersuchungen noch epidemiologische Daten auf einen Zusammenhang hinweisen [10]. Als Indiz wird genannt, dass bei Brustkrebspatientinnen die Aluminiumgehalte in der befallenen äußeren Region (axillärer Quadrant) höher sind als im inneren Bereich [3]. Allerdings könnten die höheren Konzentrationen auch durch eine Anreicherung im erkrankten Gewebe erklärt werden, ohne dass Aluminium der Auslöser der Erkrankung ist. Mit einem polyzyklischen aromatischen Kohlenwasserstoff (2,7-Dimethylbenz[a]anthracen) lassen sich tierexperimentell Mammatumoren erzeugen, in denen ein erhöhter Aluminiumgehalt nachgewiesen wurde. In pathologisch verändertem Gewebe kann sich also das Metall anreichern [8].
In mehreren älteren Arbeiten aus den 1970er Jahren ist die mögliche, direkte kanzerogene Wirkung von Aluminium bereits untersucht worden. Vom Design und den untersuchten Endpunkten her sind diese Arbeiten aus heutiger Sicht nicht adäquat. Am ehesten entspricht eine Studie mit Mäusen aus dem Jahr 1994 den heutigen Richtlinien. Das Futter dieser Tiere enthielt bis zu zehn Prozent Aluminiumkaliumsulfat (Alaun). Die Mäuse nahmen so für 20 Monate, also praktisch lebenslang, täglich bis zu 853 mg Aluminium/kg Körpergewicht zu sich. Die Ergebnisse dieser Studie sind bemerkenswert:
- Es wurden keine Symptome beobachtet, die als Hinweise auf eine Aluminiumintoxikation angesehen werden könnten, und
- diese Tiere hatten weniger Tumoren als die Kontrollen. Vor allem hepatozelluläre Karzinome und Adenokarzinome der Lunge traten seltener auf.
Dieser positive Befund wurde durch ein geringeres Körpergewicht der hochexponierten Tiere erklärt [9]. Auch nach Sichtung aller verfügbaren Publikationen kam die International Agency for Research on Cancer (IARC) zu dem Ergebnis, dass Aluminium bei üblicher Exposition über die Nahrung nicht kanzerogen wirkt. Eine mögliche Ausnahme wurde in der Exposition am Arbeitsplatz gesehen. Allerdings ist die Exposition mit aluminiumhaltigen Stäuben dort auch mit der gleichzeitigen Exposition gegen bekannte Kanzerogene, wie polyzyklische aromatische Kohlenwasserstoffe und Asbest, verbunden.
Medizinische Verwendung von Aluminium
Impfstoffe
Durch das Standardimpfprogramm sind Säuglinge hohen Aluminiumdosen ausgesetzt, denn Aluminiumhydroxid und Aluminiumphosphat werden in vielen Impfstoffen als Adjuvanzien zur Verstärkung der Immunantwort eingesetzt. Da weder die Nierenfunktion noch die Blut-Hirn-Schranke bei Säuglingen voll ausgereift ist und das Aluminium durch die Injektion direkt in den Organismus gelangt, stellen Säuglinge eine Risikogruppe für mögliche toxische Aluminiumwirkungen dar. Doch Berechnungen der Kinetik und Organkonzentrationen mit speziellen Computerprogrammen haben gezeigt, dass die Exposition nicht akut besorgniserregend ist [6]. Nur bei Säuglingen mit eingeschränkter Nierenfunktion sollten alternative Impfschemata oder spezielle Impfstoffe mit niedrigen Aluminiumgehalten in Betracht gezogen werden, um alle Risiken auszuschließen. Als Grenzwert wurde in dieser Publikation ein von der Agency for Toxic Substances and Disease Registry (ATSDR) festgelegter minimal risk level (MRL) von 1 mg Al/kg KG/Tag verwendet. Legt man allerdings den von der EFSA festgesetzten, siebenmal niedrigeren TWI (tolerable weekly intake) von 1 mg Al/kg KG/Woche zugrunde, wird der Grenzwert im Alter bis sechs Monaten schon alleine durch die Standardimpfungen erreicht und kann bei einem drei Monate alten Kind sogar um 30 Prozent überschritten werden.
Angesichts des neurotoxischen Potenzials des Aluminiums sind die Konzentrationen im Gehirn von besonderem Interesse. Auch bei einem „worst case“ liegen diese noch deutlich unterhalb kritischer Werte. Normale Aluminiumgehalte im Gehirn liegen bei etwa 2 mg/kg, Enzephalopathien werden ab etwa 9 mg/kg beobachtet. Eine Impfung erhöht die Konzentration aber nur um maximal 0,026 mg/kg und dürfte daher toxikologisch nicht relevant sein [7].
Antacida und andere Arzneimittel
Aluminiumhydroxid und andere Aluminiumverbindungen wie Hydrotalcit (Mg6Al2[(OH)16CO3]·4H2O) werden seit Jahrzehnten als Antacida angewandt; dennoch gibt es bis heute bei Einhaltung gewisser Kontraindikationen – z.B. Niereninsuffizienz – und bei gelegentlichem Gebrauch der Präparate keine Hinweise auf gesundheitliche Risiken. Das Ausmaß der Resorption aus dem Magen-Darm-Trakt wird in den Fachinformationen von Talcid® (Wirkstoff: Hydrotalcit) mit 1 Prozent angegeben – ein Wert, der recht hoch angesetzt ist angesichts einiger Publikationen, die eine deutlich niedrigere Resorptionsrate ermittelt haben. Allerdings kann die Resorptionsrate erheblich schwanken. So wurde bei gleichzeitiger Gabe des Antacidums Aludrox® (Wirkstoff: kolloidales Aluminiumhydroxid) mit Orangensaft eine Erhöhung der Aluminiumresorption und -elimination (Urin) ermittelt. Es ist aber eher unwahrscheinlich, dass ein Patient das Antacidum mit Orangensaft einnimmt.
Laut Fachinformation von Talcid® soll eine Tageshöchstdosis von zwölf Kautabletten nicht überschritten werden, das entspricht 6,0 g Hydrotalcit. Bei Patienten mit eingeschränkter Nierenfunktion kann eine Intoxikation mit Osteomalazie und Enzephalopathie resultieren. Daher sollten diese Patienten das Präparat nur bei Kontrolle der Serumspiegel von Magnesium und Aluminium einnehmen. Ein Aluminiumspiegel von 40 µg/l soll dabei nicht überschritten werden.
Neben Impfstoffen und Antacida sind Aluminiumverbindungen in weiteren Arzneimitteln enthalten. Sie werden u.a. als Lösung zum Gurgeln bei leichten Entzündungen des Zahnfleisches oder der Mundschleimhaut oder als „Halstabletten“ angeboten. Dabei wird die leicht adstringierende Wirkung der Aluminiumverbindungen genutzt.
Dermale Resorption aus Kosmetikzubereitungen
Angesichts der extrem hohen Dosen von Aluminium, die bei der Anwendung von aluminiumhaltigen Antacida oral zugeführt werden, sind die Diskussionen über mögliche gesundheitliche Risiken durch Anwendung aluminiumhaltiger Kosmetika nicht nachvollziehbar.Neben den Deodorants, die einer mikrobiellen Zersetzung des Schweißes auf der Haut entgegenwirken und so eine Geruchsentwicklung verhindern, kommen auch Antitranspiranzien zum Einsatz. In diesen Zubereitungen werden Aluminiumsalze (meistens Aluminiumchlorhydrate) wegen ihrer nachgewiesenen und seit Jahrhunderten bekannten schweißhemmenden Wirkung eingesetzt, die durch einen Verschluss der Ausführungsgänge der Schweißdrüsen zustande kommt. Da die Aluminiumverbindungen auf den Produkten deklariert werden, kann ein Verbraucher aluminiumfreie Kosmetika verwenden, wenn keine Hyperhidrose vorliegt, sondern lediglich der Geruchsbildung entgegengewirkt werden soll.
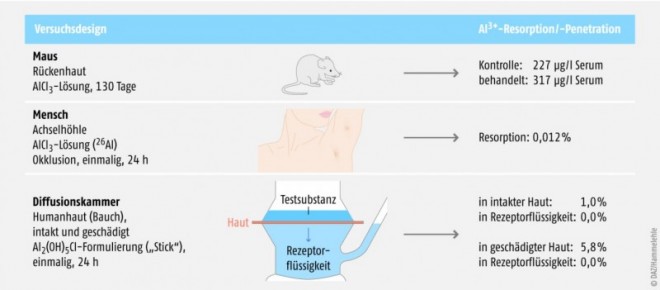
Oben: Über mehrere Monate wurde Mäusen eine Aluminiumchlorid-Lösung auf die Haut gegeben. Die Al3+-Konzentrationen im Blut waren höher als bei den Kontrolltieren.
Mitte: Nach Auftragung einer radioaktiv markierten Aluminiumchlorid-Lösung auf die Achseln und anschließender 24-stündiger Okklusion lag die Resorption bei 0,012 Prozent.
Unten: Eine aluminiumhaltige Kosmetikzubereitung wurde in einer Diffusionskammer auf intakte oder geschädigte menschliche Haut aufgetragen (vgl. Abb. 3). Innerhalb von 24 Stunden konnte kein Durchtritt von Al3+ durch die Hautproben nachgewiesen werden (Konzentration in der Rezeptorflüssigkeit 0,0%).
Die entscheidende Frage bei einer Risikobewertung aluminiumhaltiger Antitranspiranzien lautet: Wie viel Aluminium wird über die Haut aufgenommen? Zunächst muss festgehalten werden, dass die in Antitranspiranzien verwendeten Aluminiumverbindungen bei sehr niedrigen pH-Werten in den Formulierungen löslich sind. Auf der Haut entstehen daraus jedoch mit Proteinen und anderen Bestandteilen von Haut und Schweiß chemisch inerte Komplexe, die von der gesunden Haut praktisch nicht aufgenommen werden. Darüber hinaus limitiert die positive Ladung die Fähigkeit zur Hautpenetration [2, 13].
Die Kenntnisse zum Ausmaß einer möglichen, geringen Hautpenetration sind rudimentär. Es gibt tierexperimentelle Studien zu dieser Frage, eine Studie unter Einsatz des Isotops 26Al bei zwei Probanden und eine In-vitro-Studie unter Verwendung menschlicher Haut (Abb. 2). Alle drei Ansätze weisen erhebliche Nachteile auf. Die behaarte Haut von Nagetieren lässt sich kaum mit menschlicher Haut vergleichen, die Isotop-Untersuchung entsprach nicht den realen Bedingungen einer kosmetischen Verwendung, und In-vitro-Ansätze können grundsätzlich nicht die In-vivo-Situation exakt imitieren. Im Folgenden sollen die methodischen Probleme etwas genauer beschrieben werden.
Tierexperimentelle Studie
Über einen Zeitraum von 130 Tagen wurde Mäusen 0,1 µg Aluminiumchlorid-Lösung täglich auf eine rasierte Stelle am Rücken aufgetragen [1]. Am Ende des Versuchs wurden Konzentrationen von 317 µg/l Aluminium im Serum gemessen. Bei gleichaltrigen Kontrolltieren (186 Tage) lag die mittlere Konzentration bei 227 µg/l, jüngere unbehandelte Mäuse (56 Tage) hatten Konzentrationen von 125 µg/l Serum.
Die Auftragung von wässrigen Lösungen auf die rasierte Haut von Mäusen ist problematisch, weil die Lösung nicht haftet. Darüber hinaus muss angenommen werden, dass die Tiere ihr Fell gegenseitig ablecken. Außerdem fällt auf, dass die angegebenen Konzentrationen auch bei den Kontrollen sehr viel höher sind, als beim Menschen bei üblicher Exposition messbar ist (ca. 1 bis 3 µg/l Serum). Insgesamt sind daher solche Daten völlig ungeeignet, Rückschlüsse auf die Exposition des Menschen nach dermaler Anwendung von aluminiumhaltigen Kosmetika zu ziehen (Abb. 2).
Studie mit Probanden
Bereits im Jahr 2001 veröffentlichten US-amerikanische Wissenschaftler ihre Daten zu einem Resorptionsversuch unter Verwendung des radioaktiven Isotops 26Al als Marker. Die Ergebnisse wurden von den Autoren selbst als „vorläufig“ bezeichnet, fundiertere Studien dieser Art wurden aber bis heute nicht durchgeführt. Die Untersucher verabreichten zwei Versuchspersonen eine mit dem Isotop markierte Lösung von Aluminiumchlorhydrat. Eine definierte Menge der Lösung wurde jeweils einem Mann und einer Frau einmalig auf die Haut der linken Achselhöhle appliziert, die zwei Tage zuvor elektrisch rasiert worden war. Nach dem Trocknen wurde ein Okklusivverband aufgebracht, der eine Woche lang täglich erneuert wurde. Die Achselhaut wurde täglich mit Feuchttüchern gewaschen und mit einem Klebestreifen abgezogen (skin stripping), um oberflächliche Schichten der Achselhaut zu entfernen. Unter diesen Bedingungen wurden 0,012 Prozent des applizierten Aluminiums durch die Haut aufgenommen. Bei Verdoppelung der gemessenen Werte, wodurch eine beidseitige Auftragung berücksichtigt wird, entspricht die resorbierte Menge nach Abschätzung der Autoren etwa 2,5 Prozent des Aluminiums, das täglich über den Magen-Darm-Trakt aus der Nahrung aufgenommen wird. Das Aluminiumisotop war im Blut beider Personen nachweisbar, die Konzentrationen waren jedoch zu gering für eine valide Quantifizierung [5].
In-vitro-Studie
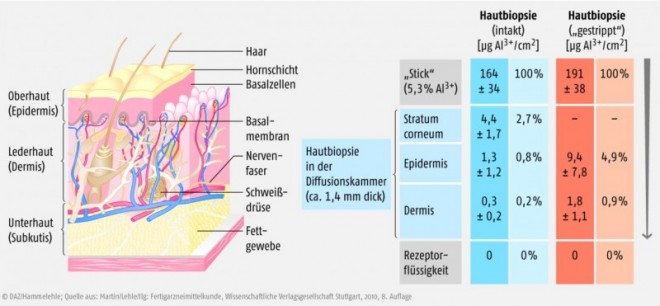
In Frankreich wählte man einen anderen experimentellen Ansatz. Drei aluminiumhaltige Kosmetika wurden in einer Franz-Diffusionskammer mit menschlicher Bauchhaut untersucht: ein Aerosol, eine Emulsion, die mit einem Rollstift aufgetragen wird, und eine Stick-Zubereitung [11]. Dabei wurden von den aus der Stick-Zubereitung aufgetragenen 164 µg/cm2 Al3+ nur etwa 1,6 µg/cm2 (1%) in die lebende Haut (Epidermis und Dermis) aufgenommen. Ein höherer Anteil von etwa 4,4 µg/cm2 (2,7%) fand sich in der Hornschicht (Stratum corneum). In der Rezeptorflüssigkeit der Diffusionskammer waren die Aluminiumgehalte nicht höher als in der Kontrolle (Blindwert), d.h. trotz 24-stündigem Kontakt war kein Aluminium durch die Haut durchgetreten (Abb. 3).
In Hautproben, deren Hornschicht zuvor mit einem Klebestreifen entfernt worden war (stripped skin) und die anschließend unter Parafilm-Okklusion gehalten wurden, waren die aufgenommenen Mengen deutlich größer (11,2 µg/cm2). Dieser experimentelle Ansatz soll die Schädigung der Haut durch eine Rasur imitieren, denn bei einer Rasur wird die Hornschicht zumindest teilweise entfernt. Auch unter diesen Bedingungen war jedoch kein Durchtritt von Aluminium durch die Haut in die Rezeptorflüssigkeit feststellbar. Auffällig ist die hohe Variabilität der Werte (Abb. 3).Es stellt sich die Frage, wie aussagekräftig diese Experimente sind, da die ca. 1,4 mm dünnen Hautproben für 24 Stunden konstant mit den Zubereitungen in Kontakt waren und die Haut nicht durchblutet war. Solche In-vitro-Ansätze mögen zwar geeignet sein, um Unterschiede zwischen verschiedenen Zubereitungen zu untersuchen, aber die Situation am lebenden Organismus können sie nicht exakt imitieren. Offenbar gab es zu diesen Versuchen auch unter den Wissenschaftlern unterschiedliche Ansichten. Wenige Monate nach der Veröffentlichung wurde ein Erratum publiziert, in dem vier der ursprünglich neun Autoren ihre Autorenschaft zurückzogen.
Zusammenfassung
Aluminium ist ubiquitär verbreitet und gelangt vor allem über die Nahrung in den menschlichen Körper. Der geringe resorbierte Anteil von ca. 0,1 bis 0,3 Prozent wird rasch über die Niere eliminiert. Die europäische Behörde EFSA hat für eine Nahrungsmittelexposition 1 mg Aluminium pro kg Körpergewicht pro Woche als unproblematischen Grenzwert abgeleitet (TWI, tolerable weekly intake). Daraus errechnet sich unter Berücksichtigung der Resorptionsquote von 0,1 Prozent eine Menge von etwa 10 µg als akzeptable Menge pro Tag für einen Erwachsenen mit durchschnittlichem Körpergewicht.
Ob und wie viel Aluminium aus Kosmetika aufgenommen wird, ist unklar. Unter Annahme einer Penetrationsrate von 0,014 Prozent, die aus einem Probandenversuch übernommen wurde, kann berechnet werden, dass etwa 12 µg Aluminium pro Tag über diesen Weg aufgenommen werden und der TWI-Wert damit überschritten ist. Selbst diese Exposition erscheint irrelevant im Vergleich zu aluminiumhaltigen Antacida oder Impfstoffen. Allerdings werden Arzneimittel in der Regel nur gelegentlich angewandt, während bei der Risikoabschätzung von Kosmetika eine langfristige Anwendung berücksichtigt werden muss. Trotzdem gibt es aus epidemiologischen Studien keinen fundierten Hinweis, dass eine Aluminiumexposition durch Kosmetika zu neurologischen Erkrankungen oder Krebs führen könnte. In langfristigen Fütterungsstudien reduzierte Aluminium bei Mäusen sogar die Häufigkeit einiger Krebsarten.
Fazit
Neben der Aufnahme über die Nahrung findet eine Aluminiumexposition des Menschen über andere Wege statt. Dazu tragen auch Antitranspiranzien und andere Kosmetika bei. Da bei Nahrungsmitteln und Kosmetika sehr strenge Grenzwerte gesetzt werden, resultiert rasch eine Überschreitung der behördlich festgesetzten maximal tolerierbaren Mengen. Vor dem Hintergrund der Expositionen über aluminiumhaltige Impfstoffe und Arzneimittel, z.B. Antacida, sind die aus Kosmetika aufgenommenen Mengen jedoch verschwindend gering.
Weder Tierexperimente noch epidemiologische Daten geben eindeutige Hinweise auf ein kanzerogenes Potenzial von Aluminium. Auch ein Zusammenhang mit der Entstehung eines Morbus Alzheimer ist seit Jahrzehnten in der Diskussion, aber bisher nicht wissenschaftlich belegt.
Unstrittig besteht ein gesundheitliches Risiko durch Aluminium bei Vorliegen einer Niereninsuffizienz. Nierenkranke Patienten müssen vor erhöhten Aluminiumexpositionen geschützt werden.
Grundsätzlich muss bei allen Überlegungen bedacht werden, dass alle Berechnungen auf Daten beruhen, die mit fragwürdigen Methoden generiert wurden. Genauere Kenntnisse über die Hautpenetration und vor allem über den Abrieb nach Auftragung der Zubereitungen würden eine bessere Risikoabschätzung erlauben. Bis zum Vorliegen von Untersuchungen, in denen aluminiumhaltige Antitranspiranzien unter Alltagsbedingungen nach mehrmaliger Auftragung und ohne Okklusion (!) untersucht wurden, bleibt die Warnung vor aluminiumhaltigen Antitranspiranzien ein Hinweis im Sinne des vorbeugenden Verbraucherschutzes und nicht eine Warnung vor konkreten Gefahren.
Literatur
[1] Anane R, et al. Bioaccumulation of water soluble aluminium chloride in the hippocampus after transdermal uptake in mice. Arch Toxicol 1995;69:568-571
[2] Bundesinstitut für Risikobewertung (BfR). Aluminiumhaltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. Stellungnahme 007/2014 vom 26. Februar 2014; www.bfr.bund.de
[3] Darbre PD, Mannello F, Exley C. Aluminium and breast cancer: Sources of exposure, tissue measurements and mechanisms of toxicological actions on breast biology. J Inorg Biochem 2013;128:257-261
[4] EFSA (European Food Safety Authority). Safety of aluminium from dietary intake. Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials (AFC). Efsa J 2008;754:1-34
[5] Flarend R, et al. A preliminary study of the dermal absorption of aluminium from antiperspirants using aluminium-26. Food Chem Toxicol 2001;39:163-168
[6] Mitkus RJ, et al. Updated aluminum pharmacokinetics following infant exposures through diet and vaccination. Vaccine 2011;29:9538-9543
[7] Nördershäuser, D. Risikobewertung von Aluminium-Adjuvantien in Impfstoffen mit Hilfe eines physiologisch basierten pharmakokinetischen Modell-Ansatzes. Masterarbeit zum Abschluss des Studiums der Toxikologie an der Charité – Universitätsmedizin Berlin, 2012
[8] Ogoshi K, et al. Accumulation of aluminum in cancers of the liver, stomach, duodenum and mammary glands of rats. J Trace Elem Electrolytes Health Dis 1994;8:27-31
[9] Oneda S, et al. Chronic toxicity and tumorigenicity study of aluminum potassium sulfate in B6C3F1 mice. In Vivo 1994;8:271-278
[10] Pineau A, et al. If exposure to aluminium in antiperspirants presents health risks, its content should be reduced. J Trace Elem Med Biol 2014;28:147-150
[11] Pineau A, et al. In vitro study of percutaneous absorption of aluminum from antiperspirants through human skin in the Franz™ diffusion cell. J Inorg Biochem 2012;110:21-26
[12] Raghu G, et al. Pulmonary fibrosis associated with aluminum trihydrate (Corian) dust. N Engl J Med 2014;370:2154-2156
[13] Scientific Committee on Consumer Safety. Opinion on the safety of aluminium in cosmetic products. 27.03.2014; http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_153.pdf
[14] Schäfer SG, Elsenhans B, Schümann K. Aluminium. In: Marquardt H, Schäfer SG, Barth H (Hrsg). Toxikologie, 3. Aufl. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2013, S. 793–796
[15] Shaw CA, Tomljenovic L. Aluminum in the central nervous system (CNS): toxicity in humans and animals, vaccine adjuvants, and autoimmunity. Immunol Res 2013;56:304-16
Autor
Prof. Dr. Ralf Stahlmann
Leiter des Masterstudiengangs Toxikologie
Institut für Klinische Pharmakologie und Toxikologie,
Charité – Universitätsmedizin Berlin
Luisenstr. 7, 10117 Berlin
E-Mail: ralf.stahlmann@charite.de





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.