
- DAZ.online
- DAZ / AZ
- DAZ 37/2014
- Kinderkrankheit mit ...
Thema Varizellen
Kinderkrankheit mit Folgen
Eine Impfung kann die Gürtelrose verhindern
Pathogenese der VZV-Infektion
Varizellen sind eine typische Kinderkrankheit, die in Deutschland vor Einführung der allgemeinen Varizellenimpfung im Jahre 2004 bei über 90% der Kinder während der ersten zehn Lebensjahre auftrat. Durch die Impfung gingen von 2005 bis 2012 die Infektionsraten um ca. 85% zurück [1].
Während der Varizellenerkrankung repliziert sich das VZV in der Haut, aber auch in viszeralen Organen. Als ausgesprochen neurotropes Virus gelangt das VZV entlang der Nervenbahnen oder auf hämatogenem Wege in die Neuronen der hinteren Wurzeln der Spinal- und Hirnnervenganglien [2]. In den Nervenzellen verbleibt es meistens in einem latenten Zustand, in dem zwar die virale DNA, aber nicht das Virus selbst nachweisbar ist. Über die Bedeutung der Expression einzelner Gene in den befallenen Neuronen besteht noch Unklarheit.
Das latente VZV kann wieder aktiv werden und sich replizieren. Dabei greift die Infektion auf benachbarte Neuronen im Ganglion über, und es kommt zu einer Entzündungsreaktion mit Zerstörung von Neuronen. Die neu gebildeten Viren gelangen über sensorische Nerven in die Haut und lösen dort das typische Zosterexanthem aus, das von radikulären, oft sehr ausgeprägten Schmerzen begleitet ist. Durch einen retrograden Transport können die Viren von den Ganglien der Hirnnerven ins ZNS und ins Auge gelangen und dort Entzündungen verursachen [3].
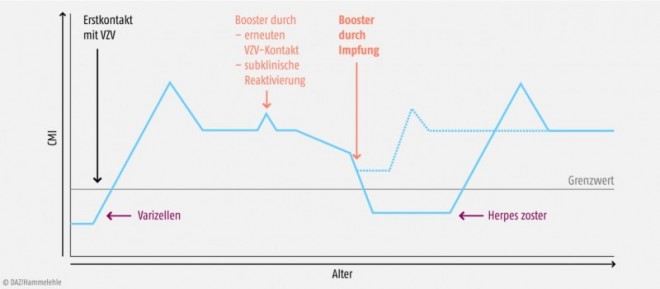
Die molekularen Mechanismen, die der Etablierung der Latenz nach der Primärinfektion und der Virus-Reaktivierung zugrunde liegen, sind noch weitgehend unbekannt. Sicher ist, dass die T-Zell-vermittelte Immunität (CMI), die während der Varizellenerkrankung erworben wird, eine entscheidende Rolle bei der Aufrechterhaltung der Latenz spielt [4, 5, 6, 7]. Im Laufe des Lebens kommt es durch erneuten Kontakt mit dem VZV oder durch wiederholte subklinische endogene Reaktivierungen zu einer Boosterung dieser Abwehrreaktionen, sodass der Schutz aufrechterhalten werden kann (Abb. 1).
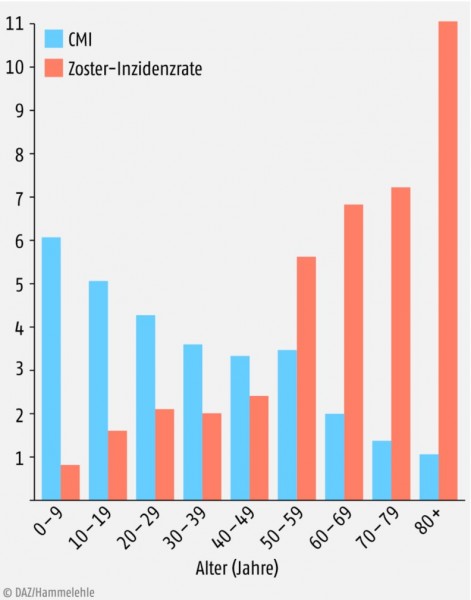
Immunsuppressive Therapien und die im Alterungsprozess nachlassende Funktionsfähigkeit des Immunsystems (Immunoseneszenz) begünstigen die Reaktivierung des VZV. Das erklärt, warum das Zosterrisiko mit zunehmendem Lebensalter ansteigt (Abb. 2) und bei immunsupprimierten Patienten besonders hoch ist.
Blau: VZV-spezifische CMI (Stimulationsindex) in den einzelnen Altersgruppen (nach [5]).
Orange: Zoster-Inzidenzraten (Fälle pro 1000 Personen pro Jahr) in den einzelnen Altersgruppen (nach [6]).
Epidemiologie
Jeder Mensch, der latent mit dem VZV infiziert ist, kann an einem Zoster erkranken. Die Inzidenzrate ist allerdings bei 20- bis 40-Jährigen mit zwei bis drei Erkrankungen pro 1000 Personen pro Jahr relativ niedrig (Abb. 2). Erst jenseits des 50. Lebensjahres steigt sie deutlich an. Sie beträgt bei den 60- bis 70-Jährigen sechs bis sieben Fälle/1000 Personen/Jahr und bei den über 80-Jährigen mehr als zehn Fälle/1000 Personen/Jahr. Hochgerechnet bedeutet dies: Wer das 85. Lebensjahr erreicht, erkrankt mit 50-prozentiger Wahrscheinlichkeit einmal an Zoster [9]. Das geschätzte Erkrankungsrisiko der gesamten Normalbevölkerung beträgt ca. 25 Prozent. Frauen sind offenbar häufiger als Männer betroffen.
Nach Schätzungen aufgrund von Abrechnungsdaten der niedergelassenen Ärzte treten in Deutschland jährlich ca. 300.000 Zostererkrankungen in der Altersgruppe der ≥50-Jährigen auf [10]. In der Gesamtpopulation ist von ca. 400.000 Zostererkrankungen auszugehen. Besonders hoch ist das Risiko für immundefiziente Personen: Patienten unter immunsuppressiver Therapie, HIV-Infizierte, Empfänger von Organtransplantaten und Patienten mit malignen lymphoproliferativen Erkrankungen. Bei dieser Personengruppe werden auch häufig Zosterrezidive beobachtet, die bei immungesunden Menschen nur selten auftreten.
Kinder, bei denen die VZV-Primärinfektion intrauterin stattgefunden hat (Varizellen der Mutter während der Schwangerschaft), haben ein deutlich erhöhtes Risiko, bereits im frühen Kindesalter an einem Zoster zu erkranken. Das ist auch bei Kindern der Fall, die im ersten Lebensjahr an Varizellen erkrankt waren [11].
Welchen Einfluss die 2004 in Deutschland eingeführte allgemeine Varizellenimpfung im Kindesalter auf die Zosterhäufigkeit hat, ist noch unbekannt. Es gibt Befürchtungen, dass mit dem Rückgang der Varizellen-Erkrankungen die Bevölkerung nicht mehr hinreichend mit Wildtypviren Kontakt hat und damit der angenommene natürliche Boostereffekt wegfällt, woraus ein Anstieg der Zosterrate resultieren könnte. Bisherige epidemiologische Daten aus den USA, wo die allgemeine Varizellenimpfung bereits 1996 eingeführt wurde, lassen diesbezüglich noch keine klaren Aussagen zu [12].
Die im Varizellenimpfstoff enthaltenen attenuierten Viren können zwar auch eine latente Infektion etablieren, aber die geimpften Kinder haben ein um ca. 80 Prozent niedrigeres Zosterrisiko als ungeimpfte Kinder, die an Varizellen erkrankt waren [13].
Krankheitsverlauf
Dem akuten Zoster geht meist eine zwei- bis fünftägige Prodromalphase mit milden uncharakteristischen Allgemeinsymptomen wie leichtem Fieber, Müdigkeit und Abgeschlagenheit voraus. Typisch sind brennende Schmerzen oder Sensibilitätsstörungen im Bereich von einem bis drei benachbarten Dermatomen. (Ein Dermatom ist das von einem Rückenmarksnerv innervierte Hautsegment; benachbarte Dermatome überlappen sich teilweise.) In seltenen Fällen bleiben Schmerzen das einzige Symptom (Zoster sine herpete) [14]. Bei Kindern sind die Allgemeinsymptome meist stärker ausgeprägt als bei Erwachsenen, während intensive Schmerzen häufig fehlen.
In dem betroffenen Hautareal zeigt sich ein Erythem, gefolgt von charakteristisch gruppiert angeordneten Papeln, aus denen sich innerhalb weniger Stunden Bläschen entwickeln. Die Bläschenbildung hält ein bis fünf Tage an. Danach trocknen diese über sieben bis zwölf Tage aus, sodass der Zoster bei immungesunden Patienten nach zwei bis vier Wochen abgeheilt ist. Bei abwehrgeschwächten Patienten können die Hautläsionen monatelang bestehen und wiederholt Bläschen auftreten. Der Zoster ist vorwiegend im Bereich der thorakalen Dermatome lokalisiert. Mit zunehmendem Alter werden häufiger die kranialen Innervationsgebiete des Nervus trigeminus befallen, vor allem des ersten Trigeminusastes (Nervus ophthalmicus). Ein wichtiges Symptom, das auf eine Augenbeteiligung hinweist, sind Hauterscheinungen an der Nasenspitze durch den Befall des Ramus nasociliaris des Nervus ophthalmicus. In seltenen Fällen ist auch die Mundhöhle betroffen. Insgesamt ist der Zoster bei ca. 20 Prozent der Fälle am Kopf lokalisiert.
Ein Zoster ist potenziell infektiös, solange Bläschen auf der Haut vorhanden sind. Das Infektionsrisiko durch Hautkontakte ist aber deutlich niedriger als bei Varizellen. Zudem scheiden die Zosterpatienten kein VZV über Sekrete des Respirationstraktes aus.
Zoster-Komplikationen
Sekundäre bakterielle Infektionen der Bläschen können den Heilungsprozess verzögern. Besonders schwere Krankheitsverläufe gehen mit hämorrhagischen und nekrotischen Hautveränderungen einher, die oft unter Narbenbildung abheilen. Das Auftreten „aberrierender“ Bläschen zeigt eine beginnende Disseminierung an, die bis zum Zoster generalisatus fortschreiten kann, der differenzialdiagnostisch von Varizellen abzugrenzen ist. Gelegentlich treten Beschwerden seitens innerer Organe auf [14, 15].
Bei mehr als der Hälfte der Patienten mit einem kranialen Zoster kommt es zur Mitbeteiligung des Auges (Zoster ophthalmicus) mit Konjunktivitis, Episkleritis und Skleritis bis zur Uveitis und Iridozyklitis. In seltenen Fällen können eine nekrotisierende Retinitis und eine Schädigung des Sehnervs auftreten.
Seltener werden neurologische Komplikationen wie Myelitis, Enzephalitis, Fazialisparese, granulomatöse Arteriitis und Guillain-Barré-Syndrom beobachtet. Segmentale Paresen können u.a. zu Zwerchfelllähmung, Bauchwandhernie und Harnblasendysfunktion führen. Es gibt auch verlässliche Daten für einen kausalen Zusammenhang von Zoster und Schlaganfall als Folge einer VZV-Vaskulopathie der Zerebralarterien [16].
Die häufigste schwerwiegende Zosterkomplikation ist die Post-Zoster-Neuralgie (PZN), die bei zehn bis 30 Prozent der zumeist älteren Patienten nach Abklingen der akuten Symptome auftritt. Die PZN wird in einem gesonderten Beitrag ausführlich dargestellt [17].
Antivirale Zostertherapie
Die Ziele der akuten Zosterbehandlung sind die Linderung der Schmerzen in der Akutphase, die Begrenzung der Ausdehnung und Dauer der Erkrankung sowie die Abschwächung oder Vermeidung von Komplikationen wie z.B. der PZN. Je nach Stadium der Erkrankung wird lokal entweder austrocknend und antiseptisch oder krustenlösend behandelt. Eine wirksame lokale antivirale Therapie ist nicht verfügbar.
Für die systemische antivirale Zostertherapie stehen in Deutschland Aciclovir (oral und i.v.), Valaciclovir (oral), Famciclovir (oral) und Brivudin (oral) zur Verfügung. Für Kinder ist nur Aciclovir zugelassen. Die Wirkstoffe hemmen die Virusreplikation und reduzieren die Dauer und Schwere der Erkrankung sowie möglicherweise das Risiko für Komplikationen [18]. Der Behandlungserfolg hängt vom Zeitpunkt des Therapiebeginns ab. Daher sollte die Therapie sofort (spätesten 72 Stunden nach Beginn der Hautsymptomatik) eingeleitet werden. Ein späterer Therapiebeginn ist noch sinnvoll, solange frische Bläschen erkennbar sind, wenn Anzeichen einer viszeralen Ausbreitung bestehen, bei floridem Zoster ophthalmicus und Zoster oticus sowie generell bei Immunsupprimierten.
- Bei unkomplizierten Zosterfällen kann das Virustatikum oral über sieben Tage verabreicht werden, wobei Brivudin (1-mal täglich 125 mg) dem Aciclovir (5-mal täglich 800 mg) und Valaciclovir (3-mal täglich 1000 mg) überlegen ist.
- Schwere Erkrankungsverläufe sowie kraniale Zostererkrankungen sollten intravenös mit Aciclovir (3-mal täglich 5 mg/kg KG über 5 bis 7 Tage; Dosisanpassung bei Nierenfunktionseinschränkung) behandelt werden; bei immuninkompetenten oder Tumorpatienten sollte die Dosis gesteigert werden (3-mal täglich 10 mg/kg KG über 7 bis 10 Tage).
- Immunsupprimierte Patienten können mit Famciclovir (3‑mal täglich 500 mg über 7 bis 10 Tage) behandelt werden (Alternative zu Aciclovir i.v.).
Die systemische antivirale Zostertherapie ist indiziert bei Patienten über 50 Jahren – also der großen Mehrheit der Patienten. Zudem ist sie altersunabhängig indiziert bei kranialem Zoster sowie bei ausgedehntem Zoster (mehr als ein Dermatom befallen), bei hämorrhagischen Läsionen und bei Schleimhautbeteiligung; schließlich auch bei Patienten mit Immunschwäche, mit malignem Grundleiden oder mit schwerer atopischer Dermatitis und anderen ausgedehnten Ekzemen [18]. Zur Zostertherapie gehört auch eine konsequente analgetische Behandlung des akuten und chronischen Zosterschmerzes [17].
Attenuierte Lebendvakzine gegen Zoster und PZN
Zur Auffrischung der Immunabwehr im Alter wurde ein attenuierter Lebendimpfstoff (Zostavax®) entwickelt, der sich vom Varizellenimpfstoff durch eine ca. 14-fach höhere Viruskonzentration unterscheidet. In einer klinischen Studie mit 38.000 Personen ab 60 Jahren konnte die Impfung das Zosterrisiko halbieren (51%) und das PZN-Risiko um 67 Prozent senken [19].
Eine große bevölkerungsbasierte Kohortenstudie in den USA, wo die Zosterimpfung seit 2006 allen Personen ab 60 Jahren empfohlen wird, kam zu vergleichbaren Ergebnissen [20]. Die Impfung schützt Menschen jenseits des 70. Lebensjahres zwar weniger effektiv vor der Zostererkrankung als Jüngere, sie verkürzt aber die Schmerzdauer und reduziert die Schmerzintensität [19]. Nach derzeitigem Wissensstand hält der Impfschutz mindestens sieben Jahre an. Ob und wann eine Wiederimpfung erforderlich ist, bleibt abzuwarten.
Der Impfstoff wird generell gut vertragen [21]. Als Nebenwirkungen traten vor allem lokale Reaktionen an der Injektionsstelle auf wie Erytheme, Schmerz, Schwellungen. Diese Beschwerden sind in der Regel von kurzer Dauer und mild. Vor der Impfung muss keine Varizellen-Anamnese erhoben werden, da der Impfstoff auch an Personen verabreicht werden kann, die nicht an Varizellen erkrankt waren.
Wie alle anderen Lebendimpfstoffe darf der Zoster-Lebendimpfstoff Personen mit angeborener oder erworbener Immundefizienz (akute/chronische Leukämie, HIV etc.) oder mit immunsuppressiver Therapie nicht verabreicht werden.
Der Zosterimpfstoff kann zeitgleich mit einem Grippeimpfstoff appliziert werden. Eine Simultangabe mit 23-valentem Pneumokokken-Polysaccharid-Impfstoff sollte nicht erfolgen, da sie zu einer geringeren Immunogenität des Zosterimpfstoffs führen kann. Zur gleichzeitigen Anwendung mit anderen Impfstoffen liegen noch keine Daten vor.
Der Zosterimpfstoff, der als Einmalgabe verabreicht wird, wurde 2006/2007 in der EU für Personen ab 50 Jahren zugelassen. Die Sächsische Impfkommission hat bereits 2010 die Zosterimpfung als Standardimpfung für alle Personen über 50 Jahre empfohlen [22]. Eine Entscheidung der STIKO steht noch aus.
Zosterimpfstoffe im klinischen Test
Inaktivierte VZV-Vakzine. Das vordergründige Ziel der Entwicklung neuer Zosterimpfstoffe ist eine Vakzine, die auch immunsupprimierten Patienten verabreicht werden kann. Da diese keine vermehrungsfähigen Viren enthalten darf, bieten sich hitzeinaktivierte Viruspräparationen an, mit denen bereits zur Varizellenprophylaxe bei Kindern mit Leukämie Erfahrungen gesammelt wurden. Die Firma Merck hat 2010 eine Phase-III-Studie begonnen, in der ein VZV-Totimpfstoff an erwachsenen Patienten mit soliden Tumoren bzw. malignen hämatologischen Erkrankungen getestet wird [23].
VZV-Untereinheiten-Impfstoff. Die Firma GlaxoSmithKline hat 2010 mit der klinischen Prüfung (Phase III) eines VZV-Untereinheiten-Impfstoffes begonnen, in den weltweit mehr als 30.000 Probanden im Alter von 50 Jahren und darüber einbezogen werden sollen. Dieser Impfstoff basiert auf dem Glykoprotein E des VZV. Die Vakzine enthält als Wirkverstärker ein Adjuvans auf Lipidbasis (AS01B). Präklinische Studien haben gezeigt, dass dieser Impfstoff eine starke zelluläre und humorale Immunantwort auslöst. Da der Untereinheiten-Impfstoff keine vermehrungsfähigen Viren enthält, könnten damit auch immunsupprimierte Menschen geimpft werden [24].
Literatur
[1] Robert Koch-Institut. Evaluation der Varizellen-Impfempfehlung durch die STIKO. Epidem Bull 1/2013
[2] Arvin A. Varicella-zoster virus. Clin Microbiol Rev 1996;9:361-81
[3] Gilden D, et al. Review: The neurobiology of varicella zoster virus infection. Neuropathol Appl Neurobiol 2011;37:441-63
[4] Arvin A. Aging, immunity, and the varicella-zoster virus. N Engl J Med 2005; 352:2266-67
[5] Burke BL, et al. Immune responses to varicella-zoster in the aged. Arch Intern Med 1982;142:291-93
[6] Hope-Simpson RE. The nature of herpes zoster: a long-term study and a new hypothesis. Proc R Soc Med 1965;58:9-20
[7] Oxman MN. Herpes zoster pathogenesis and cell-mediated immunity and immunosenescence. J Am Osteopath Assoc 2009;109(6 Suppl 2): S13-7
[8] Pinchinat S, et al. Similar herpes zoster incidence across Europe: results from a systematic literature review. BMC Infect Dis 2013;13:170
[9] Schmader K. Herpes zoster in older adults. Clin Infect Dis 2001;32: 1481-86
[10] Ultsch B, et al. Epidemiology and cost of herpes zoster and postherpetic neuralgia in Germany. Eur J Health Econ 2013;14:1015-26
[11] Sauerbrei A, Wutzler P. Varizellen in der Schwangerschaft. Dtsch Med Wochenschr 2004;129:1983-86
[12] Civen R, et al. The incidence and clinical characteristics of herpes zoster among children and adolescents after implementation of varicella vaccination. Pediatr Infect Dis J 2009;28:954-59
[13] Weinmann S, et al. Incidence and clinical characteristics of herpes zoster among children in the varicella vaccine era, 2005-2009. J Infect Dis 2013;208:1859-68
[14] Gross G. Zoster – Manifestationsformen an der Haut, Komplikationen und Therapie. Dtsch Med Wochenschr 1997;122:132-39
[15] Wutzler P, Meister M. Herpes zoster – Symptomatologie, demographische Daten und prognostische Faktoren – Ergebnisse einer prospektiven Studie an ambulanten Zosterpatienten in Deutschland. Dtsch Ärztebl 1997;94 A-1129-33
[16] Langan SM, et al. Risk of stroke following herpes zoster: a self-controlled case-series study. Clin Infect Dis 2014;58:1497-503
[17] Eren O, Straube A. Schmerztherapie bei Herpes zoster. Dtsch Apoth Ztg 2014;154(37):48-50
[18] Gross G, et al. Zoster und Zosterschmerzen – Leitlinie der Deutschen Dermatologischen Gesellschaft, Arbeitsgemeinschaft Dermatologische Infektiologie. Chemother J 2002;5:165-73
[19] Oxman MN, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med 2005;352:2271-84
[20] Langan SM, et al. Herpes zoster vaccine effectiveness against incident herpes zoster and post-herpetic neuralgia in an older US population: a cohort study. PLoS Med 2013;10(4):e1001420
[21] Tseng HF, et al. Safety of zoster vaccine in adults from a large managed-care cohort: a Vaccine Safety Datalink study. J Intern Med 2012; 271:510-20
[22] Empfehlungen der Sächsischen Impfkommission zur Durchführung von Schutzimpfungen im Freistaat Sachsen; Stand: 01.01.2010
[23] Clinical Trials.gov. http://clinicaltrials.gov/show/NCT01254630
[24] Clinical Trials.gov. http://clinicaltrials.gov/ct2/show?term= zoster+GSK&rank=3
Autor
Univ.-Prof. Dr. Peter Wutzler
Universitätsklinikum Jena
Institut für Virologie und Antivirale Therapie
Hans-Knöll-Str. 2
07745 Jena





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.