
- DAZ.online
- DAZ / AZ
- DAZ 27/2014
- Fetter Fisch für alle
Ernährung
Fetter Fisch für alle?
Was Omega-3-Fettsäuren wirklich leisten
Biochemie der Fettsäuren
Nomenklatur. Fettsäuren sind in der Regel aliphatische Monocarbonsäuren, deren Name daher rührt, dass natürlich vorkommende Fette und Öle aus den Estern dieser Monocarbonsäuren und Glycerin bestehen. Die Fettsäuren können anhand ihrer Kettenlänge, ihrer Anzahl enthaltener Doppelbindungen (gesättigt, einfach ungesättigt, mehrfach ungesättigt) und ihrer Notwendigkeit der Nahrungszufuhr (essenziell/nicht essenziell) charakterisiert werden. Die systematische Nomenklatur der Fettsäuren beginnt mit der Zählung am Carboxylende. Die historische ω-Nomenklatur der ungesättigten Fettsäuren bezeichnet die Lage der Doppelbindungen vom Methyl-Ende der Fettsäure ausgehend. Beispielsweise wird die Ölsäure als wichtigster Vertreter der einfach ungesättigten Fettsäuren systematisch als cis-9-Octadecensäure, aber in ihrer Struktur als ω-9-Fettsäure mit dem Lipidnamen 18:1 (ω-9) bezeichnet.
ω-3- und ω-6-Fettsäuren. Bei den ω-3-Fettsäuren handelt es sich um eine Gruppe mehrfach ungesättigter Fettsäuren. Zu den bekanntesten Vertretern dieser Gruppe gehören die aus Pflanzen stammende α-Linolensäure (ALA) sowie die beiden in maritimen Organismen vorkommenden Eicosapentaensäure (EPA) und Docosahexaensäure (DHA). Ihren besonderen ernährungsmedizinischen Stellenwert haben die ALA, EPA und DHA aufgrund ihrer komplexen physiologischen Funktionen. Diese sind unter anderem [1]:
- Strukturbestandteile von Zellmembranen, besonders im ZNS
- Precursor zahlreicher antiinflammatorischer Mediatoren (Serie-1- und Serie-3-Eicosanoide)
- Aufrechterhaltung der physiologischen Funktion von Gehirn und Retina
- Bestandteile der Gallenflüssigkeit
- Strukturbestandteile des Lungen-Surfactants
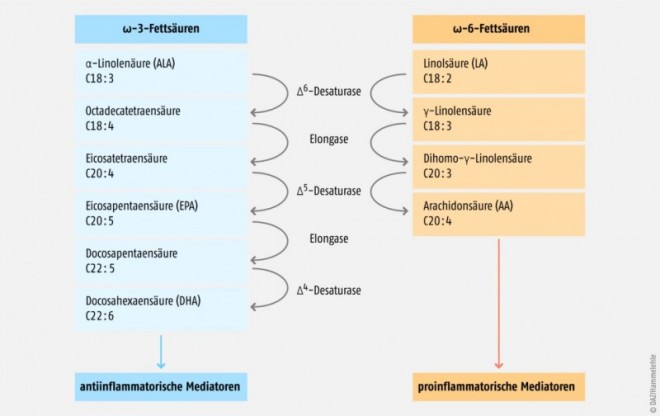
Von den ω-3-Fettsäuren ist lediglich die α-Linolensäure essenziell, sie muss also mit der Nahrung zugeführt werden; Eicosapentaensäure und Docosahexaensäure können physiologisch durch Kettenverlängerung aus der α-Linolensäure gebildet werden. Die Umwandlungsrate der α-Linolensäure zu EPA und DHA beträgt jedoch nur ca. 5 bis 10% und ist außerdem von der Menge der parallel aufgenommenen ω-6-Fettsäuren abhängig, da diese über identische Enzyme metabolisiert werden [2] (Abb. 1). Auf diesem Weg wird die ebenfalls essenzielle ω-6-Fettsäure Linolsäure zu Arachidonsäure umgewandelt, die als Ausgangssubstanz verschiedener proinflammatorischer Mediatoren an zahlreichen pathophysiologischen Prozessen beteiligt ist [1–3]. Bei einem ω-6-Fettsäure-lastigen Verhältnis in der Nahrung wird daher endogen weniger EPA und DHA aus α-Linolensäure, dafür aber vermehrt Arachidonsäure aus den ω-6-Fettsäuren gebildet. Hauptquelle dieses ungünstigen Überschusses an ω-6-Fettsäuren sind meist tierische Fette. Die Deutsche Gesellschaft für Ernährung empfiehlt zur ausreichenden Versorgung mit ω-3-Fettsäuren ein Fettsäureverhältnis zwischen ω-6- und ω-3-Fettsäuren in der Nahrung von maximal 5:1 [4, 5]; bei der in den Industrienationen üblichen, fleischlastigen Ernährung liegt dieses Verhältnis allerdings bei 10:1 [4]. Dieses Ungleichgewicht trägt vermutlich maßgeblich zu den ungünstigen Effekten einer fleischreichen Ernährung bei [1–3].
ω-3-Fettsäuren und Hirnfunktion
ω-3-Fettsäuren sind unverzichtbare Bestandteile für den Aufbau, die Reifung und die physiologische Funktion neuronaler Strukturen; sie tragen im ZNS zur Aufrechterhaltung der normalen Hirnaktivität bei und regulieren die neuronale Gentranskription und Neurotransmitter-Ausschüttung. Es ist daher naheliegend, bei neuropsychiatrischen und neurodegenerativen Erkrankungen einen Mangel an ω-3-Fettsäuren zu vermuten. Pathophysiologisch gut belegt ist die Rolle von Neuroprotectin D1 (NPD1), das im Gehirn aus Docosahexaensäure gebildet wird [3]: An Neuronen wirkt NPD1 über zahlreiche komplementäre Effekte neuroprotektiv, indem es antiapoptotische und antiinflammatorische Wirkungen vermittelt und die neuronale Resistenz gegenüber oxidativem Stress verbessert [6–8]. Außerdem reduziert NPD1 die Bildung der β-Amyloide [6], die Bestandteil seniler Plaques sind und als Hauptursache für Morbus Alzheimer und andere demenzielle Erkrankungen gelten [9].
Altersbedingter kognitiver Leistungsverlust. Vor diesem Hintergrund erscheint ein Vorteil durch die Supplementation mit ω-3-Fettsäuren über Nahrungsergänzungsmittel zur Prävention von Demenz und altersbedingtem kognitivem Leistungsverlust sinnvoll. Die Daten zur Verbesserung der kognitiven Leistungsfähigkeit bei Gesunden stammen jedoch überwiegend aus tierexperimentellen Studien [10–12]. Zwar gibt es auch Interventionsstudien an Menschen, bei denen die mehrmonatige Supplementation mit ω-3-Fettsäuren (z.B. 900 mg/d DHA) den altersbedingten Abbau der kognitiven Fähigkeiten bremste und die Gedächtnisleistung verbesserte [13]. Eine aktuelle und qualitativ hochwertige Cochrane-Metaanalyse zum Effekt der ω-3-Fettsäure-Supplementation bei gesunden Menschen über 60 Jahre konnte jedoch keine Evidenz für eine entsprechende Wirksamkeit hinsichtlich einer verbesserten kognitiven Leistungsfähigkeit oder gar hinsichtlich der Demenz-Inzidenz finden [14]. Der Beobachtungszeitraum bei den eingeschlossenen Studien betrug allerdings maximal 40 Monate, und es ist möglich, dass eine längerfristige Supplementation durchaus einen positiven Effekt haben könnte. Unbeantwortet ist ebenfalls die Frage, welche ω-3-Fettsäure sinnvollerweise in welcher Dosierung verwendet werden sollte.
Morbus Alzheimer. Im Hirngewebe von Alzheimer-Patienten sind nicht nur die Konzentrationen der β-Amyloide erhöht, sondern es sind auch die Konzentrationen von Docosahexaensäure und NPD1 erniedrigt [3]. Dies betrifft vor allem Areale, die an Lernfähigkeit und Gedächtnis beteiligt sind [15]. Aus Beobachtungsstudien ist ebenfalls bekannt, dass möglicherweise ein umgekehrter Zusammenhang zwischen der täglich mit der Nahrung aufgenommenen DHA-Menge und der Prävalenz der Alzheimer-Erkrankung besteht [16, 17]. Allerdings sind selbst die Ergebnisse der reinen Beobachtungsstudien widersprüchlich [18–23]; die möglichen Zusammenhänge sind überaus komplex und können keineswegs auf die einfache These „Mehr ω-3-Fettsäuren in der Nahrung = weniger Demenz“ reduziert werden [24]. Die verfügbaren, placebokontrollierten Interventionsstudien bei Menschen mit bereits diagnostizierter Alzheimer-Demenz zeigen keinen klinisch signifikanten Vorteil einer Supplementation mit ω-3-Fettsäuren [16, 25–27]. Die Datenlage zur Prävention einer Alzheimer-Demenz ist insbesondere deshalb schlecht, weil die methodische Qualität, die für entsprechende Studien erforderlich wäre, praktisch kaum erbracht werden kann: In einem randomisiert-kontrollierten Setting müssten mehrere hundert Probanden über Jahrzehnte (!) entsprechende Supplemente konsumieren. Da dies nicht praktikabel ist, stammen die vorhandenen Daten aus Studien mit Interventionszeiträumen von wenigen Monaten, was vorhersehbar keine reduzierte Alzheimer-Inzidenz nachweisen kann [14].
Morbus Parkinson. Ähnlich sieht die Studienlage auch für die mögliche Wirksamkeit von ω-3-Fettsäuren bei Morbus Parkinson aus: Zwar konnte in zahlreichen Laborstudien gezeigt werden, dass Docosahexaensäure an dopaminergen Neuronen neuroprotektive Effekte besitzt und antiinflammatorisch wirkt [28, 29], und in tierexperimentellen Parkinson-Modellen kann DHA Dopaminmangel-Dyskinesien reduzieren [30]. Bislang gibt es aber keine aussagekräftige Studie, die einen protektiven oder gar therapeutischen Effekt von ω-3-Fettsäure-Supplementen oder ω-3-Fettsäure-reicher Ernährung bei Parkinson-Patienten belegen würde.
Neuropsychiatrische Erkrankungen. Die beste Datenlage zur klinischen Wirksamkeit von ω-3-Fettsäuren gibt es für die Verwendung von EPA-Supplementen bei depressiven Erkrankungen: So zeigen mehrere große Metaanalysen von placebokontrollierten Interventionsstudien, dass die tägliche Gabe von EPA (200 bis 2200 mg/d), nicht jedoch von DHA, die depressive Symptomatik messbar reduziert [31–33]. Entscheidend scheint bei kombinierten Supplementen neben der Dosierung auch das relative Mengenverhältnis der einzelnen ω-3-Fettsäuren zu sein: So sollte das Verhältnis EPA/DHA möglichst > 60% betragen [31]. Die zugrunde liegenden Mechanismen sind derzeit Gegenstand intensiver Forschung.
Aufgrund dieser positiven Daten für die Therapie der Depression gibt es innerhalb der aktuellen neuropsychiatrischen Forschung nahezu keine Indikation, bei der nicht die Wirksamkeit einer Supplementation mit ω-3-Fettsäuren untersucht wird, so beispielsweise bei bipolaren Störungen [34], Borderline-Störungen [35], Schizophrenie [36], Autismus [37], kindlichen Lernstörungen [38] oder beim Aufmerksamkeitsdefizit-Hyperaktivitätssyndrom (ADHS) [39]. Ob sich hieraus zukünftig tatsächlich irgendein nutzbares therapeutisches Potenzial ableiten lässt, kann auf Grundlage der bisherigen Ergebnisse nicht seriös abgeschätzt werden.
Schwangerschaft. Umfassend belegt ist jedoch die Bedeutung einer ausreichenden ω-3-Fettsäure-Zufuhr in der Schwangerschaft für die visuelle und kognitive Entwicklung des Kindes; dies betrifft insbesondere die ausreichende Zufuhr von Docosahexaensäure (DHA). So wirkt sich eine überdurchschnittliche DHA-Zufuhr während der Schwangerschaft positiv auf die kindliche Sehschärfe, kognitive Funktionen, Intelligenz (IQ), Schlafmuster und Feinmotorik aus [40–43]. Aktuelle Studien stellen diese Sichtweise jedoch infrage und zeigen, dass die Vorteile der DHA-Supplementation nur in den ersten Lebensmonaten des Kindes festzustellen sind, während sie sich bei älteren Kindern verlieren und gegenüber den Umwelteinflüssen in den ersten Lebensjahren vermutlich vernachlässigbar sind [44]. Inwieweit diese Ergebnisse zutreffend sind, muss in weiteren Studien geklärt werden. Bis auf Weiteres sollten Schwangere und Stillende für die optimale Entwicklung ihres Kindes jedoch täglich mindestens 200 mg DHA zuführen; kann diese Menge nicht über regelmäßigen Fischkonsum (zwei- bis dreimal wöchentlich, s.u.) erreicht werden – z.B. bei Veganerinnen! –, sollten die Frauen entsprechende Supplemente verwenden [40, 45].
ω-3-Fettsäuren und kardiovaskuläres System
Physiologische Effekte ohne klinische Relevanz. Der häufig diskutierte antithrombotische Effekt der ω-3-Fettsäuren ist in sehr hohen Dosierungen vorhanden (15 g/d in Supplementform, entspricht ca. 1,2 kg Hering pro Tag!), konnte aber in klinischen Studien nicht zuverlässig reproduziert werden [46]. In den vergangenen Jahren wurde jedoch auch immer wieder gezeigt, dass EPA und DHA vasodilatatorisch, antiarrhythmisch, lipidsenkend und antiinflammatorisch wirken [47–51] – alles Effekte also, die sich günstig auf die Prävalenz und den Verlauf kardiovaskulärer Erkrankungen auswirken müssten. Hinsichtlich klinisch relevanter Endpunkte wie kardiovaskulärer Morbidität und Mortalität – also jenseits rein pathophysiologischer Parameter – ist die Datenlage nach wie vor uneinheitlich: So gibt es zwar zahlreiche Studien, die einen präventiven Effekt zeigen [52–57]; jedoch gibt es mindestens ebenso viele doppelblinde, randomisierte und placebokontrollierte Studien, bei denen ein derartiger Effekt nicht nachweisbar ist [58–64].
Von stärkerer Aussagekraft sollten daher Metaanalysen sein. Interessanterweise kommen lediglich jene Metaanalysen zu positiven – also kardiovaskulär-präventiv wirksamen – Ergebnissen, die auch Studien ohne Placebo-Kontrolle in die Auswertung mit einschlossen [65-67]. Beinhalten die Metaanalysen zur Sekundärprävention ausschließlich placebokontrollierte Studien, so zeigt die Supplementation mit ω-3-Fettsäuren keinen Effekt auf die Häufigkeit von Schlaganfall, Herzinfarkt, Herzinsuffizienz, Angina pectoris, kardiovaskuläre Mortalität oder Gesamtmortalität [68, 69]. Zum gleichen Ergebnis kommt auch eine Cochrane-Analyse aus dem Jahr 2009, die weder für Gesunde noch für bereits kardiovaskulär Erkrankte einen Vorteil durch ω-3-Fettsäure-Supplemente oder durch ω-3-Fettsäure-reiche Ernährung zeigte [70]. Und die immer wieder als Beleg für die kardiovaskuläre Wirksamkeit der ω-3-Fettsäuren angeführte GISSI-Studie mit über 11.000 Patienten nach Herzinfarkt weist erhebliche methodische Mängel auf: Zwar war das kardiovaskuläre Risiko in der ω-3-Gruppe reduziert, doch die Kontrollgruppe erhielt statt der heute zur Risikoreduktion üblichen Statin-Therapie überhaupt keine Prophylaxe; außerdem war die Studie herstellerfinanziert (Omacor®), nicht verblindet, nicht placebokontrolliert, ohne vorher definierte sekundäre Endpunkte und hatte eine erhebliche vorzeitige Abbruchquote von 29% [71].
Alles nur ein Missverständnis?
Als Grundlage für die Hypothese, dass ein hoher ω-3-Fettsäure-Konsum das Risiko für kardiovaskuläre Erkrankungen reduziert, dienen auch in der aktuellsten Literatur immer noch die Studien von Bang und Dyerberg aus den 1970er Jahren [72–74]. Faktisch wurden in diesen Untersuchungen jedoch lediglich die Ernährungsgewohnheiten, nicht aber die Prävalenzen kardiovaskulärer Erkrankungen untersucht. In einem aktuellen Übersichtsartikel zur kardiovaskulären Morbidität der Inuit in Grönland, Alaska und Kanada konnte hingegen gezeigt werden, dass sich die Prävalenz kardiovaskulärer Erkrankungen trotz des hohen Seefisch-Konsums nicht von europäischen Vergleichspopulationen unterscheidet [75]. Im Gegenteil: Die Inuit haben eine erhöhte Schlaganfallrate, eine erhöhte Gesamtmortalität und eine um durchschnittlich zehn Jahre geringere Lebenserwartung [75]. Dennoch werden die genannten Studien von Bang und Dyerberg weiterhin zitiert, wenn der kardiovaskuläre Vorteil eines hohen Fischöl-Konsums belegt werden soll. Vor diesem Hintergrund sowie angesichts der Tatsache, dass die oben genannten Metaanalysen keinen kardiovaskulär präventiven Effekt durch Fischöl-Supplementation zeigen konnte, ist es erstaunlich, dass die aktuellen amerikanischen und europäischen Leitlinien noch immer den regelmäßigen Konsum ω-3-Fettsäure-haltiger Lebensmittel zur Prävention kardiovaskulärer Erkrankungen empfehlen [76, 77].
Andererseits könnte es einen plausiblen Grund für den fehlenden klinischen Wirksamkeitsnachweis geben: Nahezu alle Patienten mit hohem kardiovaskulärem Risiko, insbesondere nach bereits überlebtem erstem Herzinfarkt, erhalten heute eine Statin-Therapie, auch die Patienten in den genannten Studien zur Sekundärprävention. Abgesehen von der heute nicht mehr leitliniengerechten Kontrollgruppe der GISSI-Studie erhalten die Patienten in den Interventionsgruppen ein Statin + ω-3-Fettsäuren, die Patienten in den Kontrollgruppen ein Statin (mono). Somit könnte ein möglicher positiver Effekt der ω-3-Fettsäuren durch die Statine kaschiert werden, worauf der Umstand hindeutet, dass der kardiovaskuläre Vorteil nur dann nachweisbar ist, wenn die Kontrollgruppe eben kein Statin erhält. Daraus ergibt sich die leider unbefriedigende Tatsache, dass ein kardiovaskulär günstiger Effekt der ω-3-Fettsäuren vor den physiologischen und epidemiologischen Hintergründen durchaus plausibel scheint, dieser Effekt aber gegenüber einer wirksamen Statin-Therapie wohl vernachlässigbar ist [68].
Eine praktische Schlussfolgerung lässt sich daher aus all den Studien ziehen: Patienten mit Atherosklerose oder weiteren kardiovaskulären Risikofaktoren, die ohnehin eine leitliniengerechte Arzneimitteltherapie (Statine, gegebenenfalls auch ASS, Betablocker, ACE-Hemmer) erhalten, haben durch die Supplementation mit ω-3-Fettsäuren keinen Zusatznutzen.
Omega-3-Fettsäuren in Lebensmitteln
In der Nahrung sind ω-3-Fettsäuren in pflanzlichen wie tierischen Fetten und Ölen zu finden, allerdings mit recht unterschiedlichen Substanzmustern (Tab. 1 und 2).
Unter ernährungsphysiologischen Aspekten besonders geeignete Quellen für ω-3-Fettsäuren sind Leinöl, Perillaöl, fette Fische bzw. Fisch-/Krillöl (Tab. 3); allerdings lehnen viele Menschen Leinöl oder Fisch aus geschmacklichen Gründen ab, und sowohl das Perilla- als auch das Krillöl sind bislang wenig bekannt.
α-Linolensäure aus pflanzlichen Ölen. Die empfohlene Zufuhr an α-Linolensäure beträgt 0,5% der Gesamtenergiezufuhr [5]. Dies wären beim durchschnittlichen täglichen Energiebedarf eines normalgewichtigen Erwachsenen (ca. 2000 kcal) ungefähr 10 kcal pro Tag, enthalten z.B. in 500 g geräucherter Makrele oder einem halben Teelöffel Leinöl/Perillaöl (ca. 2 g) bzw. einem Esslöffel Rapsöl (ca. 10 g). Insbesondere Leinöl und Perillaöl wären aufgrund ihres überdurchschnittlichen Gehalts an α-Linolensäure potenzielle Alternativen zu einem regelmäßig hohen Fischkonsum. Es gibt jedoch einen Haken: Im Rahmen der üblicherweise ω-6-Fettsäure-lastigen Ernährung werden durch die kompetitive Enzymhemmung nur 5 bis 10% der in den Ölen reichlich enthaltenen ALA in Eicosapentaensäure und Docosahexaensäure umgewandelt. Um auf die als Schätzwert veranschlagte empfohlene Tageszufuhr an EPA und DHA (250 bis 300 mg/d [4]) zu kommen, wäre unter Berücksichtigung der geringen Umwandlungsrate aus ALA ein täglicher Konsum von ca. 75 ml (!) Leinöl erforderlich – was natürlich nicht realisierbar ist.
EPA und DHA aus Fisch. Die empfohlene Tageszufuhr an EPA und DHA kann über den indirekten Weg (endogene Bildung aus ALA) aus pflanzlichen Ölen nicht ausreichend gedeckt werden [1, 4]. Zwar sind beide ω-3-Fettsäuren in pflanzlichen Ölen grundsätzlich nicht enthalten, jedoch wäre die direkte Aufnahme beider ω-3-Fettsäuren über Fisch bzw. Fischöle möglich. Die Zufuhrmengen zur Deckung des täglichen EPA/DHA-Bedarfs (250 bis 300 mg/d [4]) sind über Fisch grundsätzlich praktikabel [78]:
- ca. 25 g Hering/Tag oder
- ca. 25 g Thunfisch/Tag oder
- ca. 35 g Makrele/Tag oder
- ca. 60 g Sardine/Tag oder
- ca. 70 g Lachs/Tag oder
- ca. 200 g Forelle/Tag oder
- ca. 300 g „Seelachs“/Tag
Beim sogenannten „Seelachs“ handelt es sich nicht – wie die Bezeichnung suggerieren soll – um eine Fischart, sondern um ein Produkt der Lebensmittelindustrie: „Seelachs“ ist ein Lachsersatz-Produkt, das auf die Lachs-Engpässe während es des Ersten Weltkriegs zurückgeht. Tatsächlich besteht „Seelachs“ aus dem Fleisch des Köhlers (Pollachius virens), das zu diesem Zweck rot eingefärbt wird. Gleiches gilt für den sogenannten „Alaska-Seelachs“, der wie das Krebsfleisch-Imitat Surimi aus dem Pazifischen Pollak (Theragra chalcogramma) hergestellt wird. Zoologisch gehören weder der Köhler noch der Pazifische Pollak zu den Lachsartigen, sondern zu den Dorschen, weshalb auch der ω-3-Fettsäuregehalt dieser Ersatzprodukte deutlich niedriger ist als der von echtem Lachs.
EPA und DHA aus Fischölen. Viele Menschen essen jedoch keinen Fisch und fragen nach Alternativen, um ω-3-Fettsäuren in ausreichendem Maße zuzuführen. Innerhalb des reichhaltigen Sortiments gewinnt aktuell das Krillöl immer mehr an Bedeutung. Krillöl wird aus dem Antarktischen Krill (Euphausia superba), einer antarktischen Krebsart, gewonnen und weist eine Besonderheit auf: Während die anderen natürlichen Fischöle ω-3-Fettsäuren ausschließlich in Form von Triglyceriden enthalten, liegt ein Teil der ω-3-Fettsäuren im Krillöl als Phospholipid vor [79]. Hierdurch soll die Bioverfügbarkeit der ω-3-Fettsäuren verbessert sein. Ob die Bioverfügbarkeit bei Substanzen, deren klinische Wirksamkeit zumindest zweifelhaft ist, überhaupt eine Rolle spielt, sei jedoch dahingestellt. Möchte man für das Krillöl dennoch einen Vorteil nennen, dann diesen: Anders als bei den meisten Fischöl-Supplementen kommt es hierbei nicht zu dem unangenehmen fischigen Aufstoßen.
Fazit
Die Studienlage zum Thema „Wirksamkeit der ω-3-Fettsäuren“ sieht unübersichtlich aus, die aktuellen Metaanalysen sind aber eindeutig: Für den Bereich der neuropsychiatrischen und –degenerativen Erkrankungen ist allein für die Depression unter Umständen ein Nutzen bestimmter ω-3-Fettsäure-Supplemente belegt.
Die postulierten kardioprotekiven Effekte einer Supplementation mit ω-3-Fettsäuren sind nicht nachzuweisen. Patienten mit erhöhtem kardiovaskulärem Risiko profitieren von einer ω-3-Fettsäure-Supplementation nur dann, wenn ihnen die leitliniengerechte Pharmakotherapie mit Statinen und Antihypertensiva vorenthalten wird – und das will ja niemand. Und Gesunde? Hier hat die Empfehlung der Deutschen Gesellschaft für Ernährung, mindestens zwei Mal in der Woche Seefisch zu essen, nach wie vor ihre Berechtigung: Fisch besteht nicht nur aus ω-3-Fettsäuren, sondern er kann als Bestandteil einer abwechslungsreichen mediterranen Ernährung sicherlich zur Kardioprotektion beitragen.
Autoren
Prof. Dr. rer. nat. Martin Smollich, Fachapotheker für Klinische Pharmazie, Antibiotic Stewardship-Experte (DGI). 1998 bis 2004 Studium von Biologie und Pharmazie in Münster und Cambridge (UK), 2005 bis 2008 wissenschaftlicher Mitarbeiter an der Universitätsfrauenklinik Münster, 2009 bis 2013 klinische Tätigkeit und pharmakologischer Konsildienst. Seit 2013 Professor und Studiengangsleiter des Studiengangs Clinical Nutrition/Ernährungsmanagement an der Mathias Hochschule Rheine.
Wissenschaftliche Schwerpunkte: klinische Ernährung, klinische Pharmakologie, Arzneimitteltherapiesicherheit und rationale Antiinfektiva-Therapie
Dipl. med. päd. Birgit Blumenschein, Diätassistentin, 1988 bis 1990 Ausbildung zur staatlich anerkannten Diätassistentin, 1996 bis 2002 Lehrassistentin an medizinischer Fachschule, Fachbereich Diätassistenz, 1997 bis 2003 Studium der Medizinpädagogik an der Charité in Berlin. Seit 2003 selbstständig tätig in eigener Praxis, seit 2011 wissenschaftliche Mitarbeiterin an der Mathias Hochschule Rheine, Studiengangskoordinatorin des Studiengangs Clinical Nutrition/Ernährungsmanagement, B.Sc.
Wissenschaftliche Schwerpunkte: Ernährungsmedizin mit den Schwerpunkten Gastroenterologie, Stoffwechsel und Adipositas; betriebliches Gesundheitsmanagement
Quelle
[1] Schmidt K, Bayer W. Orthomolekulare Diagnostik, Prävention und Therapie am Beispiel der Omega-3-Fettsäuren und ihrer Metabolite. In: E&M Ernährung und Medizin 2013;28:55-60
[2] Schek A. Ernährungslehre kompakt. 4., aktualisierte und ergänzte Auflage. Umschau Zeitschriftenverlag GmbH 2011;56-61
[3] Bazan NG, Molina MF, Gordon WC. Docosahexaenioc acid signalolipidomics in nutrition: Significance in aging, neuroinflammation, macular degeneration, Alzheimer`s, and other neurodegenerative diseases. Annual Review of Nutrition 2011;31:321-351
[4] DGE Deutsche Gesellschaft für Ernährung (Hrsg.) 12. Ernährungsbericht 2012. DGE Bonn 2012;55
[5] DACH Referenzwerte für die Nährstoffzufuhr 4., korrigierter Nachdruck. Neuer Umschau Buchverlag. Neustadt a.d.W. DGE Bonn 2012;43-58
[6] Lukiw WJ, Cui J, Marcheselli VL et al. A role for docosahexaenoic acidderived neuroprotectin D1 in neural cell survival and Alzheimer disease. J Clin Invest 2005;115:2774-2783
[7] Marcheselli VL, Hong S, Lukiw WJ et al. Novel docosanoids inhibit brain ischemia-reperfusion-mediated leukocyte infiltration and pro-inflammatory gene expression. J Biol Chem 2003;278:43807-43817
[8] Mukherjee PK, Marcheselli VL, Serhan CN et al. Neuroprotectin D1:a docosahexaenoic acid-derived docosatriene protects human retinal pigment epithelial cells from oxidative stress. Proc Natl Acad Sci USA 2004;101:8491-8496
[9] Haass C. Initiation and propagation of neurodegeneration. Nat Med 2010;16:1201-1204
[10] Petursdottir AL, Farr SA, Morley JE et al. Effect of dietary n-3 polyunsaturated fatty acids on brain lipid fatty acid composition, learning ability, and memory of senescence-accelerated mouse. J Gerontol A Biol Sci Med Sci 2008;63:1153-1160
[11] Lim SY, Hoshiba J, Moriguchi T et al. N-3 fatty acid deficiency induced by a modified artificial rearing method leads to poorer performance in spatial learning tasks. Pediatr Res 2005;58:741-748
[12] Lim SY, Hoshiba J, Salem N Jr. An extraordinary degree of structural specificity is required in neural phospholipids for optimal brain function: n-6 docosapentaenoic acid substitution for docosahexaenoic acid leads to a loss in spatial task performance. J Neurochem 2005;95:848-857
[13] Yurko-Mauro K, McCarthy D, Rom D et al. Beneficial effects of docosahexaenoic acid on cognition in age-related cognitive decline. Alzheimers Dement 2010;6:456-464
[14] Sydenham E, Dangour AD, Lim WS. Omega 3 fatty acid for the prevention of cognitive decline and dementia. Cochrane Database of Systematic Reviews 2012, 6:Art. No. CD005379
[15] Soderberg M, Edlund C, Kristensson K et al. Fatty acid composition of brain phospholipids in aging and in Alzheimer’s disease. Lipids 1991;26:421-425
[16] Freund-Levi Y, Eriksdotter-Jönhagen M, Cederholm T et al. Omega-3 fatty acid treatment in 174 patients with mild to moderate Alzheimer disease: OmegAD study: a randomized double-blind trial. Arch. Neurol. 2006;63:1402-1408
[17] Cunnane SC, Plourde M, Pifferi F et al. Fish, docosahexaenoic acid and Alzheimer’s disease. Prog Lipid Res 2009;48:239-256
[18] Morris MC, Evans DA, Bienias JL et al. Dietary fats and the risk of incident Alzheimer disease. Arch Neurol 2003;60:194-200
[19] Morris MC, EvansDA, Bienias JL et al. Consumption of fish and n-3 fatty acids and risk of incident Alzheimer disease. Arch Neurol 2003;60:940-946
[20] Barberger-Gateau P, Raffaitin C, Letenneur L et al. Dietary patterns and risk of dementia: The three-city cohort study. Neurology 2007;69:1921-1930
[21] Nurk E, Drevon CA, Refsum H et al. Cognitive performance among the elderly and dietary fish intake: The Hordaland Health Study. Am J Clin Nutr 2007;86:1470-1478
[22] Kalmijn S, van Boxtel MP, Ocke M et al. Dietary intake of fatty acidsand fish in relation to cognitive erformance at middle age. Neurology 2004;62:275-280
[23] Schaefer EJ, Bongard V, Beiser AS et al. Plasma phosphatidylcholine docosahexaenoic acid content and risk of dementia and Alzheimer disease: The Framingham Heart Study. Arch Neurol 2006;63:1545-1550
[24] Fotuhi M, Mohassel P, Yaffe K. Fish consumption, long-chain omega-3 fatty acids and risk of cognitive decline or Alzheimer disease:A complex association. Nat Clin Pract Neurol 2009;5:140-152
[25] Chiu CC, Su KP, Cheng TC et al. The effects of omega-3 fatty acids monotherapy in Alzheimer’s disease and mild cognitive impairment: A preliminary randomized double-blind placebo-controlled study. Prog Neuropsychopharmacol Biol Psychiatry 2008;32:1538-1544
[26] Kotani S, Sakaguchi E, Warashina S et al. Dietary supplementation of arachidonic and docosahexaenoic acids improves cognitive dysfunction. Neurosci Res 2006;56:159-164
[27] Quinn JF, Raman R, Thomas RG et al. Docosahexaenoic acid supplementation and cognitive decline in Alzheimer disease: a randomized trial. JAMA 2010;304:1903-1911
[28] Tanriover G, Seval-Celik Y, Ozsoy O et al. The effects of docosahexaenoic acid on glial derived neurotrophic factor and neurturin in bilateral rat model of Parkinson’s disease. Folia Histochem Cytobiol 2010;48:434-441
[29] Hacioglu G, Seval-Celik Y, Tanriover G et al. Docosahexaenoic acid provides protective mechanism in bilaterally MPTP-lesioned rat model of Parkinson‘s disease. Folia Histochem Cytobiol 2012;50:228-238
[29] Cansev M, Ulus IH, Wang L et al. Restorative effects of uridine plus docosahexaenoic acid in a rat model of Parkinson’s disease. Neurosci Res 2008;62:206-209
[30] Samadi P, Grégoire L, Rouillard C et al. Docosahexaenoic acid reduces levodopa-induced dyskinesias in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine monkeys. Biochemistry 2006;45:15610-15616
[31] Sublette ME, Ellis SP, Geant AL et al. Meta-analysis of the effects of eicosapentaenoic acid (EPA) in clinical trials in depression. J Clin Psychiatry 2011;72:1577-1584
[32] Ross BM, Seguin J, Sieswerda LE. Omega-3 fatty acids as treatments for mental illness: which disorder and which fatty acid? Lipids Health Dis 2007;6:21
[33] Martins JG. EPA but not DHA appears to be responsible for the efficacy of omega-3 long chainpolyunsaturated fatty acid supplementation in depression:evidence from a meta-analysis of randomized controlled trials. J Am Coll Nutr 2009;28:525-542
[34] Rakofsky JJ, Dunlop BW. Review of nutritional supplements for the treatment of bipolar depression. Depress Anxiety 2014;31:379-390
[35] Amminger GP, Chanen AM, Ohmann S et al. Omega-3 fatty acid supplementation in adolescents with borderline personality disorder and ultra-high risk criteria for psychosis: a post hoc subgroup analysis of a double-blind, randomized controlled trial. Can J Psychiatry 2013;58:402-408
[36] Marano G, Traversi G, Nannarelli C et al. Omega-3 fatty acids and schizophrenia: evidences and recommendations. Clin Ter. 2013;164:e529-537
[37] Amminger GP, Berger GE, Schäfer MR et al. Omega-3 fatty acids supplementation in children with autism: a double-blind randomized, placebo-controlled pilot study. Biol Psychiatry 2007;61:551-553
[38] Tan ML, Ho JJ, Teh KH. Polyunsaturated fatty acids (PUFAs) for children with specific learning disorders. Cochrane Database Syst Rev. 2012;12:CD009398
[39] Barragán E, Breuer D, Döpfner M. Efficacy and safety of omega-3/6 fatty acids, methylphenidate, and a combined treatment in children with ADHD. J Attend Disord 2014 (epub ahead of print)
[40] Koletzko B, Cetin I, Brenna JT et al. Dietary fat intakes for pregnant and lactating women. Br J Nutr 2007;98:873-877
[41] Helland IB, Smith L, Saarem K et al. Maternal supplementation with very-long-chain n-3 fatty acids during pregnancy and lactation augments children’s IQ at 4 years of age. Pediatrics 2003;111:e39–e44
[42] Hibbeln JR, Davis JM, Steer C et al. Maternal seafood consumption in pregnancy and neurodevelopmental outcomes in childhood (ALSPAC study):an observational cohort study. Lancet 2007;369:578–585
[43] Jensen CL. Effects of n-3 fatty acids during pregnancy and lactation. Am J Clin Nutr 2006;83:1452–1457
[44] Makrides M, Gould JF et al. Four-Year Follow-up of Children Born to Women in a Randomized Trial of Prenatal DHA Supplementation. JAMA 2014;311:1802-1804
[45] Koletzko B. Ernährung in der Schwangerschaft: Für das Leben des Kindes prägend. Dtsch Arztebl 2013;110(13):A-612
[46] Mozaffarian D, Wu HY. Omega-3 fatty acids and cardiovascular disease. J Am Coll Cardiol 2011;58:2047–6207
[47] Mori TA. Omega-3 fatty acids and blood pressure. Cell Mol Biol 2010;56:83-92
[48] McKenney JM, Sica D. Prescription omega-3 fatty acids for the treatment of hypertriglyceridemia. Am J Health Syst Pharm. 2007;64:595-605
[49] Mita T, Watada H, Ogihara T et al. Eicosapentaenoic acid reduces the progression of carotid intimamedia thickness in patients with type 2 diabetes. Atherosclerosis 2007;191:162-167
[50] Wall R, Ross RP, Fitzgerald GF et al. Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids. Nutr Rev 2010;68:280-289
[51] Metcalf RG, Sanders P, James MJ et al. Effect of dietary n-3 polyunsaturated fatty acids on the inducibility of ventricular tachycardia in patients with ischemic cardiomyopathy. Am J Cardiol 2008;101:758-761
[52] Singh RB, Niaz MA, Sharma JP et al. Randomized, double-blind, placebo-controlled trial of fish oil and mustard oil in patients with suspected acute myocardial infarction:the Indian experiment of infarct survival-4. Cardiovasc Drugs Ther 1997;11:485-491
[53] von Schacky C, Angerer P, Kothny W et al. The effect of dietary omega-3 fatty acidson coronary atherosclerosis. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 1999;130:554-562
[54] Leaf A, Albert CM, Josephson M et al; Fatty Acid Antiarrhythmia Trial Investigators. Prevention of fatal arrhythmias in high-risk subjects by fish oil n-3 fatty acid intake. Circulation 2005;112:2762-2768
[55] Galan P, Kesse-Guyot E, Czernichow S et al. Effects of B vitamins and omega 3 fatty acids on cardiovascular diseases: a randomised placebo controlled trial. BMJ 2010;341:c6273.
[56] Tavazzi L, Maggioni AP, Marchioli R et al;GISSIHF Investigators. Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008;372:223-1230
[57] Svensson M, Schmidt EB, Jørgensen KA et al. OPACH Study Group. N-3 fatty acids as secondary prevention against cardiovascular events in patients who undergo chronic hemodialysis: a randomized, placebo-controlled intervention trial. Clin J Am Soc Nephrol 2006;1:780-786
[58]. ORIGIN Trial Investigators, Bosch J, Gerstein HC et al. n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia. N Engl J Med 2012;367:309-318
[59] Leng GC, Lee AJ, Fowkes FG et al. Randomized controlled trial of gamma-linolenic acid and eicosapentaenoic acid in peripheral arterial disease. Clin Nutr 1998;17:265-271
[60] Nilsen DW, Albrektsen G, Landmark K et al. Effects of a high-dose concentrate of n-3 fatty acids or corn oil introduced early after an acute myocardial infarction on serum triacylglycerol and HDL cholesterol. AmJ Clin Nutr 2001;74:50-56
[61] Kromhout D, Giltay EJ, Geleijnse JM. Alpha Omega Trial Group. n-3 fatty acids and cardiovascular events after myocardial infarction. N Engl J Med. 2010;363:2015-2026.
[62] Rauch B, Schiele R, Schneider S et al. OMEGA, a randomized, placebocontrolled trial to test the effect of highly purified omega-3 fatty acids on top of modern guidelineadjusted therapy after myocardial infarction. Circulation 2010;122:2152-2159
[63] Einvik G, Klemsdal TO, Sandvik L et al. A randomized clinical trial on n-3 polyunsaturated fatty acids supplementation and all-cause mortality in elderly men at high cardiovascular risk. Eur J Cardiovasc Prev Rehabil 2010;17:588-592
[64] Brouwer IA, Zock PL, Camm AJ et al. Effect of fish oil on ventricular tachyarrhythmia and death in patients with implantable cardioverter defibrillators: the Study on Omega-3 Fatty Acids and Ventricular Arrhythmia (SOFA) randomized trial. JAMA 2006;295:2613-2619
[65] Bucher HC, Hengstler P, Schindler C et al. N-3 polyunsaturated fatty acids in coronary heart disease: a meta-analysis of randomized controlled trials. Am J Med 2002;112:298-304
[66] Hooper L, Thompson RL, Harrison RA et al. Risks and benefits of omega 3 fats for mortality, cardiovascular disease, and cancer: systematic review. BMJ 2006;332:752-760
[67] Marik PE, Varon J. Omega-3 dietary supplements and the risk of cardiovascular events: a systematic review. Clin Cardiol 2009;32:365-372
[68] Kwak SM, Myung SK, Lee YJ et al. Korean Meta-analysis Study Group. Efficacy of omega-3 fatty acid supplements (eicosapentaenoic acid and docosahexaenoic acid) in the secondary prevention of cardiovascular disease: a meta-analysis of randomized, double-blind, placebo-controlled trials. Arch Intern Med 2012;172:686-694
[69] Rizos EC, Ntzani EE, Bika E et al. Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: a systematic review and meta-analysis. JAMA 2012;308:1024-1033
[70] Hooper L, Harrison RA, Summerbell CD et al. Omega 3 fatty acids for prevention and treatment of cardiovascular disease. Cochrane Database Syst Rev 2004;CD003177
[71] GISSI-Prevenzione Investigators (Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto Miocardico). Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSIPrevenzione trial Lancet 1999;354:447-455
[72] Bang HO, Dyerberg J, Nielsen AB. Plasma lipid and lipoprotein pattern in Greenlandic West-coast Eskimos. Lancet 1971;1:1143-1145
[73] Bang HO, Dyerberg J. Fat content of the blood and composition of the diet in a population group in West Greenland. Ugeskr Laeger 1975;137:1641-1646
[74] Dyerberg J, Bang HO, Stoffersen E et al. Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis? Lancet 1978;2:117-119
[75] Fodor GJ, Helis E, Yazdekhasti N et al. Fishing for the origins of the Eskimos and heart disease story. Facts or wishful thinking? A review. Can J Cardiol, e-pub ahead of print 14.04.2014, doi.org/10.1016/j.cjca.2014.04.007
[76] American Heart Association. Available at: www.heart.org/HEARTORG/GettingHealthy/NutritionCenter/HealthyEating/The-American-Heart-Associations-Diet-and-Lifestyle-Recommendations_UCM_305855_Article. Aufgerufen am 17. Mai 2014
[77] The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). 2013 ESH/ESC Guidelines for the management of arterial hypertension. J Hypertens 2013;31:1281-1357
[78] Blumenschein B. Rheuma und Ernährung. In: Ernährung im Fokus 2012;12:60-65
[79] Gigliotti JC, Davenport M, Beamer S et al. Extraction and characterization of lipids from Antarctic krill (Euphausia superba). Food Chem 2011;125:1028-1036
[80] DGE Deutsche Gesellschaft für Ernährung (Hrsg.) Arganöl. In: DGE-Info – Essen und Trinken. 02/2006. www.dge.de/modules.php?name=News&file=article&sid=585 Zugriff:4. Mai 2014
[81] Krist S. Lexikon der pflanzlichen Fette und Öle. 2. Auflage 2013;S 83. Springer Berlin.
[82] Adam O. Diät & Rat bei Rheuma und Osteoporose. Hädecke. Weil der Stadt 2010;161-163
[83] Chung KH, Hwang HJ, Kyung OS et al. Effects of perilla oil on plasma concentrations of cardioprotective (n-3) fatty acids and lipid profiles in mice. Nutr Res Pract 2013;7:256-261
[84] Kitajka K, László G, Pukás G et al. The role of n-3 polyunsaturated fatty acids in brain: Modulation of rat brain gene expression by dietary n-3 fatty acids. PNAS 2002;99:2619-2624
[85] Ulven SM, Kirkhus B, Lamglait A et al. Metabolic Effects of Krill Oil are Essentially Similar to Those of Fish Oil but at Lower Dose of EPA and DHA, in Healthy Volunteers. Lipids 2011;46:37-46
[86] Phleger CF, Nelson MM, Mooney BD et al. Interannual and between species comparison of the lipids, fatty acids and sterols of Antarctic krill from the US AMLR Elephant Island survey area Biochem Physiol B. 2002;131:733-747
[87] Flemmer A. Ernährung bei Multipler Sklerose. Ernährung & Medizin 2008;23:29-33
[88] Souci Fachmann Kraut. Die Zusammensetzung der Lebensmittel Nährwert-Tabellen. 7. revidierte und ergänzte Auflage Wissenschaftliche Verlagsgesellschaft. Stuttgart 2008






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.