
- DAZ.online
- DAZ / AZ
- DAZ 13/2014
- Vitamine C und D, Selen ...
Krebstherapie
Vitamine C und D, Selen und Carnitin
Ausgewählte Mikronährstoffe in der Krebstherapie
Vitamin C
Selbst bei der Einnahme extrem hoher Dosen Vitamin C (z.B. 18 g/Tag, p.o.) steigt der Vitamin-C-Plasmaspiegel nur auf maximal 220 bis 240 µmol/l (3,9–4,2 mg/dl). Demgegenüber werden bei der intravenösen Applikation von 10 g oder 50 g Vitamin-C-Peakwerte von etwa 6.000 µmol/l bzw. 14.000 µmol/l erreicht. In-vitro-Studien haben gezeigt, dass Vitamin-C-Plasmaspiegel über 1000 µmol/l auf Tumorzellen zytotoxisch wirken, ohne normale Zellen zu schädigen. Dabei spielt das Wasserstoffperoxid (H2O2), dessen Synthese von Vitamin C induziert wird, eine zentrale Rolle, denn H2O2 ist in der Lage, Krebszellen selektiv zu vernichten [7–10].
Klinische Studien
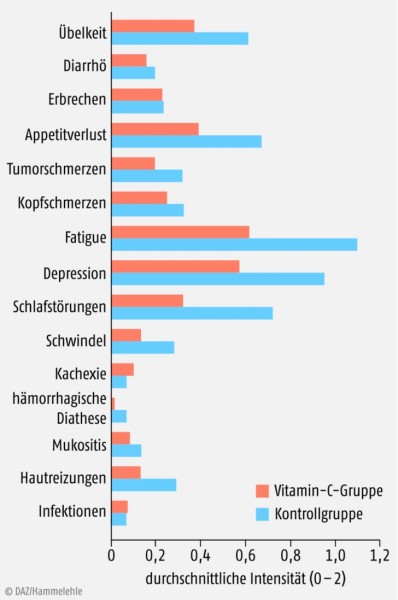
Brustkrebs. 125 Brustkrebspatientinnen (UICC-Klassifikation: IIa bis IIIb; Durchschnittsalter 56 Jahre) erhielten nach der Operation begleitend zur Chemo- und Radiotherapie einmal wöchentlich 7,5 g Vitamin C i.v. über mindestens vier Wochen. Bei ihnen waren typische krankheits- oder therapiebedingte Beschwerden nur etwa halb so intensiv wie in der Kontrollgruppe ohne Vitamin-C-Infusionen (Abb. 1). Die Vitamin-C-Infusionen selbst verursachten keine Nebenwirkungen [11].
Ovarialkarzinom. Patientinnen mit fortgeschrittenem epithelialem Ovarialkarzinom (Stadium IIIc), die nach einer Primäroperation eine Chemotherapie bzw. Konsolidierungstherapie mit Carboplatin und Paclitaxel erhielten, supplementierten regelmäßig hochdosierte diätetische Antioxidanzien. Zusätzlich wurde ihnen nach Ausschluss eines Glucose‑6-Phosphat-Dehydrogenase-Mangels 40 Monate lang zweimal wöchentlich 60 g [!] Vitamin C infundiert, um Plasmaspiegel > 200 mg/dl zu erzielen. Die Auswirkungen auf die tumordestruktive Effektivität und Nebenwirkungsrate der Chemotherapie sowie auf die Remissionsdauer und die Lebensqualität waren überaus günstig. Bei den Patientinnen waren drei Jahre nach Ende der Behandlung keine Rezidive nachweisbar. Der Tumormarker CA-125 lag im Normbereich [12].
Fallberichte
In drei Fallberichten, bei denen die vom National Cancer Institute der USA erstellten „Best Case Series Guidelines“ zugrunde gelegt wurden, war die langfristige Vitamin-C-Hochdosistherapie mit einem außergewöhnlich guten klinischen Verlauf assoziiert [13].
- Eine Patientin (51 Jahre, starke Raucherin) mit Nierenzellkarzinom (Grad III/IV mit Beteiligung der Nierenvene), bei der sechs Monate nach der Nephrektomie mehrere Lungenmetastasen nachgewiesen wurden, lehnte die konventionelle Therapie ab und entschied sich stattdessen für eine Vitamin-C-Hochdosistherapie (65 g i.v., 2x/Woche, über 10 Monate). Die Untersuchung nach einem Jahr ergab in der Lunge keinen pathologischen Befund. Erst fünf Jahre später fand sich ein kleinzelliges Lungenkarzinom, an dem die Patientin verstarb.
- Ein Patient (49 Jahre) mit Harnblasenkarzinom (Grad 3/3, papilläres, muskelinvasives Übergangsepithelkarzinom) und multiplen Satellitentumoren erhielt nach der Resektion des Tumors eine Vitamin-C-Hochdosistherapie (30 g i.v., 2x/Woche über 3 Monate; danach 4 Jahre lang 30 g i.v. alle 1–2 Monate, unterbrochen von 1–2-monatigen Intervallen mit häufigeren Infusionen). Nach neun Jahren war der Patient bei guter Gesundheit und frei von Metastasen.
- Eine Patientin (66 Jahre), die ein diffuses großes B-Zell-Lymphom (Stadium III mit Beteiligung axillärer Lymphknoten) hatte, lehnte nach einer 5-wöchigen Bestrahlung eine Chemotherapie ab und wählte stattdessen eine Vitamin-C-Hochdosistherapie (15 g i.v., 2x/Woche über 2 Monate, dann 1x/Woche über 7 Monate, dann alle 2–3 Monate über 1 Jahr). Zehn Jahre nach der Diagnose war sie beschwerdefrei und ohne Anzeichen einer malignen Erkrankung.
Eine Patientin mit Brustkrebs erhielt nach Ausschluss eines Glucose-6-Phosphat-Dehydrogenase-Mangels jeweils vor der Chemotherapie (3x 5-FU-Epirubicin-Cyclophosphamid (FEC) und 3x Docetaxel) eine Infusion von 150 g [!] Vitamin C in 1000 ml Ringer-Lactat-Lösung plus 400 mg Magnesium – der Fall wurde 2007 in der Deutschen Zeitschrift für Onkologie dokumentiert. Die Vitamin-C-Hochdosistherapie, die immer noch weitergeführt wird (150 g i.v., alle 4 bis 6 Wochen) zeigte einen überaus günstigen Effekt auf die Nebenwirkungsrate der Chemotherapie (z.B. Fatigue, Mukositis, Neurotoxizität) und die Lebensqualität der Patientin. Eine Beeinträchtigung der Nierenfunktion ist bis heute nicht nachweisbar [14].
Patienten mit Pankreaskarzinom
Die Vitamin-C-Hochdosistherapie (15–125 g i.v., 2x/Woche, Dosiseskalation bis Vitamin-C-Plasmaspiegel > 20.000 µmol/l bzw. 350 mg/dl) bei neun Patienten mit Pankreaskarzinom (Stadium IV), die das Zytostatikum Gemcitabin (1.000 mg/m2, 1x wöchentlich über 3 Wochen) in Kombination mit Vitamin C erhielten, zeigte eine gute Verträglichkeit sowie einen günstigen Einfluss auf den Krankheitsverlauf. Bei einem der Patienten konnte anhand von CT-Scans innerhalb von vier Monaten eine Abnahme der primären Tumorgröße auf ein Neuntel beobachtet werden. Die Patienten verloren im Behandlungszeitraum von durchschnittlich sechs Monaten (Spanne: 69–556 Tage) nur etwa 5,3 kg Körpergewicht. Die Zeit bis zur Krankheitsprogression betrug 26 Wochen. Die durchschnittliche Überlebenszeit der Patienten, die mindestens zwei Therapiezyklen abgeschlossen hatten, lag bei 13 Monaten (gegenüber 6,65 Monaten bei mit Gemcitabin behandelten Patienten in einer 1997 publizierten Studie). Als Nebenwirkungen traten vor allem Nausea, Durst und Diarrhö auf [15].
Vitamin-C-Hochdosistherapie
Vor der Infusion sollte labormedizinisch ein Glucose‑6-Phosphat-Dehydrogenase-Mangel ausgeschlossen werden. Cave Hämolyse!
Dosis: 7,5 g bis 60 g Vitamin C pro Infusion (langsam auftitrieren)
Zielwert: Vitamin-C-Plasmaspiegel > 1.000–20.000 µmol/l (17,5–350 mg/dl)
Keine Anwendung während der Strahlentherapie
Fazit
Laut ersten Studienergebnissen wirken sich hoch dosierte Vitamin-C-Infusionen während des Chemotherapiezyklus günstig auf die Nebenwirkungsrate und die Lebensqualität von Krebspatienten aus, doch müssen weitere Interventionsstudien Belege für die klinische Wirksamkeit und die Unbedenklichkeit liefern. Von einer Vitamin-C-Hochdosistherapie während der Strahlentherapie wird derzeit in jedem Fall abgeraten.
Selen
Das Spurenelement Selen ist Bestandteil einiger Proteine, die den Redoxhaushalt und die antioxidative Kapazität der Zellen und zahlreicher Gewebe (z.B. Schilddrüse) regulieren und dadurch vorzeitigen Alterungsprozessen, funktionellen Beeinträchtigungen und genetischen Mutationen vorbeugen. Die Supplementierung von Selen kann die Krebsprävention verbessern und die Nebenwirkungen einer Strahlen- und Chemotherapie (z.B. Cisplatin, Anthracycline) reduzieren, ohne deren onkologische Wirkung zu beeinträchtigen [16, 17]. Zudem verbessert Selen die Lebensqualität der Tumorpatienten.
Selen und Chemotherapie
In einer randomisierten Cross-over-Studie mit 41 Patienten, die eine Chemotherapie mit Cisplatin (60–80 mg/m2) erhielten, verringerte die hoch dosierte Gabe von Selen (4 mg/d, p.o.) die hämatotoxischen und nephrotoxischen Nebenwirkungen von Cisplatin. Bei den supplementierten Patienten war die Leukozytenanzahl 14 Tage nach Beginn der Chemotherapie signifikant höher (3,35 x 109/l vs. 2,31 x 109/l), sodass sie weniger Granulozyten-Kolonie-stimulierenden Faktor (110,1 vs. 723,6) und gar keine Bluttransfusion benötigten [18].
Bei Patientinnen mit Ovarialkarzinom, die mit Cyclophosphamid und Cisplatin behandelt wurden (n = 31), führte die dreimonatige Supplementierung von täglich 200 µg Selen zu einem idealen Selen-Serumspiegel (130,23 µg/l; Kontrollgruppe 51,41 µg/l) und zu einer signifikanten Verbesserung des Immunstatus und der Nebenwirkungen (z.B. Hämatotoxizität). Die supplementierten Patientinnen litten seltener unter Nebenwirkungen wie Appetitverlust, Übelkeit, Erbrechen, Stomatitis, Haarausfall, Flatulenz, abdominellen Schmerzen, Schwäche und Unwohlsein [19].
Bei Patienten mit neu diagnostiziertem Non-Hodgkin-Lymphom, die mit einer Chemotherapie nach dem CHOP-Schema behandelt wurden (n = 50), führte die 30-tägige, sehr hoch dosierte Gabe von Selen in Form von Natriumselenit (200 µg/kg KG/d) zu einer signifikanten Abnahme des Tumormarkers Bcl-2 (8,6 ng/ml; Kontrollgruppe 36,9 ng/ml). Das mediane Gesamtüberleben der Patienten mit kompletter Remission war in der Selen-Gruppe zwei Monate länger als in der Kontrollgruppe (21,9 vs. 19,7 Monate) [20]. In einer weiteren Studie an Patienten mit Non-Hodgkin-Lymphom (n = 40) steigerte die Gabe von Natriumselenit (200 µg/kg KG/d, 7 Tage lang) während der Chemotherapie die Apoptoserate der Lymphomzellen signifikant (78,9% vs. 58,9%); zudem war die Herzfunktion der supplementierten Patienten erheblich besser [21].
Selen und Strahlentherapie
In einer randomisierten Studie an Patienten mit Kopf-Hals-Tumoren (n = 39) verringerte die Supplementierung von Selen (500 µg, als Natriumselenit) während der Strahlentherapie die Dysphagierate signifikant [22]. In einer weiteren Studie erhielt eine Gruppe der Patientinnen, denen ein Zervix- oder Uterustumor chirurgisch entfernt worden war (n = 81), während der Strahlentherapie täglich 300 µg Selen als Natriumselenit (an den Tagen der Strahlentherapie 500 µg Selen). Bei ihnen trat die radiogene Diarrhö (Grad ≥ 2) nur halb so häufig auf wie in der Kontrollgruppe, und nach zehn Jahren betrug ihre Gesamtüberlebensrate 58,4% gegenüber 44,8% [23].
Selen in der Krebstherapie
Applikation in Form von Natriumselenit (Na2SeO3)
Dosis bei Radiotherapie: 500–1.000 µg Selen p.o. am Tag der RT
Dosis bei Chemotherapie: 1.000–2.000 µg Selen i.v. 30-45 min vor der CT
Zielwert: 130–155 µg/l Selen im Vollblut
Fazit
Die Gabe von Selen kann Nebenwirkungen der Chemo- und Strahlentherapien verringern, ohne dass sie die jeweilige Hauptwirkung beeinträchtigt. Anzustreben ist ein Selen-Serumspiegel von 110 bis 130 µg/l (130–155 µg/l Selen im Vollblut). Achtung: Bei Krebspatienten sollte nur Natriumselenit eingesetzt werden, da organische Selenverbindungen (z.B. Selenomethionin) im Körper akkumulieren können.
Vitamin D
Als ausgeprägter Vitamin-D-Mangel gilt ein Calcidiol(25-OH-D)-Serumspiegel unter 20 ng/ml (50 nmol/ml). Er tritt bei Krebspatienten häufig auf [23] und kann mit einem ungünstigen Verlauf der Erkrankung korrelieren, so in einer amerikanischen Studie mit fast 1000 Patienten mit Non-Hodgkin-Lymphom [24, 25]. Sowohl bei Patienten mit Kolonkarzinom als auch bei Patientinnen mit Mammakarzinom erwies sich der Vitamin-D-Status als unabhängiger Prädiktor für das Überleben [26]. Zudem begünstigt ein Vitamin-D-Mangel das Auftreten von Komplikationen (z.B. Atemwegsinfekte).
Vitamin D und Chemotherapie
Bei Brustkrebspatientinnen, die eine Chemotherapie mit Anthracyclinen und Taxanen erhielten, wurde ein deutlicher Abfall des Calcidiol-Spiegels beobachtet [27]; das liegt daran, dass einige Zytostatika (z.B. Cyclophosphamid, Paclitaxel) über eine Induktion der 24-Hydroxylase den enzymatischen Abbau von Calcidiol und Calcitriol fördern. Zudem beeinflussen sie die Expression von Genen, die normalerweise durch Vitamin D reguliert wird [28].
Fallberichten zufolge konnten mukokutane Nebenwirkungen (z.B. Stomatitis, Dermatitis) und Geschmacksstörungen (Dysgeusie), die bei Krebspatienten mit ausgeprägtem Vitamin-D-Mangel unter einer Polychemotherapie nach dem TCH-Schema (Docetaxel, Carboplatin, Trastuzumab) oder dem FOLFOX6-Schema (Fluorouracil, Calciumfolinat, Oxaliplatin) auftraten, erfolgreich durch die Gabe von Vitamin D behandelt werden [29].
Kombination mit Letrozol oder Bisphosphonaten
Bei Brustkrebspatientinnen mit Vitamin-D-Mangel, die eine adjuvante Therapie mit dem Aromatasehemmer Letrozol erhielten, traten Knochen- und Gelenkschmerzen (Arthralgien) auf, die sich nach der Supplementierung von Vitamin D besserten [30, 31].
Patientinnen, die außer der Standardtherapie (Letrozol + 600 IE Vitamin D3 + 1200 mg Calcium täglich) einmal wöchentlich 30.000 IE Vitamin D3 p.o. erhielten, litten nach 24 Wochen signifikant weniger unter Arthralgien und Fatigue als die Patientinnen in der Vergleichsgruppe (n = 147) [24, 32].
Wenn eine Therapie mit Bisphosphonaten durchgeführt werden soll, ist in jedem Fall vorher der Vitamin-D-Status zu prüfen, denn bei einem Vitamin-D-Mangel ist die Therapie kontraindiziert [33]. Auch das Risiko für Kiefernekrosen steigt bei einem Vitamin-D-Mangel deutlich [24, 34].
Fazit
Der Vitamin-D-Status sollte bei allen Krebspatienten gemessen und durch eine adäquate Supplementierung kompensiert werden (Tab. 1). Nach fünf bis sechs Wochen sollte der Vitamin-D-Status kontrolliert werden. Der Zielwert liegt im Bereich 40 bis 60 ng/ml (100–150 nmol/ml) 25-OH-D im Serum.
L‑Carnitin
Studien zufolge weisen bis zu 80% der Patienten mit fortgeschrittenen Krebserkrankungen einen Mangel an L‑Carnitin auf [1, 2, 35]. Die bisher bekannten Ursachen sind vielfältig:
- Mangelernährung (z.B. Mangel an Eisen, Vitamin C, L‑Methionin),
- Interaktion von Zytostatika (z.B. Anthracyclinen) mit dem Carnitintransporter OCTN2,
- Störung der L‑Carnitinbiosynthese durch Anthracycline,
- Steigerung der renalen Carnitinelimination durch Cisplatin und Ifosfamid,
- Bildung von unphysiologischen Carnitinestern und erhöhte renale Ausscheidung.
Für den Einsatz von L‑Carnitin bei Krebspatienten sprechen die gute Verträglichkeit, die immunstabilisierende Wirkung, die potenzielle zytoprotektive Wirkung während einer Chemotherapie sowie die fehlende Beeinträchtigung der erwünschten Zytostatikawirkung.
L‑Carnitin hemmt proinflammatorische Zytokine, vermindert den Abbau der Skelettmuskulatur und erhöht die Energiebereitstellung aus der β-Oxidation. So erscheint es naheliegend, dass die Gabe von L‑Carnitin bei Krebspatienten viele Symptome wie Tumorkachexie, Anorexie und Fatigue vermeiden oder verringern kann. Hierzu wurden zwar zahlreiche präklinische, aber nur kleinere (meist nicht GCP-konforme) klinische Studien publiziert.
Fragestellungen der Studien waren u.a. die Reduktion der Neurotoxizität von Paclitaxel oder der Kardiotoxizität von Anthracyclinen sowie die Minderung von Fatigue im Kontext mit Cisplatin oder Ifosfamid [36–39]. Die placebokontrollierte CARPAN-Studie hat bei Patienten mit fortgeschrittenem Pankreaskarzinom (n = 72) ergeben, dass die Gabe von L‑Carnitin (2x 2.000 mg/d, p.o.) sowohl die Lebensqualität als auch den Ernährungszustand der Patienten signifikant verbessert, die Überlebenszeit (nicht signifikant) verlängert und die Krankenhausverweildauer senkt [2, 40].
Fazit
Die Supplementierung oder parenterale Applikation von L‑Carnitin ist vor allem bei Krebspatienten mit schlechtem Ernährungsstatus, Therapien mit Anthracyclinen, Cisplatin, Ifosfamid und Taxanen sowie Fatigue und Tumorkachexie in Erwägung zu ziehen. Bei Tumorkachexie ist auch die Kombination mit Omega-3-Fettsäuren empfehlenswert.
Literatur
[1] Gröber U, Holzhauer P, Kisters K. Besser durch die Krebstherapie. Mehr Lebensqualität mit den richtigen Vitaminen und Mineralstoffen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2014.
[2] Gröber U, Mücke R, Adamietz I, et al. Komplementärer Einsatz von Antioxidanzien und Mikronährstoffen in der Onkologie - Update 2013. Der Onkologe, 2013; 19(2): 136-143.
[3] D’Andrea G. Use of antioxidants during chemotherapy and radiotherapy should be avoided. CA Cancer J Clin, 2005; 55(5):319-321.
[4] Block KI, Koch AC, Mead MN et al. Impact of antioxidant supplementation on chemotherapeutic toxicity: A systematic review of the evidence from randomized controlled trials. International Journal of Cancer, 2008; 123(6):1227-1239.
[5] Gröber U. Antioxidants and other micronutrients in complementary oncology. Breast Care (Basel), 2009; 4(1): 13-20.
[6] Nechuta S, Lu W, Chen Z, et al. Vitamin supplement use during breast cancer treatment and survival: a prospective cohort study. Cancer Epidemiol Biomarkers Prev, 2011; 20(2): 262–271.
[7] Padayatty JS, Sun H, Wang Y, et al. Vitamin C pharmacokinetics: Implications for oral and intravenous use. Ann Intern Med, 2004; 140(7): 533-538.
[8] Chen Q, Espey MG, Krishna MC, et al. Pharmacologic ascorbic acid concentrations selectively kill cancer cells: action as prodrug to deliver hydrogen peroxide to tissues. Proc Natl Acad Sci USA 2005; 102(38): 13604-13609.
[9] Chen, Q, Espey MG, Sun AY, et al. Pharmacologic doses of ascorbate act as prooxidant and decrease growth of aggressive tumor xenografts in mice. Proc Natl Acad Sci USA 2008; 105 (32): 11037-11038.
[10] Ma Y, Chapman J, Levine M, et al. High-dose parenteral ascorbate enhanced chemosensitivity of ovarian cancer and reduced toxicity of chemotherapy. Sci Transl Med. 2014; 6(222): 222ra18.
[11] Vollbracht C, Schneider B, Leendert V, Weiss G et al. Intravenous vitamin C administration improves quality of life in breast cancer patients during chemo-/radiotherapy and after care: results of a retrospective, multicentre, epidemiological cohort study in Germany. In Vivo, 2011; 25: 983–990.
[12] Drisko JA, Chapman J, Hunter VJ, The use of antioxidants with first-line chemotherapy in two cases of ovarian cancer. J Am Coll Nutr, 2003; 22(2): 118–123.
[13] Padayatty SJ, Riordan HD, Hewitt SM, et al. Intravenously administered vitamin C as cancer therapy: three cases. CMAJ 2006; 174(7): 937-942.
[14] Gröber U. Vitamin-C-Hochdosisinfusionstherapie beim Mammakarzinom: Falldarstellung der Vitamin-C-Hochdosisinfusionstherapie GL. Deutsche Zeitschrift für Onkologie, 39 (2): 80–81, 2007.
[15] Welsh JL,Wagner BA, Van ’t Erve TJ et al. Pharmacological ascorbate with gemcitabine for the control of metastastic and node-positive pancreatic cancer (PACMAN): results from a phase I clinical trial. Cancer Chemother Pharmacol, 2013; 71 (3): 765–775.
[16] Wallenberg M, Misra S, Björnstedt M,Selenium Cytotoxicity in Cancer. Basic Clin Pharmacol Toxicol, 2014 [Epub ahead of print].
[17] Mücke R, Schomburg L, Gröber U, Holzhauer P, Micke O, Komplementärer Seleneinsatz in der Onkologie. Der Onkologe, 2010; 16: 181-186.
[18] Hu YJ, Chen Y, Zhang YQ, et al. The protective role of selenium on the toxicity of cisplatin-contained chemotherapy regimen in cancer patients. Biol Trace Elem Res, 1997; 56(3):331-341.
[19] Sieja K, Talerczyk M Selenium as an element in the treatment of ovarian cancer in women receiving chemotherapy. Gynecol Oncol, 2004; 93(2): 320-327.
[20] Asfour IA, Fayek M, Raouf S, et al. The impact of high-dose sodium selenite therapy on Bcl-2 expression in adult non-Hodgkin‘s lymphoma patients: correlation with response and survival. Biol Trace Elem Res, 2007; 120(1-3): 1-10.
[21] Asfour IA, El-Tehewi MM, Ahmed MH, et al. High-dose sodium selenite can induce apoptosis of lymphoma cells in adult patients with non-Hodgkin‘s lymphoma. Biol Trace Elem Res, 2009; 127(3): 200-210.
[22] Büntzel J, Riesenbeck D, Glatzel M, et al. Limited effects of selenium substitution in the prevention of radiation-associated toxicities. results of a randomized study in head and neck cancer patients. Anticancer Res, 2010; 30(5): 1829-1832.
[23] Muecke R, Schomburg L, Glatzel M, et al. Multicenter, phase 3 trial comparing selenium supplementation with observation in gynecologic radiation oncology. Int J Radiat Oncol Biol Phys, 2010; 78(3): 828-835.
[24] Gröber U, Spitz J, Reichrath J, Kisters K, Holick MF. Vitamin D. Update 2013. From rickets prophylaxis to general healthcare. Dermatoendocrinol, 2013; 5:3, e2: 331-347.
[25] Drake MT, Maurer MJ, Link BK, Habermann TM, et al. Vitamin D insufficiency and prognosis in non-Hodgkin’s lymphoma. J Clin Oncol 2010; 28: 4191–4198.
[26] Goodwin PJ, Ennis M, Pritchard KI, Koo J, et al. Prognostic effects of 25-hydroxyvitamin D levels in early breast cancer. J Clin Oncol 2009;27:3757–63.
[27] Santini D, Galluzzo S, Vincenzi B, Zoccoli A, et al. Longitudinal evaluation of vitamin D plasma levels during anthracycline- and docetaxel based adjuvant chemotherapy in early-stage breast cancer patients. Ann Oncol 2010; 21:185–186.
[28] Gröber U, Kisters K, Influence of drugs on vitamin D and calcium metabolism. Dermatoendocrinol, 2012; 4(2): 158-166.
[29] Fink M. Vitamin D deficiency is a cofactor of chemotherapy-induced mucocutaneous toxicity and dysgeusia. J Clin Oncol 2011; 29(4): e81–e82.
[30] Khan QJ, Reddy PS, Kimler BF, Sharma P, et al. Effect of vitamin D supplementation on serum 25-hydroxy vitamin D levels, joint pain, and fatigue in women starting adjuvant letrozole treatment for breast cancer. Breast Cancer Res Treat 2010; 119(1):111–118.
[31] Prieto-Alhambra D, Javaid MK, Servitja S, Arden NK, et al. Vitamin D threshold to prevent aromatase inhibitor-induced arthralgia: a prospective cohort study. Breast Cancer Res Treat 2011; 125(3): 869–78.
[32] Khan QJ, et al. Randomized trail of vitamin D3 to prevent worsening of musculoskeletal symptoms and fatigue in women with breast cancer starting adjuvant letrozole: The VITAL trial. J Clin Oncol 2012;30(Suppl):abstr. 9000, ASCO-Kongress 2012.
[33] Favus MJ. Bisphosphonates for osteoporosis. N Engl J Med, 2010; 363(21): 2027-2035.
[34] Bedogni A, Saia G, Bettini G, et al. Osteomalacia: the missing link in the pathogenesis of bisphosphonate-related osteonecrosis of the jaws? Oncologist, 2012; 17(8):1114-1119.
[35] De Grandis D. Acetyl-L-carnitine for the treatment of chemotherapy-induced peripheral neuropathy: a short review. CNS Drugs, 2007; 21 Suppl 1:39-43.
[36] Jin HW, Flatters SJ, Xiao WH et al. Prevention of paclitaxel-evoked painful peripheral neuropathy by acetyl-L-carnitine: effects on axonal mitochondria, sensory nerve fiber terminal arbors, and cutaneous Langerhans cells. Exp Neurol, 2008; 210(1):229-237.
[37] Bianchi G, Vitali G, Caraceni A et al. Symptomatic and neurophysiological responses of paclitaxel- or cisplatin-induced neuropathy to oral acetyl-L-carnitine. Eur J Cancer, 2005; 41(12):1746-1750.
[38] Sayed-Ahmed MM, Salman TM, Gaballah HE et al. Propionyl-L-carnitine as protector against adriamycin-induced cardiomyopathy. Pharmacol Res, 2001; 43(6):513-520.
[39] Wenzel U, Nickel A, Daniel H. Increased carnitine-dependent fatty acid uptake into mitochondria of human colon cancer cells induces apoptosis. J Nutr, 2005; 135(6):1510-1514.
[40] Kraft M, Kraft K, Gärtner S, et al. L-Carnitine-supplementation in advanced pancreatic cancer (CARPAN) – a randomized multicentre trial. Nutr J, 2012;11: 52. doi: 10.1186/1475-2891-11-52.
Autoren
Apotheker Uwe Gröber, Akademie für Mikronährstoffmedizin, Essen, www.mikronaehrstoff.de
Dr. med. Peter Holzhauer, Chefarzt Innere Medizin II, Abteilung für Onkologie und Komplementärmedizin des onkologischen Zentrums Oberaudorf, Klinik Bad Trissl und Interdisziplinäres Onkologisches Zentrum (IOZ), München
Prof. Dr. med. Klaus Kisters, Chefarzt an der Medizinischen Klinik I am St. Anna-Hospital, Herne




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.