
- DAZ.online
- DAZ / AZ
- DAZ 28/2013
- 5-Jahres-Bilanz zu ...
DAZ aktuell
5-Jahres-Bilanz zu Kinderarzneimitteln
Ein erster bedeutender Meilenstein in der Umsetzung der Verordnung war die Einrichtung des Pädiatrieausschusses (Pediatric Committee, PDCO), der seit Juli 2007 einmal im Monat zusammen kommt. Zudem hat im Jahr 2009 das Europäische Netzwerk für die pädiatrische Forschung der EMA (Enpr-EMA) seine Tätigkeit aufgenommen und trifft sich seit 2010 regelmäßig. Im Dezember 2010 wurden die Ergebnisse der Erhebung über alle derzeitigen Verwendungen von Arzneimitteln in der pädiatrischen Bevölkerungsgruppe der EU veröffentlicht. Sie dienten als Grundlage für das Inventar des Therapiebedarfs.
Neue Arzneimittel mit PIP
Mit der Verordnung wurden die pharmazeutischen Unternehmen verpflichtet, in der Entwicklung jedes neuen oder für die Erweiterung der Serie eines bereits zugelassenen patentgeschützten Arzneimittels stets die pädiatrische Population mit einzubeziehen. Hierzu muss ein pädiatrisches Prüfkonzept (PIP) erstellt und abgearbeitet werden. Ausnahmen von der Verpflichtung sind möglich, z. B. wenn das betreffende Indikationsgebiet bei Kindern nicht relevant ist. Außerdem kann die Durchführung ganz oder teilweise zurückgestellt werden, wenn es hierdurch zu Verzögerungen bei der Zulassung für andere Bevölkerungsgruppen kommen könnte.
Nur wenige Prüfpläne abgeschlossen
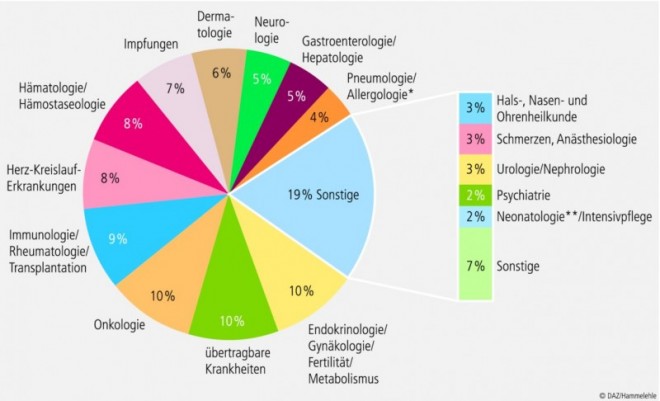
Bis Ende 2012 hatte die Europäische Arzneimittel-Agentur 600 pädiatrische Prüfkonzepte gebilligt, davon 453 für in der EU noch nicht zugelassene Arzneimittel. Sie decken ein breites Spektrum therapeutischer Bereiche ab (siehe Abbildung). Abgeschlossen waren bis Ende des letzten Jahres allerdings erst 33 Prüfkonzepte. Dies ist zum einen auf die langen Entwicklungszyklen von Arzneimitteln zurückzuführen, die häufig mehr als ein Jahrzehnt umfassen und zum anderen darauf, dass pädiatrische Studien in erheblich größerem Maßstab als ursprünglich erwartet zurückgestellt wurden. Bei den meisten Arzneimitteln waren die Forschungs- und Entwicklungsprogramme bereits vor dem Inkrafttreten der Verordnung gestartet worden. So konnte das Studienprogramm für Kinder nicht von Beginn an berücksichtigt werden. Insgesamt werden die pädiatrischen Prüfkonzepte aber mehrheitlich planmäßig umgesetzt.
Seit dem Inkrafttreten der Verordnung wurden 31 von 152 neuen Arzneimitteln für die pädiatrische Verwendung zugelassen. Außerdem wurden bis Ende 2011 72 neue pädiatrische Indikationen für bereits zugelassene Arzneimittel genehmigt sowie 26 neue Darreichungsformen für die pädiatrische Verwendung, darunter 18 angepasste Formen für zentral zugelassene Arzneimittel.
Mehr Kinder in klinischen Prüfungen
Bei den pädiatrischen Prüfungen ist insgesamt noch kein Anstieg abzulesen. Mit jährlich durchschnittlich 350 Prüfungen blieben die Zahlen zwischen 2006 und 2012 abgesehen von einigen Schwankungen konstant. Auch wegen der hohen Zahl an Zurückstellungen werden die Auswirkungen der Verordnung auf pädiatrische Prüfungen erst in den kommenden Jahren deutlicher zu erkennen sein, so interpretiert die Kommission.
Erfreulich ist jedoch der deutliche Anstieg der Probandenzahlen in Studien zwischen 2007 und 2012 von 313 auf knapp 40.000. (Säuglinge und Kleinkinder: von 21 auf 3141, Kinder: von 181 auf 20.677, Jugendliche: von 111 auf 13.191). Außerdem kommt die Forschung nun auch Neugeborenen zugute, die vor 2008 normalerweise gar nicht in Prüfungen einbezogen wurden (2012: 1712 Frühgeborene, 1172 Neugeborene).
Die "Juwelen" der Verordnung
Um die bereits bestehende Datenlage zur klinischen Forschung an Kindern transparenter zu machen, verpflichtete die Kinderarzneimittel-Verordnung die Unternehmen, der Zulassungsbehörde vorhandene und neu erzeugte pädiatrische Daten vorzulegen, damit die gewonnenen Erkenntnisse aufbereitet und gegebenenfalls in den Produktinformationen umgesetzt werden können. Seit 2008 wurden auf dieser Basis über 18.000 Studienberichte zu etwa 2200 Arzneimitteln eingereicht. Bei zentral zugelassenen Arzneimitteln hatte die Agentur die Bewertung der Daten zu 55 Wirkstoffen bis 2011 abgeschlossen. Die Zusammenfassung der Produktmerkmale wurde hiernach bei zwölf Arzneimitteln geändert.
Die Daten zu den auf nationaler Ebene zugelassenen Arzneimitteln werden von den Behörden der Mitgliedstaaten der EU in einem großen Arbeitsteilungsprojekt bewertet. Als Ergebnis wurden bislang Bewertungsberichte zu über 140 Wirkstoffen veröffentlicht. In 65 Fällen konnten entsprechende Zusatzinformationen zur Anwendung bei Kindern herausgefiltert werden. Angesichts dieser Erfolge bezeichnete die Kommission die zugrundeliegenden Artikel als die "verborgenen Juwelen" der Verordnung.
Nur eine PUMA
Als Anreiz zur Erforschung der potenziellen pädiatrischen Verwendung patentfreier Arzneimittel wurde als Novum im Zulassungs-Prozedere die Genehmigung für die pädiatrische Verwendung (PUMA, paediatric use marketing authorisation) eingeführt. Sie bietet acht Jahre Datenexklusivität und zehn Jahre Marktexklusivität für jedes neue patentfreie Produkt, das ausschließlich für die Verwendung in der pädiatrischen Bevölkerungsgruppe entwickelt wird. Das PUMA-Konzept ist allerdings den anfänglichen Erwartungen nicht gerecht geworden. Bislang wurde nur eine PUMA erteilt. Einige weitere Projekte sind in Arbeit.
Kein Kinder-Symbol
Auch die geplante Kennzeichnung von Arzneimitteln mit einer pädiatrischen Indikation mit einem bestimmten Symbol lässt noch auf sich warten. Der Pädiatrieausschuss befürchtet Missverständnisse bei Eltern oder Betreuern über die genaue Bedeutung eines solchen Symbols und hat der Europäischen Kommission daher bislang davon abgeraten, einen Beschluss hierzu zu fassen.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.