
- DAZ.online
- DAZ / AZ
- DAZ 15/2013
- Thyreotoxikose
Schilddrüse
Thyreotoxikose
Zwar werden in der klinischen Routine die Begriffe Thyreotoxikose und Hyperthyreose meist synonym verwendet, streng genommen besteht jedoch ein Unterschied:
Bei der Thyreotoxikose handelt es sich um eine Störung, die unabhängig von der Ursache durch erhöhte Serumspiegel der Schilddrüsenhormone Thyroxin (T4) und Triiodthyronin (T3) charakterisiert ist.
Bei der Hyperthyreose sind die T3-/T4-Serumspiegel infolge einer Erkrankung der Schilddrüse mit gesteigerter Hormonproduktion erhöht.
Eine Thyreotoxikose tritt etwa bei 2% der Frauen und bei 0,2% der Männer auf. Die Prävalenz steigt mit dem Alter – je nach Ursache bereits zwischen der zweiten und vierten Lebensdekade (bei Morbus Basedow) oder in höherem Alter (bei toxischer nodulärer Struma, vor allem in Iodmangelregionen).
Morbus Basedow als Autoimmunerkrankung
Wie Tabelle 1 zeigt, kann die Thyreotoxikose einerseits vielfältige Ursachen haben, muss aber andererseits nicht zwingend mit einer Hyperthyreose assoziiert sein. Bei den häufigsten Ursachen allerdings, bei Morbus Basedow, toxischer nodulärer Struma und autonomem Adenom, geht die Thyreotoxikose mit einer Hyperthyreose einher.
Tab. 1: Ursachen der Thyreotoxikose mit Pathomechanismen. | |
Häufige Ursachen |
Pathomechanismus |
Thyreotoxikose assoziiert mit Hyperthyreose
|
|
|
|
Thyreotoxikose nicht assoziiert mit Hyperthyreose
|
|
|
|
Weniger häufige bis seltene Ursachen |
Pathomechanismus |
Thyreotoxikose assoziiert mit Hyperthyreose
|
|
|
|
Thyreotoxikose nicht assoziiert mit Hyperthyreose
|
|
|
|
Die Basedow-Erkrankung (im angloamerikanischen Sprachraum Graves’ Disease) ist eine Autoimmunerkrankung. Die vom Körper gegen das Schilddrüsengewebe gebildeten Autoantikörper binden an den Rezeptor für das in der Hypophyse gebildete Thyreoidea-stimulierende Hormon (TSH). Durch die Stimulierung der Follikelepithelzellen der Schilddrüse kommt es zur erhöhten Iodaufnahme und nachfolgend zur vermehrten Synthese der Hormonvorstufe T4 und der biologisch aktiven Form T3. Bei Basedow-Patienten findet man meist eine diffuse symmetrische Vergrößerung der Schilddrüse, bei der Hälfte der Betroffenen auch eine positive Familienanamnese.
Eine autonome Überproduktion der Schilddrüsenhormone ist der Pathomechanismus beim benignen autonomen Schilddrüsenadenom und bei der toxischen nodulären Struma. Aus einem oder mehreren dieser autonomen Knoten entwickelt sich über subklinische Stadien allmählich eine manifeste Thyreotoxikose.
Entzündliche Ursachen
Bei einer Thyreoiditis wird aufgrund einer entzündlichen Zelldestruktion gebildetes Schilddrüsenhormon vermehrt in den Kreislauf freigesetzt.
Im Fall der schmerzhaften subakuten Thyreoiditis de Quervain handelt es sich um eine Erkrankung wahrscheinlich viraler Ätiologie. Etwa die Hälfte der Patienten zeigt Symptome einer Thyreotoxikose. Nach einigen Wochen entwickelt sich in den meisten Fällen eine Schilddrüsenunterfunktion, die sich jedoch fast immer wieder normalisiert.
Bei bis zu 10% aller Frauen tritt postpartal eine leichte schmerzlose Thyreoiditis auf. Hier handelt es sich um eine entzündliche Autoimmunstörung, die ein typisches Muster aufweist: Nach einer initialen Hyperthyreose kommt es zu einer Hypothyreose, bis sich bei den meisten Frauen nach sechs bis zwölf Monaten wieder eine Euthyreose einstellt.
Auch bei iatrogen exogener Zufuhr von Schilddrüsenhormonen entwickelt sich häufig eine Thyreotoxikose – zum einen bei therapeutisch hohen Dosen zur Verkleinerung oder Wachstumsbegrenzung eines Schilddrüsentumors, zum anderen bei unabsichtlicher Überdosierung. Die Thyreotoxicosis factitia wird in der Regel vom Patienten selbst verursacht, entweder durch eigenmächtige oder durch falsche Einnahme von Schilddrüsenhormon.
Vielfältiges Symptommuster
Je nach Ausprägung der Thyreotoxikose kann nahezu jedes Organsystem betroffen sein. Zu den gängigen Symptomen und Komplikationen der manifesten Thyreotoxikose gehören
Fatigue, Angst- und/oder Erregungszustände, Nervosität, Konzentrationsstörungen,
Muskelschwäche (oft M. quadriceps femoris), Hyperreflexie, Tremor,
Palpitationen, Belastungsdyspnoe, Tachykardie/‑arrhythmie, Vorhofflimmern,
Haarausfall, Hitzeunverträglichkeit, Schwitzen,
Gewichtsverlust trotz erhöhtem Appetit,
bei Frauen Zyklusstörungen und verminderte Fertilität, bei Männern Libidostörungen.
Zudem entwickelt sich bei Basedow-Patienten eine Ophthalmopathie, die gekennzeichnet ist durch hervorstehende Augen, periorbitale Schwellung und Entzündung des Weichteilgewebes sowie entzündliche Veränderungen in den äußeren Augenmuskeln, verbunden mit Diplopie und Muskel-Imbalance. Hervorgerufen werden die Effekte durch folgende Mechanismen:
Aufnahme von T3 durch spezifische Membrantransporter,
Interaktion von T3 mit Rezeptoren, die die Transkription vieler verschiedener Gene steuern,
Steigerung der β-adrenergen Rezeptoraktivität vor allem durch erhöhtes T3.
Erhöhtes kardiales Risiko
So sind die kardiovaskulären Symptome bei Thyreotoxikose von besonderer klinischer Bedeutung, zumal hier Tachykardien und supraventrikuläre Rhythmusstörungen häufig bei ansonsten herzgesunden Menschen auftreten. Daten aus den USA zeigen, dass bei 8,3% Patienten mit Thyreotoxikose bereits 30 Tage nach Diagnosestellung ein Vorhofflimmern – ein unabhängiger Prädiktor für Mortalität – festzustellen war. Weiterhin können der venöse Rückfluss, das Blutvolumen, die Kontraktilität und damit der kardiale Sauerstoffverbrauch inadäquat erhöht sein ("high output failure"). Studien aus England, Finnland und den USA legen nahe, dass die Thyreotoxikose nicht nur mit einer erhöhten kardiovaskulären Sterblichkeit einhergeht, sondern auch mit einer erhöhten Inzidenz an Embolien, Schlaganfällen und ischämischen Herzerkrankungen. Die eingeschränkte körperliche Leistungsfähigkeit bis zur Belastungsdyspnoe beruht in vielen Fällen nicht nur auf der kardiovaskulären Störung, sondern auch auf einer Muskelschwäche, die die Atemmuskulatur mitbetrifft. Im Allgemeinen korreliert die Schwere der Symptomatik mit der laborchemischen Ausprägung der Thyreotoxikose, allerdings zeigen ältere Menschen weniger die klassischen Zeichen als vielmehr die kardiovaskulären Komplikationen wie Vorhofflimmern.
TSH erniedrigt, f T4 erhöht
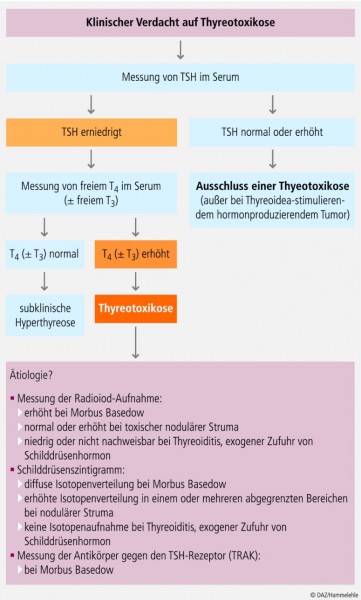
Bei allen Formen der manifesten Thyreotoxikose ist die Konzentration von Thyreoidea-stimulierendem Hormon (TSH) im Serum erniedrigt, während die Messwerte von freiem Thyroxin (f T4) und/oder freiem Triiodthyronin (f T3) erhöht sind. Als subklinische Thyreotoxikose wird eine persistent niedrige Serumkonzentration von TSH bei normalen f T3-/f T4-Werten definiert. Um differenzialdiagnostisch die Ursache zu klären, empfehlen sich Maßnahmen wie die Messung der Radioiod-Aufnahme bzw. der Antikörper gegen den TSH-Rezeptor (TRAK) sowie ein Schilddrüsenszintigramm (s. Abb. 1).
In Europa Pharmakotherapie bevorzugt
Zur Therapie der Thyreotoxikose können drei Wege beschritten werden:
medikamentös mit Thyreostatika,
nuklearmedizinisch als Radioiod-Therapie und
chirurgisch, zumeist als Thyreoidektomie.
In Europa und Japan wird weitgehend die Gabe von Thyreostatika bevorzugt, in den USA die Radioiod-Therapie, allerdings mit steigendem Trend zugunsten der medikamentösen Intervention. Zur Anwendung kommen in der Regel die Thionamide Carbimazol, sein aktiver Metabolit Thiamazol (= Methimazol) sowie Propylthiouracil. Alle Thionamide vermindern die Synthese von Schilddrüsenhormon, indem sie die Oxidation von Iodid zu elementarem Iod und als Folge den Einbau von Iod in die Thyrosylreste des Thyreoglobulins sowie deren Kombination zu T3 bzw. T4 verhindern.
Thyreostatika können langfristig mit dem Ziel einer dauerhaften Remission angewendet werden, etwa bei Morbus Basedow. Bei toxischer nodulärer Struma sind sie nur kurzfristig zur Einstellung einer Euthyreose vor der definitiven chirurgischen oder Radioiod-Behandlung indiziert.
Zur Therapie einer Thyreoiditis ohne exzessive Produktion von Schilddrüsenhormonen dürfen Thionamide nicht eingesetzt werden.
Achtung bei Amiodaron!Amiodaron, ein potentes Antiarrhythmikum mit komplexem Wirkmechanismus, ist in Deutschland zur Bekämpfung von schwerwiegenden tachykarden supraventrikulären (z. B. Tachykardie bei WPW-Syndrom, paroxysmales Vorhofflimmern) und ventrikulären Herzrhythmusstörungen zugelassen. Wegen des hohen Iodgehaltes der Substanz (37%) kommt es häufig zu Schilddrüsenfunktionsstörungen. In sechs bis zehn Prozent der Fälle entwickelt sich eine Thyreotoxikose, die mit einer Verdoppelung kardiovaskulärer Zwischenfälle assoziiert ist. Zwei Typen der Amiodaron-induzierten Thyreotoxikose (AIT) lassen sich unterscheiden:
| |||||||||||||||||||||||||||||
Selten, aber gefürchtet: Agranulozytose
Die empfohlene Startdosierung von Carbimazol und Thiamazol beträgt 10 – 20 mg einmal täglich, von Propylthiouracil 50 – 100 mg zweimal täglich. Unter diesem Regime normalisieren sich die T4-Serumspiegel bei den meisten Patienten in acht bis zwölf Wochen. Die Schilddrüsenfunktion sollte initial alle vier bis sechs Wochen überprüft werden, nach Reduktion auf eine Carbimazol-/Thiamazol-Erhaltungsdosis von 5 – 10 mg täglich genügt ein Monitoring-Intervall von zwei bis drei Monaten. Unerwünschte Effekte unter Thionamiden zeigen sich bei rund 3% der behandelten Patienten, sind aber meist vorübergehend und gering ausgeprägt (s. Tab. 2). Gefürchtet bei allen drei Substanzen ist – unabhängig von Dosierung und Therapiedauer – eine Agranulozytose in etwa 0,2 bis 0,5% der Fälle. Propylthiouracil kann sehr selten zu einem toxischen fulminanten Leberversagen führen, dann allerdings eher bei Kindern. Experten warnen daher zunehmend davor, Propylthiouracil als First-line-Medikament einzusetzen.
Tab. 2: Mögliche unerwünschte Wirkungen von Thionamid-Thyreostatika | |
Carbimazol/Thiamazol |
Propylthiouracil |
|
Agranulozytose (0,2 – 0,5%)
Aplastische Anämie
Thrombozytopenie
Cholestatische Hepatitis
Hypoglykämie
Missbildungen, z. B. Choanalatresie
|
Agranulozytose (0,2 – 0,5%)
Aplastische Anämie
Thrombozytopenie
Toxische Hepatitis und fulminantes Leberversagen
Antineutrophil-zytoplasmatische-Antikörper-positive Vaskulitis
Lupus-erythematodes-ähnliche Symptome
Hypoprothrombinämie
|
Außerdem: Urtikaria; Arthralgien, Arthritis; Fieber; passagere Granulozytopenie; Übelkeit und Erbrechen; Störung der Geruchs- und Geschmacksempfindung | |
Wenn Thionamide bei Morbus Basedow mit dem Therapieziel angewendet werden, eine Remission zu induzieren, ist eine Behandlungsdauer – wie auf der Basis von vier randomisierten Studien nachgewiesen wurde – von 12 bis 18 Monaten optimal. Eine Verlängerung der Therapie ging nicht mit einer Verbesserung der Remissionsrate einher. Insgesamt kommt es nur bei etwa 50% aller Basedow-Patienten zu einer Langzeitremission. Faktoren, die für eine eher geringe Remissionsrate sprechen, umfassen eine starke biochemische Ausprägung der Erkrankung, männliches Geschlecht, Lebensalter unter 40 Jahren, große Strumen, Nicotinabusus und hohe Konzentrationen von TSH-Rezeptor-Antikörpern.
Unerwünschte Hypothyreose durch Radioiod
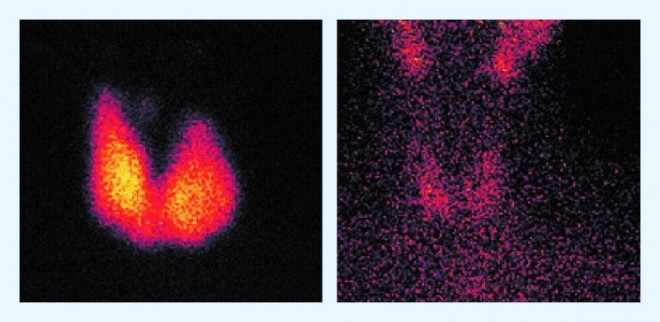
Eine Radioiod-Behandlung ist indiziert bei toxischer multinodulärer Struma und bei der Basedow-Erkrankung, sowohl neu diagnostiziert als auch rezidivierend. Eingesetzt wird das radioaktive Isotop Iod‑131 (131I), das im menschlichen Körper nur in Schilddrüsenzellen gespeichert wird. In Deutschland darf die Radioiod-Therapie nur stationär durchgeführt werden. Kontraindikationen sind Schwangerschaft oder Stillzeit, Kinderwunsch innerhalb der nächsten sechs Monate und die (Verdachts-)Diagnose eines Schilddrüsenkarzinoms. Retrospektive Daten zeigen, dass 80 bis 90% der Patienten nach einer einzigen Behandlung mit Iod‑131 innerhalb von acht Wochen eine euthyreote Stoffwechsellage erreichen (s. Abb. 2).
Langfristig verursacht die Radioiod-Behandlung allerdings bei mehr als 60% der Patienten eine Hypothyreose, auch wenn es aufgrund des Austritts von zuvor produziertem Schilddrüsenhormon aus dem geschädigten Organ zunächst zu einer Verstärkung der Thyreotoxikose kommt.
Behandlung der Ophthalmopathie
Eine Basedow-Ophthalmopathie kann sich durch die Behandlung mit Iod‑131 entwickeln oder verschlimmern, vor allem bei Rauchern oder Patienten mit schwerer Hyperthyreose. Hier kann eine Steroidprophylaxe die Progression der Ophthalmopathie verhindern.
Im Gegensatz zur Radioiod-Therapie nimmt die Basedow-Ophthalmopathie bei chirurgischer Entfernung der Schilddrüse (Thyreoidektomie) nicht zu. Weiterhin wird die Hyperthyreose durch den Eingriff rasch und in mehr als 90% der Fälle beseitigt. OP-Indikationen sind große Strumen, schwere Ophthalmopathie, Schwangerschaft und Rückfall nach medikamentöser Therapie bzw. deren schwere Nebenwirkungen. Analog zur Radioiod-Therapie sollte mit Thyreostatika eine präoperative Euthyreose erzielt werden.
Auch die Thyreoidektomie führt bei den meisten Patienten zu einer permanenten Hypothyreose; als OP-Komplikation droht zudem die Schädigung des Nervus laryngeus recurrens.
Thyreotoxikose und Schwangerschaft
Physiologischerweise kommt es in der Schwangerschaft zu folgenden Interferenzen mit der Schilddrüsenfunktion:
Iodmangel aufgrund erhöhter Iodclearance,
TSH-stimulierende Wirkung des Choriongonadotropin (hCG),
Anstieg des Thyroxin-bindenden Globulins (TBG).
Obwohl die Konzentration der Gesamthormone infolgedessen ansteigt, bleiben die freien Hormonkonzentrationen von Tyroxin und Triiodthyronin (f T3 und f T4) zumeist unbeeinflusst. Das TSH ist vor allem im ersten Trimenon erniedrigt.
In rund 0,2% der Schwangerschaften kommt es zu einer Thyreotoxikose, wobei in der Regel ein Morbus Basedow besteht. Die Frauen leiden unter Tachykardien, Hitzeintoleranz, Gewichtsabnahme und vor allem im ersten Trimenon unter starkem Erbrechen (Hyperemesis gravidarum). Auch hier lassen sich laborchemisch erniedrigte Werte des TSH und des TSH-Rezeptor-Antikörpers (TRAK) nachweisen, während f T3 und f T4 gegenüber den trimenonspezifischen Referenzbereichen erhöht sind. Der Krankheitsverlauf erfährt im zweiten und dritten Trimenon eine Besserung, da die Schwangerschaft zu einer gewissen Immunsuppression führt, die sich auch in einem Rückgang der TRAK niederschlägt.
Dennoch birgt eine unbehandelte Schwangerschaftsthyreotoxikose ein deutlich erhöhtes Risiko fetaler Missbildungen oder einer fetalen Struma, sowie für Komplikationen wie Eklampsie oder Frühgeburt. Aufgrund der diaplanzentaren Passage von Thyreostatika besteht die Gefahr einer fetalen Hypothyreose, sodass erstens eine Monotherapie und zweitens diese in der niedrigsten effektiven Dosis angestrebt werden sollte. In Fallbeschreibungen wurden verschiedene Missbildungen wie Choanalatresie, ösophageale Atresie, mentale sowie motorische Entwicklungsverzögerungen mit hohen Thiamazol-Dosen in Verbindung gebracht. Daher wird für die Anwendung in der Frühschwangerschaft häufig Propylthiouracil empfohlen, obwohl hierfür keine sichere Evidenz besteht.
Von der Thyreotoxikose ist die transiente Schwangerschaftshyperthyreose abzugrenzen. Hierbei handelt es sich um eine Form der Hyperthyreose bei Frauen ohne Autoimmunerkrankung mit Nachweis von TRAK. Die Ursache liegt in erhöhten hCG-Werten vor allem in der Frühschwangerschaft; laborchemisch ist zudem eine Suppression von TSH bei erhöhtem f T4 festzustellen, wobei klinisch die Hyperemesis gravidarum mit dem Ausmaß der pathologischen Serumspiegel korreliert. In der Regel hat die Störung keinen negativen Einfluss auf den Schwangerschaftsverlauf. Mit dem Rückgang der hCG-Werte normalisieren sich auch die Werte des f T4, sodass hier normalerweise keine thyreostatische Therapie erforderlich ist.
LiteraturFranklyn JA, Boelaert K. Thyrotoxicosis. Lancet online 2012. doi:10.1016/S0140-6736(11)60782-4. Pearce EN. Diagnosis and management of thyrotoxicosis. Br Med J 2006; 332: 1369– 1373. Hintze G, Fink H. Aktuelle Schilddrüsendiagnostik und -therapie bei Fertilitätsstörungen und Schwangerschaft. Wissenschaft und Praxis 2004; 12: 576-578. Kahaly GJ, et al. Amiodaron und Schilddrüsendysfunktion. Dtsch Arztebl 2007; 104(51– 52): A-3550/B-3129/C-3021.
Autor
DAZ 2013, Nr. 15, S. 50





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.