
- DAZ.online
- DAZ / AZ
- DAZ 8/2012
- Wirkort Gehirn
Technologie
Wirkort Gehirn
Wie Arzneistoffe die Blut-Hirn-Schranke überwinden können
Parkinson- und Alzheimer-Erkrankung, Hirninfarkt, Gehirntumoren, zerebrale Infektionen, multiple Sklerose und Huntington-Krankheit sind Erkrankungen des zentralen Nervensystems (ZNS), die aufgrund unserer erhöhten Lebenserwartung auf dem Vormarsch sind. Ein Fünftel aller Menschen leidet bereits unter derartigen Erkrankungen. Schätzungen zufolge wird im Jahr 2020 eine halbe Billion US-Dollar allein zur Therapie von Demenzen aufgewendet werden müssen. Der Markt für Therapeutika zur Behandlung von ZNS-Erkrankungen erscheint riesig. Trotzdem ist die Zahl der für diese Indikationen zugelassenen Arzneimittel überraschend klein. Lediglich für Depressionen, chronische Schmerzzustände und Epilepsien gibt es bisher zufriedenstellende Behandlungsmöglichkeiten.
BHS in ZahlenAnzahl der Kapillaren: 100 Milliarden Gesamtlänge: 600 bis 650 km Oberfläche: 15 bis 30 m2 Blutfluss: 610 ml/min Mittlerer Blutdruck: 15 bis 35 mmHg Abstand zwischen Kapillaren: 40 bis 50 µm Intraendotheliales Volumen: 5 ml (4 µl/g) Dicke einer Endothelzelle: 200 nm Mittlere Passagezeit: 5 Sekunden |
Der Aufbau der Blut-Hirn-Schranke: Cheddar statt Schweizer Käse
Die Blut-Hirn-Schranke (BHS) ist eine aus Endothelzellen (Abb. 1) bestehende Grenzfläche, die den Stoffaustausch von Nährstoffen, Krankheitserregern, Botenstoffen, Xenobiotika, Toxinen, aber auch Arzneistoffen zwischen dem ZNS und der Peripherie sehr selektiv kontrolliert. Die Barrierefunktion der BHS setzt sich aus verschiedenen Teilaspekten zusammen:
1. morphologische Barrierefunktion
2. metabolische oder biochemische Barrierefunktion,
3. Fehlen eines ausgeprägten Vesikeltransports
(1 – 3: passive Barriere) sowie
4. Limitierung von Transportprozessen auf spezifische Transporter (aktive Barriere).
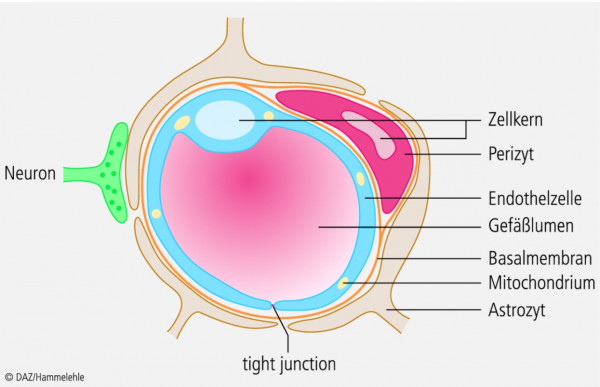
Der Aufbau der zerebralen Kapillaren unterscheidet sich beträchtlich von dem peripherer Blutgefäße und ermöglicht damit die speziellen Eigenschaften der BHS (Abb. 2).
"The walls of capillaries in peripheral tissues are like Swiss cheese, whereas the walls of capillaries in the brain are like cheddar cheese”, konstatierte William Pardridge, einer der wichtigsten BHS-Spezialisten.
Die zerebralen Kapillaren sind von einem kontinuierlichen Endothel (keine Fenestrierungen, keine Intrazellularspalten) ausgekleidet, das durch eine Basalmembran vollständig gegen das umliegende Nerven- und Bindegewebe abgegrenzt ist. Auch die seitlich angelagerten Perizyten, die auf ca. 20% der äußeren Endotheloberfläche verankert sind, sind von der Basalmembran umgeben. Als Aufgabe der Perizyten wird diskutiert: kontraktiles Element zur lokalen Blutdruckregulation, Makrophagen-Aktivität mit Beitrag zum Immunsystem des ZNS sowie Regulation von Mitose, Differenzierung und Phänotyp der Endothelzellen.
Die Endothelzellen sind zu 99% von Astrozyten (Sternzellen) hüllenartig umgeben, die über perivaskuläre Endfüße mit ihnen in Kontakt treten. Obwohl sich die ursprüngliche Annahme, dass die Astrozyten die eigentliche BHS darstellen, nicht bestätigt hat, haben sie doch einen entscheidenden Einfluss auf die Eigenschaften der Endothelzellen, denn sie beeinflussen Phänotyp, Differenzierung und Erhaltung der Endothelzellen sowie Dichtigkeit, Polarität und Enzymausstattung der Endothelzellschicht. Die eigentlichen Aufgaben der Astrozyten sind jedoch: Nährstoffversorgung der Neuronen, Produktion von Cholesterol, welches selbst die BHS nicht passieren kann, und Aufrechterhaltung der extrazellulären Ionenkonzentration.
Entscheidend für die morphologische Barrierefunktion der Endothelzellen sind die tight junctions oder Zonulae occludentes, ihre feste Verbindung durch Transmembranproteine (Occludin, Claudine etc.). Sie schränken den parazellulären Übertritt von Stoffen sehr stark ein und erhalten damit die Zellpolarität aufrecht. Sie werden auch als Ursache für den hohen transendothelialen elektrischen Widerstand (TEER, 900 – 2000 Ohm/cm2) im Gehirn angesehen (TEER in der Peripherie: 5 – 10 Ohm/cm2).
Aufgrund seiner im Vergleich zur Peripherie hohen enzymatischen Ausstattung und metabolischen Aktivität fungiert das Endothel der zerebralen Kapillaren auch als biochemische Schranke. Eine Vielzahl von Enzymen, die für den Phase 1- und Phase 2-Metabolismus in der Leber bekannt sind, ist in ihnen nachweisbar. Beispiele sind γ-Glutamyltransferase, alkalische Phosphatase, Monoaminoxidase, Cytochrom-P450-Enzyme und Catechol-O-Methyltransferase.
Auch die etwa fünffach höhere Konzentration an Mitochondrien in den Endothelzellen weist auf eine höhere metabolische Kapazität als in peripheren Kapillaren hin; sie ist allerdings auch ein Hinweis auf den hohen Energiebedarf der aktiven Transportprozesse.
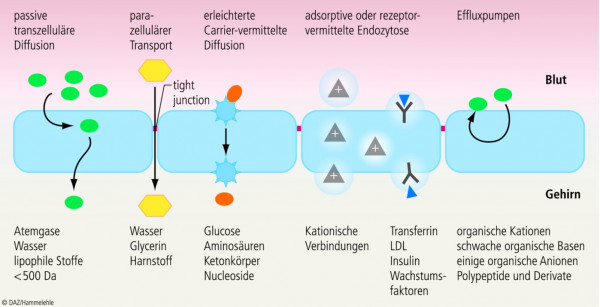
Die Blut-Hirn-Schranke weist verschiedene membranäre Transportprozesse auf, die sowohl die Homöostase und die Versorgung des Gehirns als auch den Abtransport von Stoffwechselprodukten gewährleisten (Abb. 3). Im Vergleich zur Peripherie sind diese Systeme äußerst selektiv auf die vom Gehirn benötigten bzw. zu eliminierenden Substanzen beschränkt. Passive Diffusion und parazellulärer Transport spielen nur eine geringe Rolle (Wasser, Glycerin, Harnstoff); aktive, selektiv steuerbare Transportsysteme überwiegen und tragen zur Polarität der BHS bei. Pinozytotische Transportprozesse sind im zerebralen Endothel kaum anzutreffen. ATP-getriebene Effluxpumpen (P-Glykoprotein u. a.), die auf der blutständigen, luminalen Seite der Endothelzellen lokalisiert sind, transportieren eine Vielzahl von Xenobiotika zurück in die Blutbahn.
Wirkstofftransport durch die BHS
Auch für den Transport von Wirkstoffen stellt die BHS ein Hindernis dar. Durchlässig wird sie nur bei verschiedenen Krankheitszuständen wie Traumata, Infektionen und Entzündungen, hohem Fieber, Vergiftungen, Hypoxidosen und einigen Arten von Tumoren. Nur ca. 2% aller "small molecules" mit Molekularmassen < 400 bis 500 Dalton und lipophilem Charakter können die BHS überwinden. Alkohol, Coffein, Nicotin und einige Antidepressiva gehören dazu. Die Anzahl der Wasserstoffbrücken ist dabei invers proportional zum BHS-Transport. Zudem nimmt die Wirkstoffpermeation exponenziell mit dem Anstieg der Molekularmasse ab. Kleine lipophile Moleküle überwinden mit einer Art "hitch hiking" ("per Anhalter fahren") die BHS: Die langen Fettsäurenketten der Phospholipid-Doppelschicht verursachen durch ständige Konformationsänderungen sogenannte "kinks" (Knicke) und sehr kurzlebige kleine Hohlräume in der Membran, in die die kleinen Moleküle hineinpassen; diese wandern gewissermaßen von Hohlraum zu Hohlraum. Allen größeren Molekülen bleibt jedoch der Übertritt verwehrt. Insbesondere innovative Arzneistoffe wie monoklonale Antikörper, rekombinante Proteine oder therapeutische DNA und RNA passieren die BHS nicht.
Das Verständnis der zellulären Anatomie und Physiologie der BHS haben zur Entwicklung zahlreicher innovativer Drug-Delivery-Strategien über die BHS geführt. Diese lassen sich einteilen in
invasive Methoden, die die BHS umgehen,
Methoden, die auf der Öffnung der BHS beruhen, und
Mechanismen und Methoden zur direkten Passage der BHS.
Invasive Methoden zur Umgehung der BHS
Die invasiven, sogenannten transkranialen Methoden umfassen
die intrazerebrale (i.c.) Applikation,
die intrazerebroventrikuläre (i.c.v.) Applikation sowie
das convection-enhanced delivery (CED).
Sie erfordern meist einen aufwendigen chirurgischen Eingriff in das Gehirn und sind nicht zuletzt wegen der Infektions- und Verletzungsgefahr bedenklich. Substanzen, die i.c. appliziert werden (z. B. nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF), Zytokine), verweilen größtenteils am Applikationsort und weisen meist nur einen kleinen Diffusionsradius mit inhomogener Wirkstoffverteilung entlang eines Konzentrationsgefälles auf. Die Konzentration eines Wirkstoffs nimmt dabei logarithmisch mit jedem Millimeter Hirngewebe ab (90% bei 0,5 mm). Den i.c.v. applizierten Stoffen bleibt nur wenig Zeit, um in den Gewebebereich zu diffundieren und tiefer liegende Strukturen zu erreichen, da der Liquor eine sehr hohe Flussrate besitzt und mehrmals täglich vollständig ausgetauscht wird.
Eine Vergrößerung des Diffusionsradius lässt sich mittels CED erreichen. Dabei werden ein oder mehrere Katheter stereotaktisch über eine Öffnung im Schädel in das Gehirnparenchym eingebracht und die Substanzen mithilfe einer Mikropumpe infundiert. Mittels eines Druckgradienten, der an der Spitze des Infusionskatheters entsteht, wird die Substanz gleichmäßiger und über ein größeres Areal als bei der einfachen Diffusion in den Extrazellularraum gepumpt. Die Wirkstoffkonzentration ist dabei unabhängig von Infusionsrate und Infusionsdauer. Die Wirkstoffverteilung ist eine Funktion des hydrostatischen Drucks der Infusion, kombiniert mit Diffusion in das umliegende Gewebe.
Angewandt wurde diese Methode bisher nur in präklinischen und wenigen klinischen Studien, z. B. zur Behandlung von Glioblastompatienten mit antineoplastischen Substanzen, Toxinen und Oligonucleotiden. Zahlreiche Nebenwirkungen lassen die Frage nach Langzeiteffekten dieser Technik aufkommen. Alternativen sind Implantationen von Reservoiren (z. B. Ommaya) oder Pumpen direkt unter der Kopfhaut, die bei Schmerz- und Tumorpatienten sowie Spastikern angewendet werden.
Vor allem zur Behandlung von Tumoren werden bioabbaubare Implantate wie Wafer, Pellets oder Partikel direkt in das Hirngewebe eingebracht, die den Vorteil einer hohen lokalen Bioverfügbarkeit der Wirkstoffe bei geringer systemischer Toxizität aufweisen. Die bereits kommerziell erhältlichen Gliadel® Wafer bestehen aus einer bioabbaubaren Polyanhydrid-Matrix, in die Carmustin (BCNU) eingebettet ist; sie werden nach der Entfernung eines Hirntumors in die Tumorhöhle implantiert. Der Wirkstoff wird durch eine Kombination von Diffusion und Polymererosion (Hydrolyse der Polyanhydride) freigesetzt. In der Entwicklung befinden sich Implantate mit neuroaktiven Mikrosphären aus bioabbaubarem Poly(D,L-lactid-co-glycolid) sowie mit Zellen, die in poröse Membranen eingekapselt sind und Neurotransmitter freisetzen (bioartificial molecular delivery system). Parkinsonkranken und chronischen Schmerzpatienten soll damit geholfen werden.
Methoden zur Öffnung der Barrierenfunktion
Das therapeutische Öffnen der BHS durch die Infusion von vasoaktiven Substanzen in die Arteria carotis interna unmittelbar vor der Wirkstoffapplikation ist ein reversibler Prozess, der etwa 10 bis 120 Minuten anhält. Es macht die tight junctions durchlässig und ermöglicht einen parazellulären Transport von Wirkstoffen (Abb. 3). Hyperosmolare Lösungen (meist 2 M) osmotisch aktiver Substanzen wie Mannitol und Arabinose führen bereits nach 30 Sekunden zu einem Flüssigkeitsverlust und Schrumpfen der Endothelzellen sowie durch die Zugkraft der schrumpfenden Zellen zur Öffnung der tight junctions. Unerwünschte Nebenwirkungen können schwere Vaskulopathien, chronische Neuropathien und Krämpfe sein. Blutplasma kann unkontrolliert das Hirngewebe erreichen, wo beispielsweise Albumin als Hauptbestandteil des Plasmas toxisch wirken kann. Damit ein parazellulärer Transport möglich ist, sollte der hydrodynamische Durchmesser der zu transportierenden Wirkstoffe (Peptide, Enzyme, Chemotherapeutika) kleiner als 20 nm sein.
Bei der sogenannten chemischen Modifikation der BHS führen hochdosierte Lösungsmittel und Tenside (Glycerin, Ethanol, Dimethylsulfoxid, Natriumdodecylsulfat, Tween 80, PEG-hydroxystearat) vermutlich zur Destabilisierung der Endothelzellmembran, die die transzelluläre Diffusion von Wirkstoffen erleichtert. Kytorphin, ein dipeptidisches Analgetikum, kann beispielsweise die BHS bei gleichzeitiger Gabe von Tween 80 passieren. Alkylglycerole können im millimolaren Bereich Verbindungen wie Gentamicin und Methotrexat die Passage der BHS erleichtern.
Enterotoxine von Vibrio cholerae und Clostridium perfringens fungieren als Modulatoren der tight junctions durch Bildung eines Zonula-occludens-Toxins, welches über nachfolgende Signalkaskaden den Abbau von tight junctions induziert und die Durchlässigkeit der Endothelschicht erhöht. Vasoaktive Agenzien wie z. B. Bradykinin binden an die endothelialen luminalen B2-Rezeptoren und öffnen ebenfalls die Verschlusskontakte. RPM-7, ein Bradykinin-Analogon, konnte so die Permeabilität von Chemotherapeutika über die BHS erhöhen. Durch die Kombination von fokussiertem Ultraschall (10 – 1000 W/cm2) mit Mikrobläschen (2 – 4 µm) kann die BHS in einem sehr selektiven Areal geöffnet werden, ohne Nebenwirkungen wie Apoptose oder Ischämie, Gewebeüberhitzung oder Langzeitschädigungen auszulösen, die bei der Anwendung von hochintensivem fokussiertem Ultraschall (4 kW/cm2) bekannt sind. Durch Oszillation der Mikrobläschen im Ultraschallfeld werden vermutlich Mikroströmungen und damit Scherkräfte erzeugt, die zur Durchlässigkeit der BHS führen. Wirkstoffe wie Doxorubicin und Trastuzumab konnten auf diese Weise transportiert werden. Weitere, eher selten beschriebene und therapeutisch wenig relevante Öffnungsmethoden sind ein stark saurer pH-Wert in der Arteria carotis, tiefe Temperaturen oder hohe Konzentrationen freier Fettsäuren.
Alle invasiven Techniken und Öffnungsmethoden sind technisch schwierig auszuführen. Einfacher erscheinen hingegen Methoden, die auf Veränderungen der zu applizierenden Substanzen beruhen.
"Hitch-hiking"
Bestimmte lipophil modifizierte Wirkstoffe können durch passive transzelluläre Diffusion die BHS passieren und danach im Gehirn zum aktiven Wirkstoff metabolisiert werden. Das wohl bekannteste Beispiel ist die Diacetylierung von Morphin zu Diamorphin (Heroin), die zu einer bis zu 25-fach höheren Anreicherung von Heroin im Gehirn führt. Entsprechende Effekte sind auch beobachtet worden bei Cyclisierungen von Verbindungen oder der Bildung von Diketopiperazinen. Ursache ist in allen Fällen ein Verlust der Fähigkeit, Wasserstoffbrückenbindungen auszubilden. Allerdings erhöht die Umwandlung einer wasserlöslichen Substanz zu einem lipidlöslichen Prodrug meistens die Molekularmasse, was bei einem Überschreiten der oben diskutierten Grenze von 400 bis 500 Dalton problematisch ist. Zudem werden lipophile Prodrugs wesentlich schlechter im Blut transportiert als hydrophile Substanzen und werden somit auch leichter in periphere Zellen aufgenommen. Nur wenige Konzepte wurden bisher mit dieser Technik erfolgreich realisiert.
Nutzung von vorhandenen Transportern
Selektiver gestaltet sich die Nutzung der rezeptorvermittelten Endozytose für den Arzneistofftransport, die voraussetzt, dass der Arzneistoff die Struktur des endogenen Liganden an einem Rezeptor der BHS imitiert. Dieses Konzept wurde z. B. für Levodopa zur Behandlung der Parkinson-Erkrankung realisiert; es gelangt über den LAT1 (L-type amino acid transporter 1)-Rezeptor ins Gehirn, wo es zu Dopamin (das die BHS passieren kann) verstoffwechselt wird. Mit Phenylalanin derivatisiertes Melphalan zur Therapie von Hirntumoren, das Antisympathotonikum α-Methyldopa und das Antiepileptikum Gabapentin können ebenfalls mithilfe ähnlicher Transporter die BHS passieren.
Trojanische Pferde
Sind die Wirkstoffe selbst nicht in der Lage, an Rezeptoren des Endothels zu binden, dann können "Trojanische Pferde" verwendet werden. Solche Systeme entstehen durch die kovalente Kopplung eines nicht transportierbaren Wirkstoffs mithilfe eines Linkers an einen transportierbaren Stoff (Vektor). Alle Teile müssen bestimmte Bedingungen erfüllen: Während der Vektor zuständig ist für die Gehirnspezifität und eine günstige Pharmakokinetik, bestimmt der Linker die Kopplungsrate (und ggf. Entkopplungsrate) und der Wirkstoff natürlich die Wirkung am Wirkort. "Trojanische Pferde" werden aus der Blutbahn in die Endothelzellen endozytiert und auf der Rückseite in den Liquor des Gehirns exozytiert. Dann wird der Wirkstoff z. B. enzymatisch vom Vektor getrennt und kann den gewünschten pharmakologischen Effekt auslösen.
Verbindungen können entweder durch adsorptive oder rezeptorvermittelte Endozytose aufgenommen werden, je nachdem, ob die Aufnahme über elektrostatische Wechselwirkungen mit Ladungen auf der Membranoberfläche oder durch die Bindung an einen Rezeptor erfolgt. Adsorptive Vektoren sind beispielsweise kationische Verbindungen wie kationisiertes Albumin, kationische Polymere (Poly-L-Lysin, Polyethylenimin), natürliche Polyamine (Spermin, Spermidin, Putrescin) oder Lectine (WGA, RCA-1, Con-A, PSA), Leptin und Immunglobuline, während Insulin, IGF, Low Density Lipoprotein (LDL), Transferrin und monoklonale Antikörper, die direkt gegen die Rezeptoren gerichtet sind, rezeptorvermittelt aufgenommen werden. Die rezeptorvermittelte Aufnahme ist zwar selektiver als die adsorptive, hat jedoch den Nachteil, dass die Kapazität der Rezeptoren und damit die transportierbare Wirkstoffmenge in der Regel geringer sind. Die Kationisierung, die für die elektrostatische Wechselwirkung mit der negativ geladenen Endothelzellmembran verantwortlich ist, birgt bei systemischer Applikation das Risiko einer erhöhten Aufnahme in Leber und Nieren sowie das Risiko einer erhöhten Zytotoxizität.
Nanopartikel
Nanopartikel, die eine Größe von 1 bis 100 nm aufweisen, sind per se kaum in der Lage, die BHS zu passieren. Aber durch Oberflächenfunktionalisierungen (z. B. mit Polysorbat 80 oder Poloxameren) können Nanopartikel aus Polylactid, Polylactid-co-glycolid oder Polybutylcyanoacrylat – und mit ihnen Arzneistoffe wie Doxorubicin, Loperamid, Tubocurarin und Dalargin – in das Gehirn transportiert werden. Dabei kommen mehrere Mechanismen infrage: Erhöhung des Konzentrationsgradienten durch Adsorption der Nanopartikel an die Hirnkapillaren, Hemmung der Effluxpumpen durch z. B. Polysorbat 80, Öffnung der tight junctions und ein rezeptorvermittelter Transport, indem das Polymer zuerst adsorptiv an Apolipoprotein B oder E bindet und dieser Komplex dann an den BHS-eigenen LDL-Rezeptor bindet.
Weiterhin konnten mit PEG modifizierte Hexadecylcyanoacrylat-Nanosphären im Gliosarkom (Hirntumor) von Ratten angereichert werden. Feste Lipid-Nanopartikel (SLN), die mit Eisenoxid beladen wurden, waren nach systemischer Injektion in Ratten im Hirngewebe nachweisbar. Nanopartikuläre Systeme, die durch elektrostatische Wechselwirkung zwischen negativ geladenen Oligonucleotiden und kationischen Polymeren wie Polyethylenimin hergestellt wurden, konnten DNA durch Kopplung an einen anti-Transferrin-Antikörper selektiv über die BHS transportieren. Mit DNA beladene Nanogele aus quervernetztem PEG und kationischem Polyethylenimin zeigten bereits nach einer Stunde im Vergleich zu freier DNA eine 15-mal höhere Anreicherung der DNA im Hirn.
Liposomen
Polare Verbindungen können nicht nur in Polymere, sondern auch in Lipidkomponenten eingebaut werden. Die so entstehenden Liposomen werden zwar in das Hirngewebe aufgenommen, aber in geringerem Maße als von Leber und Milz. Verbessern lässt sich die Aufnahme in das Gehirn durch die gleichzeitige Gabe von hyperosmolarem Mannitol. Mit Immunoliposomen kann die Aufnahme selektiver gestaltet werden. Diese entstehen durch Kopplung eines Antikörpers als "Trojanisches Pferd" an ein Liposom und haben eine höhere Spezifität zum Zielgewebe. So wurden Tyrosinhydroxylase(TH)-exprimierende Plasmide mittels PEGylierten Immunoliposomen, die an anti-Transferrin-Rezeptor-Antikörper gekoppelt waren, in das Striatum von Parkinson-kranken Ratten eingebracht, wo sie die TH-Expression steigerten. Ferner wurde die Überlebenszeit von Ratten mit Hirntumor deutlich verlängert, indem sie mithilfe dieser Technik Plasmide erhielten, die im Hirn die short-hairpin-RNA gegen den humanen EGF-Rezeptor produzieren.
Nasale Applikation
Auch bei nasaler Applikation können bestimmte Arzneistoffe (Insulin, Enkephaline, Neurotrophine, Zytokine, DNA, Neuropeptide, Stammzellen) in das Hirngewebe gelangen. Dabei gelten die gleichen Voraussetzungen bezüglich Molekularmasse und Lipophilie wie für den BHS-Transport nach intravenöser Applikation. Versuche, lipophile Verbindungen wie Progesteron in Form von Sprays intranasal zu verabreichen, sind bereits dokumentiert. Dabei dringen die Moleküle (sehr wahrscheinlich) über den Riechnerv in das ZNS ein. Allerdings werden nur sehr geringe Mengen transportiert, sodass diese Methode von anderen Methoden in den Hintergrund gedrängt worden ist.
Hemmung von P-Glykoprotein
P-Glykoprotein, eine der ATP-abhängigen Effluxpumpen, befördert viele Chemotherapeutika, Immunsuppressiva, Antibiotika, Calciumkanal-Blocker und HIV-Proteaseinhibitoren, die in die Endothelzellen eingedrungen sind, entgegen dem Konzentrationsgefälle wieder zurück in die Blutbahn und verhindert damit ihren Übertritt ins Gehirn. Durch die gleichzeitige Gabe von Efflux-Inhibitoren wie Verapamil, Procyanidinen oder Ciclosporin als Co-Drugs lässt sich der Efflux deutlich reduzieren. Allerdings weisen diese Co-Drugs selbst pharmakologische Effekte auf oder werden sehr schnell metabolisiert, weshalb sie modifiziert wurden. Ob P-Glykoprotein-Blocker der mittlerweile dritten Generation wie Tariquidar, Laniquidar und Zosuquidar sich in klinischen Studien bewähren, bleibt abzuwarten. Eine Abschaltung der entsprechenden Gene, um die Expression von P-Glykoprotein zu verhindern, befindet sich in einem frühen Entwicklungsstadium und funktioniert bisher nur im Tierexperiment, z. B. für den Transport von Digoxin, Paclitaxel und Docetaxel.
In-vitro-Testmodelle
Um den Erfolg und das Ausmaß des BHS-Transports quantifizieren zu können, werden neben den eher aufwendigen Tierversuchen insbesondere in den frühen Phasen der Arzneimittelentwicklung In-vitro-Modelle eingesetzt. Dazu werden entweder isolierte zerebrale Kapillaren oder als Monolayer kultivierte Endothelzellen verwendet. Mit beiden Modellen lassen sich der trans- oder parazelluläre Transport von Wirkstoffen (Permeabilität, Aufnahmemechanismen, Efflux etc.) als auch der Einfluss von Hilfsstoffen und Co-Drugs auf diesen Transport untersuchen. Der Vorteil der kultivierten Endothelzellschichten liegt in der längeren Lebensdauer und höheren Reinheit im Vergleich zu isolierten Kapillaren, welche zwar eine physiologische Differenzierung und intakte, dreidimensionale Struktur aufweisen, jedoch häufig mit Perizyten kontaminiert sind, oft bei der Isolierung beschädigt wurden und teilweise energetische Defekte aufweisen, sodass aktive Transportprozesse nicht zufriedenstellend untersucht werden können. Isolierte Kapillaren eignen sich vor allem zur Untersuchung von Vorgängen an der luminalen Seite (z. B. Efflux). Nachteilig bei den kultivierten Endothelzellschichten ist, dass sie kaum die gleiche Dichtigkeit, Polarität und Enzymausstattung des natürlichen Endothels erreichen.
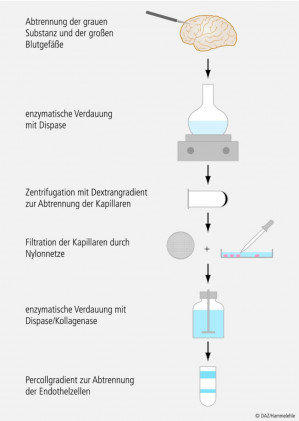
Als Ausgangsmaterial dienen Gehirne verschiedener Species (Rind, Schwein, Ratte, Maus, Kaninchen, Mensch), wobei Schweine- und Rinderhirnen aufgrund der leichten Beschaffbarkeit und der größeren Ausbeute der Vorzug gegeben wird. Aus den Gehirnen werden Kapillaren durch mechanische Homogenisations- und Filtrationsprozesse und/oder Enzymbehandlung isoliert. Durch eine weitere enzymatische Verdauung können einzelne Endothelzellen über eine Gradientenzentrifugation abgetrennt werden (Abb. 4). Die Methoden unterscheiden sich vor allem hinsichtlich der Isolierungstechnik, der Art und Konzentration der verwendeten Reagenzien, der Dauer der Inkubationen und der Zentrifugationsdauer und -geschwindigkeiten, was zu einer unterschiedlichen Ausbeute und Lebensfähigkeit der Zellen führt.
Eine ganz andere Technik geht von der Isolierung zerebraler Kapillaren aus, die einige Tage lang in Petrischalen kultiviert werden. Dabei wachsen Endothelzellkolonien, die mit Trypsin abgetrennt werden. Um einen reinen Monolayer zu erhalten, können diese erneut ausgesät und kultiviert werden. Alternativ existieren einige wenige immortalisierte Zelllinien (z. B. MBEC, PBMEC, RBE4), die für ausgewählte Fragestellungen genutzt werden und einfacher handhabbar sind, aber dem primären Modell nicht in allen Eigenschaften nahekommen. Generell können die Zellkulturen auch als Cokulturen mit Astrozyten und/oder Perizyten angelegt werden, um charakteristische BHS-Eigenschaften zu simulieren.
Im einfachsten Falle lassen sich Endothelzell-Monolayer auf permeablen Membranen anzüchten. Diese bestehen aus einem Filtereinsatz mit Polycarbonat- oder Polyestermembran, auf der die Zellen 7 bis 10 Tage lang kultiviert werden (Abb. 5 u. 6). Die Zellschicht trennt das apikale Donorkompartiment, in das der Wirkstoff hineingegeben wird, vom basolateralen Akzeptorkompartiment, in das der Wirkstoff gelangt, sofern er durch die Zellschicht transportiert wurde. In diesem Fall kann der Wirkstoff mit geeigneten Methoden quantitativ bestimmt werden. Zusätzlich kann während des Transports die Lokalisation des Wirkstoffs oder von Trägersystemen mittels Fluoreszenz- oder Elektronenmikroskopie in den Zellen bestimmt werden. Als Qualitätskontrollen werden die Dichtigkeit des Monolayers durch Messung des transendothelialen Widerstands (TEER) und die Transportraten für Kontrollsubstanzen wie z. B. Sucrose (geringe Permeabilität) und Propranolol (hohe Permeabilität) bestimmt.
Generell gilt, dass keines dieser Modelle alle Funktionen der BHS vollständig ausüben kann. Um akzeptable In-vitro-In-vivo-Korrelationen und Vorhersagen in der Entwicklung von Drug-Delivery-Systemen an der BHS machen zu können, wird eine sorgfältige Auswahl und teilweise sogar eine Kombination verschiedener Testsysteme notwendig sein.
Resümee
Das Verständnis der passiven und aktiven, selektiven und nicht-selektiven Transportmechanismen an der BHS im gesunden wie auch im pathophysiologischen Zustand ist die Voraussetzung, um Mittel und Wege zur Überwindung dieser Barriere zu finden. Die Entwicklung innovativer Drug-Delivery-Systeme bietet ein breites Betätigungsfeld für Pharmazeutische Technologen, die damit einen Beitrag zur Entwicklung neuartiger Pharmakotherapien leisten. Aus Sicht der pharmazeutischen Industrie ist die Forschung im Bereich BHS derzeit noch sehr risikoreich, weil die klinische Anwendung noch weit entfernt scheint. Umso mehr sind Grundlagenforscher gefordert, durch immer wieder neue und ungewöhnliche Ideen die geschilderten Probleme zu lösen.
Literatur
Reichel A. The role of blood-brain barrier studies in the pharmaceutical industry. Current Drug Metabol 2006;7:183-203. Kreuter J. Nanoparticulate systems for brain delivery of drugs. Adv Drug Deliv Rev 2001;47:65-81. Kreuter J. Application of nanoparticles for the delivery of drugs to the brain. Internat Congress Series 2005;1277:85-94. Fricker G, et al. Modulation of drug transporters at the blood-brain barrier. Pharmacology 2004;70:169-176. Pardridge WM. Blood-brain barrier drug targeting: The future of brain drug development. Mol Interventions 2003;3(2) 90-105. Gabriel AS. nanotechnology approaches for drug and small molecule delivery across the blodd brain barrier. Surgical Neurol 2007;67:113-116. Zlokovic BV. The blood-brain barrier in health and chronic neurodegenerative disorders. Neuron 2008;57:178-201. Pardridge WM. The blood- brain barrier: Bottleneck in brain drug development. NeuroRx 2005;2(1):3-14. Brem H, et al. Biodegradable polymer implants to treat brain tumors. J Control Rel 2001;74:63-67. Groothuis DR. The blood-brain and blood-tumor barriers: A review of strategies for increasing drug delivery. Neuro-Oncology 2000;2(1):45-59. Garberg P, et al. In vitro models for the blood-brain barrier. Toxicol In Vitro 2005;19:299-334. Rempe R, et al. Transport of poly-(n-butylcyano-acrylate) nanoparticles across the blood-brain barrier. BBRC 2011;406:64-69.
Autorin
Prof. Dr. Dagmar Fischer,
Friedrich-Schiller-Universität Jena,
Institut für Pharmazie, Professur für Pharmazeutische Technologie,
Otto-Schott-Str. 41, 07745 Jena

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.