
- DAZ.online
- DAZ / AZ
- DAZ 51/2012
- Gefäß etikettieren
Rezeptur nach ApBetrO
Gefäß etikettieren
Regelungen zur Kennzeichnung von Defekturarzneimitteln in Standgefäßen oder als Fertigarzneimittel finden sich in § 16 ApBetrO bzw. in § 10 AMG und § 14 ApBetrO. Sie sollen ebenso wie Regelungen zur Kennzeichnung von Medizinprodukten in diesem Beitrag nicht thematisiert werden. Detaillierte Ausführungen und erläuternde Angaben zum Thema "Kennzeichnung von in der Apotheke hergestellten Arzneimitteln und Medizinprodukten" sowie Materialien zur Teamschulung finden sich im Fachbuch "Rezeptur – Qualität in 7 Schritten" [2].
Entsprechend § 14 ApBetrO müssen bei Rezepturarzneimitteln folgende Angaben auf dem Behältnis "und, soweit verwendet, den äußeren Umhüllungen" aufgebracht werden:
1. Name und Anschrift der abgebenden Apotheke und, soweit unterschiedlich, des Herstellers,
2. Inhalt nach Gewicht, Rauminhalt oder Stückzahl,
3. Art der Anwendung,
4. Gebrauchsanweisung,
5. Wirkstoffe nach Art und Menge und sonstige Bestandteile nach der Art,
6. Herstellungsdatum,
7. Verwendbarkeitsfrist mit dem Hinweis "verwendbar bis" unter Angabe von Tag, Monat und Jahr und, soweit erforderlich, Angabe der Haltbarkeit nach dem Öffnen des Behältnisses oder nach Herstellung der gebrauchsfertigen Zubereitung,
8. soweit erforderlich, Hinweise auf besondere Vorsichtsmaßnahmen, für die Aufbewahrung oder für die Beseitigung von nicht verwendeten Arzneimitteln oder sonstige besondere Vorsichtsmaßnahmen, um Gefahren für die Umwelt zu vermeiden, und
9. soweit das Rezepturarzneimittel aufgrund einer Verschreibung zur Anwendung bei Menschen hergestellt wurde, der Name des Patienten.
Die Art der Anwendung soll für den Patienten leicht verständlich gekennzeichnet werden. Die Angabe "äußerlich" bzw. "Zur äußerlichen Anwendung" ist nicht konkret genug und gilt deshalb als veraltet [4]. Zu beachten ist des Weiteren, dass die Angabe der Bestandteile nach der Art auch die Angabe der Konservierungsmittel einschließt. Analog der Kennzeichnungsvorschriften für Fertigarzneimittel ist die Angabe der Mengen der Bestandteile nicht zwingend vorgeschrieben. Damit die Rezeptur nachrezeptiert werden kann, ist es empfehlenswert, bei Verwendung nicht standardisierter Vorschriften die einzelnen Bestandteile mit Mengenangaben zu versehen.
Die Angaben auf den Behältnissen müssen in gut lesbarer Schrift und auf dauerhafte Weise angebracht und mit Ausnahme der Wirkstoffe (Punkt 5) in deutscher Sprache verfasst sein. Informationen nach Punkt 8 können auch in einem Begleitdokument gegeben werden. Die Forderung nach Lesbarkeit ist in der Regel erfüllt, wenn die Kennzeichnung in schnörkelloser Schrift in einer Schriftgröße von mindestens 6 Punkten (Zeilenhöhe 1,5 mm) auf kontrastierendem Hintergrund aufgebracht wird. Ausnahmeregelungen zur Kennzeichnung kleiner Gefäße sieht die Apothekenbetriebsordnung nicht vor. Die Umsetzung der Vorgaben stellt die Apotheke deshalb vor allem bei Verordnung kleiner Rezepturmengen vor besondere Herausforderungen (siehe DAZ 2012, Nr. 35, S. 50 ff. und [2]).
Zusätzliche Festlegungen zur Kennzeichnung von Arzneimitteln, die Ethanol zur innerlichen Anwendung oder den Farbstoff Tartrazin enthalten, finden sich in der Arzneimittel-Warnhinweis-Verordnung (AMWarnV). Zu beachten sind spezielle Regelungen zur Kennzeichnung von in der Apotheke hergestellten Medizinprodukten und Tierarzneimitteln.
Weitere Angaben auf dem Etikett sind nicht verpflichtend, aber zur Information des Kunden bzw. Patienten empfehlenswert, z. B. Bezeichnung einer standardisierten (NRF-)Vorschrift, Name des Kunden bei Kaufwunsch, Telefonnummer der Apotheke. Wenn die Übersichtlichkeit auf dem Etikett nicht gefährdet ist, können weitere Angaben, z. B. Angabe von Apotheken- oder Verschreibungspflicht oder das Anbringen von Informationen in Blindenschrift, die Kennzeichnung ergänzen.
Umfangreiche Informationen können dem Kunden auch in einem Begleitdokument mitgegeben werden.
Beispielrezeptur
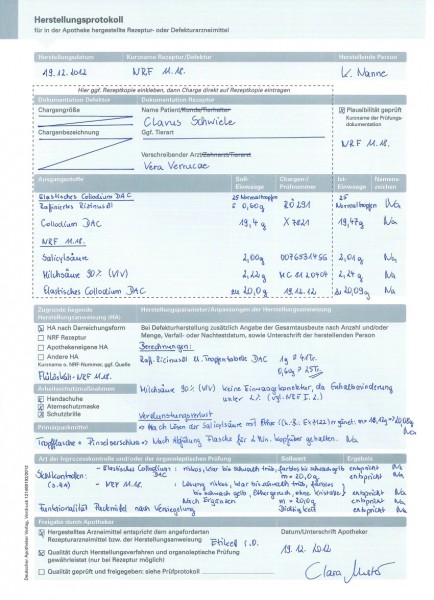
Im Beispiel ist Milchsäure-haltiges Salicylsäure-Collodium 10% nach NRF-Vorschrift verordnet worden (Abb. 1). Die Verordnung ist plausibel (Abb. 2), und das Arzneimittel kann für den Patienten wie verordnet hergestellt werden, wenn alle Ausgangsstoffe in geprüfter Qualität vorhanden sind.
Die Zubereitung enthält zwei Stoffe mit gefährlichen physikalischen Eigenschaften: Ethanol und Ether. Vor der Novellierung der Apothekenbetriebsordnung mussten Zubereitungen mit Diethylether, Isopropanol > 48% V/V oder Ethanol > 77% V/V aufgrund der Gefährdungen durch Explosion bzw. Entzündbarkeit oder Brandförderung mit dem entsprechenden Gefahrensymbol, der Gefahrenbezeichnung und Sicherheitsratschlägen gekennzeichnet werden. Ausnahmeregelungen waren für kleine Füllvolumina (< 125 ml) vorgesehen. Die konkrete Verpflichtung, dass Arzneimittel mit gefährlichen physikalischen Eigenschaften gemäß Gefahrstoffverordnung zu kennzeichnen sind, ist mit der Novellierung der Apothekenbetriebsordnung entfallen. Laut § 14, Abs. 1, Punkt 8 ApBetrO ist aber "auf besondere Vorsichtsmaßnahmen" hinzuweisen. Die Festlegung und Gestaltung dieser Hinweise obliegen dem Apotheker (Abb. 3).
Das NRF gibt zur Kennzeichnung der Beispielrezeptur die Empfehlung, den Hinweis "Hochentzündlich" aufzubringen. Besser geeignet sind für den Patienten leicht verständliche Handlungsanweisungen wie "Von Zündquellen fernhalten! Nicht rauchen!".
Unabhängig von den Regelungen zur Kennzeichnung von Rezepturarzneimitteln ist zu beachten, dass bei der Verarbeitung von Gefahrstoffen – im Beispiel auch Salicylsäure und Milchsäure – Vorsichtsmaßnahmen entsprechend der Gefährdungsbeurteilung in der Apotheke festgelegt werden müssen.
Das Behältnis wird in Abhängigkeit von der abzufüllenden Menge ausgewählt und bietet nur wenig Platz, um die geforderten Angaben aufzubringen. Es wird empfohlen, das Etikett (Abb. 5) als Fahne oder Leporello zu gestalten.
Zu beachten ist, dass die Pflichtangaben nach ApBetrO (bis auf benannte Ausnahmen) direkt auf das Behältnis aufgebracht werden müssen, das Etikett deshalb fest und dauerhaft mit dem Behältnis verbunden sein muss. Bei der Freigabe der Zubereitung zur Abgabe an den Kunden wird die Kennzeichnung durch den Apotheker überprüft (Abb. 4).
Literaturtipp
Ulrike Fischer, Katrin Schüler
Rezeptur – Qualität in 7 SchrittenXVIII, 350 S., 55 farb. Abb.,
101 Tab. Kart.
38,– Euro
Subskriptionspreis bis 31. 01. 2013: 29,80 Euro
Deutscher Apotheker Verlag, Stuttgart 2012 ISBN 978-3-7692-5602-4
Dieses Buch können Sie einfach und schnell bestellen
unter der Postadresse: Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart
oder im Internet unter: www.buchoffizin.de
oder per Telefon unter: (07 11) 25 82 - 3 41 oder- 3 42
Quellen
[1] Rezeptur nach ApBetrO. Deutscher Apotheker Verlag, Stuttgart 2012.
[2] Fischer U, Schüler K. Rezeptur – Qualität in 7 Schritten. Deutscher Apotheker Verlag, Stuttgart 2012.
[3] Neues Rezeptur-Formularium. Hrsg. ABDA, Stand 1. August 2012, Deutscher Apotheker Verlag, Stuttgart / Govi Verlag, Eschborn.
[4] Cyran/Rotta: Apothekenbetriebsordnung Kommentar. Stand: September 2012, Deutscher Apotheker Verlag, Stuttgart.
[5] Leitlinie der BAK: Herstellung und Prüfung der nicht zur parenteralen Anwendung bestimmten Rezeptur- und Defekturarzneimittel. Stand der Revision: 08.05.2012; www.abda.de/fileadmin/assets/Praktische_Hilfen/Leitlinien/Rezeptur_Defektur/LL_Rezeptur_Defektur.pdf.
Autorinnen
Apothekerin Dr. Ulrike Fischer, Dresden
Diplom-Medizinpädagogin Katrin Schüler, Dresden
DAZ 2012, Nr. 51, S. 56



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.