
- DAZ.online
- DAZ / AZ
- DAZ 47/2012
- Gezielte Wirkung im Tumor
Arzneimittel und Therapie
Gezielte Wirkung im Tumor
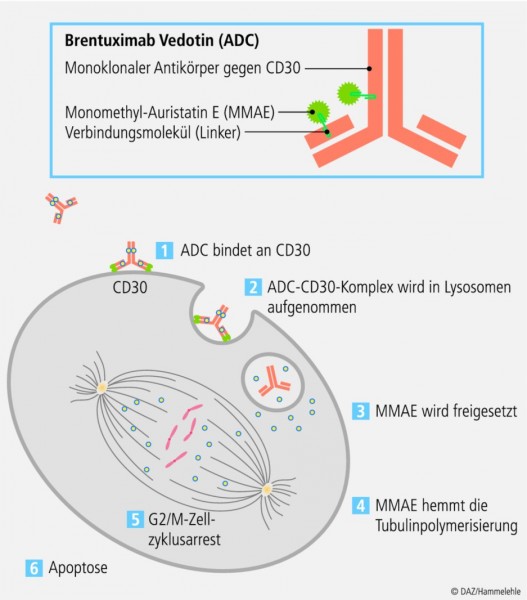
Brentuximab Vedotin gehört in die Gruppe der konjugierten Antikörper, mit deren Hilfe der Wirkstoff gezielt zu bestimmten Zellen geleitet wird. Das Ziel von Brentuximab Vedotin sind überexprimierte CD30-Zellen, die bei einigen hämatologischen Tumoren wie dem Morbus Hodgkin (HL) oder dem systemischen anaplastischen großzelligen Lymphom (sALCL) auftreten. Diese Zellen werden mithilfe des Antikörper-Wirkstoff-Konjugats (antibody-drug conjugate ADC) Brentuximab Vedotin gezielt vernichtet. Dieser Vorgang verläuft folgendermaßen: Brentuximab Vedotin besteht aus drei Komponenten, einem monoklonalen CD30-Antikörper ohne anti-tumorale Eigenschaften, einem Verbindungsstück (Linker) und dem Zytostatikum Monomethyl-Auristatin E (MMAE). Letzteres ist ein extrem toxisches Spindelgift, das aufgrund dieser Eigenschaft nicht als freier Bestandteil appliziert werden kann. Durch den Linker bleibt das Konjugat in der Blutbahn weitgehend stabil. Der Antikörperanteil bindet an die für Morbus Hodgkin und das systemische anaplastische großzellige Lymphom typischen überexprimierten CD30-positiven Tumorzellen. Nach der Bindung wird das Verbindungsstück durch lysosomale Enzyme gespalten und das Zytostatikum in der Zelle freigesetzt. Monomethyl-Auristatin E unterbindet in der Zelle die Tubulinpolymerisierung, was letztendlich zur Apoptose der Tumorzelle führt (siehe Abbildung).
Erfolgreiche Zulassungsstudien
Wirksamkeit und Sicherheit von Brentuximab Vedotin wurden bei Patienten mit Hodgkin-Lymphomen oder anaplastischen großzelligen Lymphomen untersucht, die an einer fortgeschrittenen oder rezidivierten Erkrankung litten, also bereits intensiv vorbehandelt waren.
In einer einarmigen, multizentrischen Phase-II-Studie wurde Brentuximab Vedotin in einer Dosis von 1,8 mg/kg Körpergewicht als Kurzinfusion alle drei Wochen bei intensiv vorbehandelten Patienten mit rezidiviertem Hodgkin-Lymphom bis zu 16 Zyklen lang eingesetzt. Von 102 Patienten sprachen 94% auf die Therapie an, 75% erreichten eine komplette oder partielle Remission (komplette Remissionen 34%). Das mediane progressionsfreie Überleben aller Patienten lag bei 5,6 Monaten, die mediane Responsedauer betrug bei den Patienten mit einer kompletten Remission 20,5 Monate. Nach einer medianen Beobachtungszeit von mehr als 18 Monaten hatten 31 Patienten noch keinen Progress erlitten. In aktuellen Studien wird Brentuximab Vedotin unter anderem in der Erhaltungstherapie bei rezidivierten Hodgkin-Patienten untersucht; weitere Studien für die Primärtherapie sind in Vorbereitung.
In einer internationalen einarmigen Phase-II-Studie erhielten 58 Patienten mit rezidiviertem oder therapierefraktärem ALCL dreiwöchentlich eine Kurzinfusion mit 1,8 mg/kg Brentuximab Vedotin (bis zu 16 Zyklen. Die Ansprechrate lag bei 86%, 57% der Patienten hatten eine komplette Remission, und 97% der Patienten zeigten eine Reduktion des Tumorvolumens. Die mediane Dauer des objektiven Ansprechens betrug 12,6 Monate; die Patienten, die eine komplette Remission erreicht hatten, zeigten ein medianes Ansprechen von 13,2 Monaten. Das mediane progressionsfreie Überleben der Gesamtgruppe betrug 13,3 Monate. Weitere Studien sind geplant oder bereits initiiert.
Maligne LymphomeUnter der Bezeichnung maligne Lymphome wird eine Gruppe hämatologischer Erkrankungen zusammengefasst, die durch eine rasche und unkontrollierte Vermehrung von Zellen des lymphatischen Systems charakterisiert sind. Ursachen und Manifestationen maligner Lymphome sind sehr unterschiedlich. Die aktuelle Klassifikation der WHO unterscheidet mindestens 50 Unterarten. Die zwei wichtigsten Gruppen bilden Hodgkin-Lymphome und Non-Hodgkin-Lymphome. Einige Lymphomarten tragen auf ihrer Zelloberfläche CD30-Antigene, so das systemisch anaplastische großzellige Lymphom (sALCL) und das Hodgkin-Lymphom (HL).
|
Unerwünschte Wirkungen
Zu den häufigsten unerwünschten Ereignissen zählten periphere sensorische Neuropathien (in rund 40% aller Fälle), Nausea, Fatigue, Fieber, Diarrhö, Rash, Obstipation, Infusionsreaktionen und Neutropenien. Die meisten Nebenwirkungen waren vom Schweregrad 1 bis 2. Einige Patienten zeigten eine Grad-3- oder Grad-4-Neutropenie. Die gleichzeitige Anwendung von Brentuximab Vedotin mit Bleomycin ist aufgrund pulmonaler Toxizitäten kontraindiziert. Zum Zeitpunkt der Zulassung durch die FDA war ein Fall einer progressiven multifokalen Leukoenzephalopathie (PML) unter der Therapie mit Brentuximab Vedotin bekannt. Anfang Januar 2012 informierte die FDA über zwei neue Fälle einer PML unter der Therapie mit Brentuximab Vedotin und ergänzte die Produktinformation um einen entsprechenden Warnhinweis. Dieser Hinweis findet sich ebenfalls in der aktuellen Fachinformation.
Steckbrief: Brentuximab VedotinHandelsname: Adcetris Hersteller: Takeda Pharma GmbH, Aachen Einführungsdatum: 1. 12. 2012 Zusammensetzung: 1 Durchstechflasche enthält 50 mg Brentuximab Vedotin, nach Rekonstitution enthält jeder ml 5 mg Brentuximab Vedotin. Packungsgrößen, Preise und PZN: 1 Durchstechflasche mit 50 mg Pulver Konzentrat zur Herstellung einer Infusionslösung, 4920,41 Euro, PZN 9916870. Stoffklasse: andere antineoplastische Mittel, monoklonale Antikörper, ATC-Code: L01XC12 Indikation: Zur Therapie erwachsener Patienten mit rezidiviertem oder refraktärem CD30-positivem Hodgkin-Lymphom nach einer autologen Stammzelltransplantation oder nach mindestens zwei vorangegangenen Therapien, wenn eine autologe Stammzelltransplantation oder eine Mehrfach-Chemotherapie nicht infrage kommen. Zur Therapie Erwachsener mit rezidiviertem oder refraktärem systemisch anaplastischem großzelligem Lymphom. Dosierung: Die empfohlene Dosierung beträgt 1,8 mg/kg, die als intravenöse Infusion über 30 Minuten alle drei Wochen verabreicht wird. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen sonstigen Bestandteil. Die kombinierte Anwendung von Bleomycin und Brentuximab Vedotin verursacht pulmonale Toxizität. Nebenwirkungen: sehr häufig: Infektion; Neutropenie, periphere sensorische Neuropathie, Durchfall, Übelkeit, Erbrechen, Haarausfall, Juckreiz, Myalgie, Fatigue, Fieber, infusionsbedingte Reaktionen; häufig: Infektion der oberen Atemwege, Herpes zoster, Pneumonie, Anämie, Thrombozytopenie, Hyperglykämie, periphere motorische Neuropathie, Schwindel, demyelinisierende Polyneuropathie, Husten, Dyspnoe, Verstopfung, Hautausschlag, Arthralgie, Rückenschmerzen, Schüttelfrost; gelegentlich: orale Candidiasis, Pneumocystis-jiroveci-Pneumonie, Staphylokokken-Bakteriämie, Tumorlyse-Syndrom, Stevens-Johnson-Syndrom. Wechselwirkungen: Der Antimikrotubuli-Wirkstoff Monomethyl-Auristatin E (MMAE) ist ein Substrat von CYP3A4 und möglicherweise von CYP2D6. In-vitro-Daten deuten darauf hin, dass MMAE hauptsächlich durch Oxidation durch CYP3A4/5 metabolisiert wird. Daher sind Wechselwirkungen mit Arzneimitteln möglich, die über den CYP3A4-Stoffwechselweg (CYP-3A4-Inhibitoren/Induktoren) metabolisiert werden. Die gleichzeitige Gabe von Brentuximab mit Ketoconazol, einem starken CYP3A4-und P-gp-Inhibitor, erhöhte die Exposition vom kovalent gebundenen Antimikrotubuli-Wirkstoff MMAE um rund 73% und beeinflusste die Plasma-Exposition von Brentuximab Vedotin nicht. Daher kann die gleichzeitige Gabe von Brentuximab zusammen mit starken CYP3A4-und P-gp-Inhibitoren dazu führen, dass die Häufigkeit von Neutropenie zunimmt. Die gleichzeitige Gabe von Brentuximab mit Rifampicin, einem starken CYP3A4-Induktor, änderte nichts an der Plasma-Exposition von Brentuximab, reduzierte jedoch Exposition von MMAE um ca. 31%. Die gleichzeitige Gabe von Midazolam, einem CYP3A4-Substrat, zusammen mit Brentuximab beeinflusste den Metabolismus von Midazolam nicht. Daher ist nicht zu erwarten, dass Brentuximab die Exposition von Arzneimitteln, die über CYP3A4-Enzyme metabolisiert werden, beeinflusst. Warnhinweise und Vorsichtsmaßnahmen: Bei mit Brentuximab Vedotin behandelten Patienten kann eine Reaktivierung des John Cunningham Virus (JCV) auftreten, die zu einer progressiven multifokalen Leukenzephalopathie (PML) und zum Tod führen kann. Daher sollte genau auf neue oder sich verschlechternde neurologische und kognitive Anzeichen oder Symptome für Verhaltensveränderungen, die möglicherweise auf eine PML hinweisen, geachtet werden. Unter Brentuximab wurden schwere Infektionen wie Lungenentzündung, Staphylokokken-Bakteriämie und Herpes zoster sowie opportunistische Infektionen berichtet. Die Patienten sollten während und nach der Infusion überwacht werden, da Fälle von infusionsbedingten Sofort- und Spät-Reaktionen sowie Anaphylaxie berichtet wurden. Unter Behandlung mit Brentuximab wurden Fälle von Stevens-Johnson-Syndrom sowie von Tumorlyse-Syndrom (Tberichtet. Brentuximab kann eine vorwiegend sensorische periphere Neuropathie verursachen. Unter Brentuximab können Grad 3- oder 4-Anämie, Thrombozytopenie und anhaltende Grad 3- oder Grad 4-Neutropenie auftreten. |
Quelle
Fachinformation Adcetris® (Stand Oktober 2012).
Prof. Dr. Norbert Schmitz, Hamburg: "Start für Brentuximab vedotin – Neue Perspektiven für CD30-positive Lymphome", 4. September 2012, Berlin, veranstaltet von der Takeda Pharma GmbH.
Younes A., et al:. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med. 363, 1812 – 1821 (2010).
Younes A., et al.: Results of a pivotal phase II study of Brentuximab Vedotin for patients with relapsed or refractory Hodgkin´s lymphoma. J Clin Oncol 30, 2183 – 2189 (2012).
Pro B., et al.: Brentuximab Vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large-cell lymphoma: Results of a phase II study. J Clin Oncol 30, 2190 – 2196 (2012).
www.fda.gov: FDA Drug Safety Communication; 13. Januar 2012: New Boxed Warning and Contraindication for AdcetrisTM (brentuximab vedotin) (Zugriff am 9. November 2012).
Apothekerin Dr. Petra Jungmayr


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.