
- DAZ.online
- DAZ / AZ
- DAZ 41/2012
- Schnellere ...
Arzneimittel und Therapie
Schnellere Risikoerkennung
Hintergrund sind neue gesetzliche Regelungen zur Pharmakovigilanz auf europäischer Ebene. Die Einbindung der Verbraucher und Patienten soll unter anderem dazu beitragen, dass unbekannte Nebenwirkungen früher erkannt und entsprechende Gegenmaßnahmen schneller ergriffen werden können.
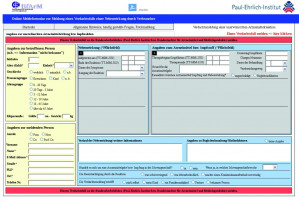
Vereinfachtes Formular
Um die neuen gesetzlichen Vorgaben umzusetzen, wurde ein vereinfachtes Online-Meldeformular für Patienten entwickelt, das ab sofort auf den Seiten des Paul-Ehrlich-Instituts oder des BfArM abrufbar ist.
Es wurde Wert darauf gelegt, dass bei Aufrufen der Seite klar gemacht wird, dass diese Meldung den Arztbesuch nicht ersetzen kann. Voraussetzung für die Meldung ist die Angabe der Kontaktdaten. Den Patienten wird aber zugesichert, dass die Daten über eine gesicherte Verbindung übermittelt und vertraulich behandelt werden. Nach Absenden der Meldung erhalten die Patienten eine Eingangsbestätigung.
Die Meldungen werden auf Behördenseite zunächst erfasst und auf Vollständigkeit überprüft. Bei fehlenden Informationen ist eine Nachfrage bei dem meldenden Patienten vorgesehen. Danach werden die Daten in anonymisierter Form den Pharmakovigilanz-Datenbanken von PEI und BfArM zugeführt. Wissenschaftliche Mitarbeiter überprüfen bei jeder eingehenden Meldung, ob ein neues Risikosignal vorliegt.
Bislang wurden Nebenwirkungen über Ärzte und Apotheker erfasst. Sie können entsprechende Verdachtsfälle entweder direkt bei den beiden Bundesoberbehörden melden sowie über die Arzneimittelkommissionen der deutschen Ärzteschaft oder der Deutschen Apotheker. Auch die pharmazeutischen Unternehmer sind gesetzlich verpflichtet, Verdachtsfälle den zuständigen Behörden mitzuteilen. Es bleibt abzuwarten, wie das neue Angebot von den Patienten angenommen wird. Erfahrungen mit direkten Meldungen durch Patienten in anderen Ländern sind durchaus unterschiedlich. In Italien und Australien liegt der Anteil direkter Nebenwirkungsmeldungen bei 0,3 bzw. 3%, in den USA bei 57%.
Quelle
Mergel M et al.: Bulletin zur Arzneimittelsicherheit. Juni 2012
Pressemitteilung des PEI vom 2. Oktober 2012
du




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.