
- DAZ.online
- DAZ / AZ
- DAZ 36/2012
- Neuer Wirkstoff bei ...
Arzneimittel und Therapie
Neuer Wirkstoff bei Mukoviszidose
Die Mukoviszidose ist eine seltene lebensbedrohliche Erberkrankung. Nach der Hämochromatose ist die Mukoviszidose die häufigste angeborene Stoffwechselerkrankung hellhäutiger Menschen. Die Erkrankungsquote liegt bei etwa 1:2000 Neugeborenen, in Schottland sogar bei 1:500. Weltweit sind etwa 70.000 Menschen betroffen, davon 30.000 in den USA, 35.000 in Europa, 3800 in Kanada und fast 3000 in Australien. In Deutschland leben zur Zeit rund 8000 Menschen mit dieser Erbkrankheit.
Da die Mukoviszidose autosomal-rezessiv vererbt wird, tritt die Erkrankung nur dann auf, wenn ein Mensch von beiden Elternteilen je ein mutiertes Gen erbt. Vier Prozent der deutschen Bevölkerung, also rund drei Millionen Menschen, sind gesunde Genträger, können das mutierte Allel aber weiter vererben. In Deutschland werden jedes Jahr rund 300 Kinder mit der Erkrankung geboren.
Mutationen in einem Chloridionenkanal
Die Ursache der Krankheit sind verschiedene Mutationen in einem Chloridionenkanal, dem CTFR-Protein (Cystic Fibrosis Transmembrane Conductance Regulator). Dieser Chloridkanal kommt auf der Oberfläche zahlreicher Epithelzellen in verschiedenen Organen vor. Die Mutationen führen dazu, dass zu wenig Kanäle gebildet werden oder/und dass diese nicht mehr richtig funktionieren. Derzeit sind mehr als 1800 Mutationen des CFTR-Gens bekannt.
Durch den gestörten Chloridionentransport werden zu wenig Salz und Wasser in die und aus den Zellen transportiert. Als Folge können alle exokrinen Drüsen nur sehr zähe Sekrete produzieren. Am stärksten betroffen sind die Lungen. Hier verstopft der dicke, zähe Schleim die Atemwege und erschwert die Atmung. Gleichzeitig begünstigt er die Ansiedelung von Bakterien, was chronische Infektionen der Lungen und fortschreitende Lungenschädigungen nach sich ziehen kann.
Behandelt wird eine Mukoviszidose symptomatisch mit Krankengymnastik, Atemtherapien, Inhalationen und verschiedenen Arzneimitteln. Dazu gehören schleimlösende Mittel, Verdauungsenzyme und Antibiotika bei Infektionen.
Heute liegt die durchschnittliche Lebenserwartung von Mukoviszidosepatienten bei 38 Jahren in den USA und 41 Jahren in Großbritannien. Für Neugeborene wird bereits ein Wert von 45 bis 50 Jahren angegeben. Minimal Erkrankte haben eine normale Lebenserwartung und sind in der Lage, Kinder zu zeugen oder auszutragen.
Wirkung nur bei der G551D-Mutation
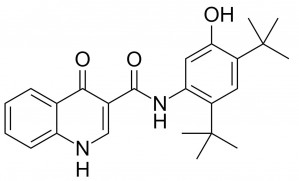
Das Oxochinolincarboxamid Ivacaftor wirkt als selektiver Potentiator des CFTR-Proteins. In vitro erhöht Ivacaftor die Offenwahrscheinlichkeit, die CFTR-Kanal-Gating-Aktivität, bestimmter CFTR-Mutanten und verstärkt so den Chloridionentransport. Der neue Wirkstoff wird daher auch als CFTR-Potentiator bezeichnet.
Ivacaftor kann damit die Ursache der Mukoviszidose direkt beeinflussen, allerdings nur bei Menschen mit einer speziellen Genmutation (G551D). Bei dieser Mutation ist Glycin an Position 551 durch Asparaginsäure ersetzt worden. Dabei ist zwar das Protein an der Zelloberfläche vorhanden, funktioniert aber nicht richtig.
Die G551D-Mutation betrifft etwa 5% der Erkrankten, in Europa sind dies schätzungsweise 1100 Menschen. In den Zulassungsstudien verbesserte Ivacaftor bei Menschen ab sechs Jahren mit dieser speziellen Genmutation die Symptome und das klinische Bild deutlich im Vergleich zu Placebo.
Für andere der über 1500 bekannten Mutationen des CFTR-Kanals konnte keine Wirksamkeit in klinischen Studien nachgewiesen werden. Daher sollte vor dem Einsatz von Ivacaftor der Genotyp des Patienten bestimmt werden.
Zweimal täglich 150 mg einnehmen
Die empfohlene Dosis beträgt 150 mg oral alle zwölf Stunden (300 mg Tagesgesamtdosis). Die Tabletten sollten unzerkaut geschluckt und zusammen mit einer fetthaltigen Mahlzeit eingenommen werden, um die Resorption zu verbessern.
Bei Patienten mit stark eingeschränkter Nierenfunktion oder terminaler Niereninsuffizienz wird zur Vorsicht geraten. Für Patienten mit mäßig eingeschränkter Leberfunktion wird eine reduzierte Dosis von 150 mg einmal täglich empfohlen; bei Patienten mit stark eingeschränkter Leberfunktion eine Anfangsdosis von 150 mg jeden zweiten Tag; die Dosierungsintervalle sind je nach klinischem Ansprechen und Verträglichkeit anzupassen.
Ivacaftor und seine Metaboliten werden nahezu ausschließlich mit den Fäzes ausgeschieden. Die terminale Halbwertszeit beträgt zwölf Stunden.
Steckbrief: IvacaftorHandelsname: Kalydeco Hersteller: Vertex Pharmaceuticals, München Einführungsdatum: 15. August 2012 Zusammensetzung: 1 Filmtablette enthält 150 mg Ivacaftor. Sonstige Bestandteile: Tablettenkern: mikrokristalline Cellulose, Lactose-Monohydrat, Hypromelloseacetatsuccinat, Croscarmellose-Natrium, Natriumdodecylsulfat, hochdisperses Siliciumdioxid, Magnesiumstearat (Ph. Eur.). Filmüberzug: Poly(vinylalkohol), Titandioxid (E171), Macrogol, Talkum, Indigocarmin, Aluminiumsalz (E132), Carnaubawachs. Drucktinte: Schellack, Eisen(II,III)-oxid (E172), Propylenglycol, Ammoniumhydroxid. Packungsgrößen, Preise und PZN: 56 Filmtabletten, 25.504,20 Euro, PZN 9921463 Stoffklasse: Mittel für den Respirationstrakt; ATC-Code: noch nicht zugewiesen Indikation: Zur Behandlung der zystischen Fibrose (CF, Mukoviszidose) bei Patienten ab sechs Jahren mit einer G551D-Mutation im CFTR-Gen Dosierung: 150 mg oral alle zwölf Stunden (300 mg Tagesgesamtdosis) zusammen mit einer fetthaltigen Mahlzeit Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile Nebenwirkungen: Bauchschmerzen, Durchfall, Schwindel, Hautausschlag, Reaktionen der oberen Atemwege, Kopfschmerzen, Bakterien im Sputum Wechselwirkungen: Ivacaftor ist ein Substrat von CYP3A4 und CYP3A5, ein schwacher Inhibitor von CYP3A und ein potenzieller Inhibitor von P-gp und CYP2C9. Bei gleichzeitiger Anwendung mit starken CYP3A-Inhibitoren sollte Ivacaftor in einer Dosis von 150 mg zweimal wöchentlich eingenommen werden; bei gleichzeitiger Anwendung mit mittelstarken CYP3A-Inhibitoren einmal täglich als Tagesdosis von 150 mg. Die gleichzeitige Anwendung mit starken CYP3A-Induktoren wird nicht empfohlen. Die gleichzeitige Anwendung schwacher bis mäßiger CYP3A-Induktoren kann die Exposition gegenüber Ivacaftor reduzieren und damit auch seine Wirksamkeit herabsetzen. Ivacaftor kann die systemische Exposition gegenüber Arzneimitteln, die Substrate von CYP3A und/oder P-gp sind, erhöhen, wodurch ihre therapeutische Wirkung sowie Nebenwirkungen verstärkt oder länger anhaltend auftreten können. Warnhinweise und Vorsichtsmaßnahmen: Leberfunktionstests werden vor Beginn der Behandlung mit Ivacaftor, alle drei Monate im ersten Jahr der Behandlung und danach jährlich empfohlen. Die Anwendung bei Patienten mit Organtransplantaten wird nicht empfohlen. |
Nebenwirkungen
Zu den häufigsten unerwünschten Reaktionen zählten Kopfschmerzen, Infektionen der oberen Atemwege, verstopfte Nase, Hautausschläge, Durchfall und Magen- oder Bauchschmerzen.
Arzneimittel, welche die CYP3A-Aktivität hemmen oder induzieren, können die Pharmakokinetik von Ivacaftor beeinflussen. Ivacaftor ist ein schwacher CYP3A-Inhibitor und kann die Pharmakokinetik von Arzneimitteln verändern, die durch das CYP3A-System metabolisiert werden. Seine Dosis muss entsprechend angepasst werden, wenn gleichzeitig starke und moderate CYP3A-Inhibitoren eingesetzt werden.
Leberfunktionstests werden vor Beginn der Behandlung mit Ivacaftor, alle drei Monate im ersten Jahr der Behandlung und danach jährlich empfohlen.
Der Hersteller Vertex Pharmaceuticals hat alle Teilnehmer der Zulassungsstudien in eine Open-Label-Anschlussstudie übernommen, sodass weitere Daten zur Wirksamkeit und Sicherheit folgen.
QuelleInternetseiten der European Medicines Agency (EMEA), Stand August 2012Ivacaftor (Kalydeco) for cystic fibrosis. Med. Lett. Drugs Ther. (2012) 54 (1388): 29 – 30.Hadjiliadis, D.: Ivacaftor improved lung function in cystic fibrosis with G551D mutation. Ann. Intern. Med. (2012) 156(8): JC4-10 Yu, H., et al.: Ivacaftor potentiation of multiple CFTR channels with gating mutations. J. Cyst. Fibros. (2012) 11(3): 237 – 245.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.