
- DAZ.online
- DAZ / AZ
- DAZ 36/2012
- Bakterien helfen heilen
Technologie
Bakterien helfen heilen
Das Geheimnis der bakteriellen Nanocellulose
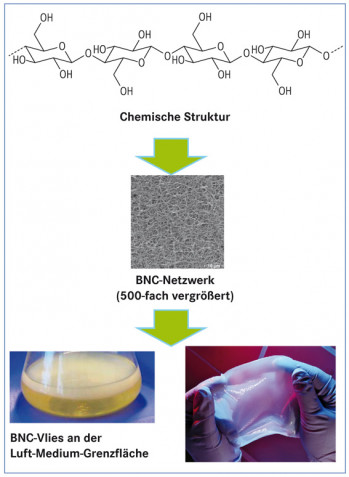
Die Besonderheit der BNC offenbart sich bei einem Blick ins Elektronenmikroskop: Sie besteht aus einem dreidimensionalen Netzwerk aus Cellulose-Nanofasern, die einen Durchmesser von ca. 40 bis 60 nm aufweisen und damit 100-mal dünner sind als pflanzliche Cellulosefasern. Das Netzwerk verfügt über ein gut ausgebildetes Tunnel- und Porensystem. Technologisch betrachtet handelt es sich um ein formstabiles Hydrogel, bestehend aus etwa 1% Cellulose und 99% Wasser, welches an der Grenzfläche zwischen Luft und Nährmedium von gramnegativen, aeroben Bakterien der Spezies Gluconacetobacter xylinus produziert wird (Abb. 1). Das Netzwerk schützt die Mikroorganismen vor Austrocknung, Feinden, Sauerstoff- und Nährstoffmangel sowie UV-Strahlung [1].
1886 entdeckte Adrian J. Brown (1852 – 1919) das weiße, gelartige Material während der Essigfermentation und identifizierte es als Cellulose. Verursacher waren Essigsäurebakterien der Spezies Gluconacetobacter xylinus (früher: Acetobacter xylinum), die nicht-pathogen sind und auf verderbenden Früchten und Blumen sowie unpasteurisierten und unsterilisierten Säften, Bier oder Wein vorkommen [1, 2]. Erst Mitte des 20. Jahrhunderts entwickelten Hestrin und Schramm ein spezielles Kulturmedium, das die Kultivierung dieser Bakterien im Labor ermöglichte [3]. Von da an trat die Nanocellulose ihren Siegeszug in vielen Bereichen an: über technische Anwendungen, die Lebensmittelindustrie bis zur Kosmetik und neuerdings auch im medizinisch-pharmazeutischen Gebiet.
Bakterielle Nanocellulose wird vom Bakterium aus niedermolekularen Zuckern oder alternativen Kohlenstoffquellen via Uridinphosphat-Glucose durch Polymerisation hergestellt. Bactopepton und Hefeextrakte dienen im Labor als Stickstoff- und Vitaminlieferanten. Die Bildung der bakteriell gewonnenen Cellulose erfolgt zwischen der äußeren Membran und der Cytoplasmamembran der Bakterienzelle mithilfe eines Cellulose-synthetisierenden Komplexes. Die entstehenden Celluloseketten werden als sogenannte Elementarfibrillen über Poren in der Bakterienwand nach außen abgegeben. Gleichzeitig ausgeschiedene Elementarfibrillen lagern sich zu Mikrofibrillen zusammen, welche nachfolgend durch Aggregation die Cellulosefasern bilden. Daraus ergibt sich im letzten Schritt durch Selbstorganisation ein hoch gequollenes dreidimensionales BNC-Netzwerk aus natürlichen Nanofasern und einem ausgeprägten Netz von Wasserstoffbrücken [4].
Die bakterielle Nanocellulose vereinigt damit die interessanten Eigenschaften der pflanzlichen Cellulose mit den besonderen Vorteilen von Nanosystemen (Tab. 1). Hervorzuheben sind dabei insbesondere die hohe Kristallinität von 70 bis 90% und der hohe Polymerisationsgrad von bis zu 10.000 Anhydroglucoseeinheiten. Damit verbunden sind ausgeprägte mechanische Eigenschaften wie eine außerordentliche Zugfestigkeit der Einzelfasern von bis zu 2 GPa vergleichbar mit Aramid-Fasern, die z. B. als Material für schusssichere Schutzwesten eingesetzt werden [1, 5]. Das hohe Aufnahme- und Rückhaltevermögen von Wasser, aber auch viskosen Flüssigkeiten, die Temperaturbeständigkeit bis 300 °C und damit Sterilisierbarkeit sowie die hohe Reinheit (frei von Lignin, Pektin, Hemicellulose) machen das Material interessant für pharmazeutische Anwendungen.
Tab. 1: Charakteristische Eigenschaften von | |
Kristallinität |
86% |
Reißfestigkeit (heißgepresste Folie, 0,013 mm dick) |
312 MPa |
Wasseraufnahmevermögen |
16.900% |
Wasserrückhaltevermögen unter mechanischer Beanspruchung (Zentrifugieren bei 4000 rpm) |
853% |
Herstellung und Modifizierung von BNC
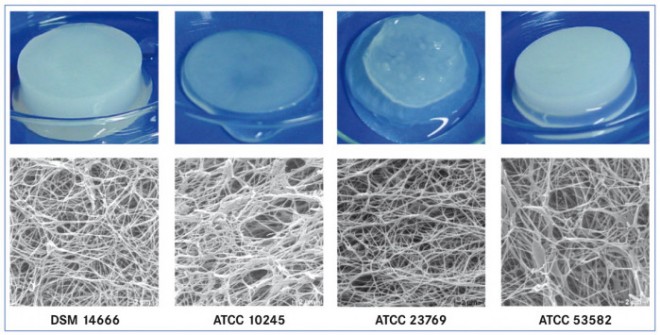
Die Eigenschaften der BNC können bereits während der Kultivierung von einer großen Anzahl von Variablen, z. B. dem Bakterienstamm, der Kultivierungsmethode, der Zusammensetzung des Kulturmediums, der Kultivierungsparameter wie pH-Wert, Temperatur, Sauerstoff-Partialdruck und in einigen Fällen auch durch ein Trägermaterial beeinflusst werden. Dargestellt ist dies in Abb. 2 beispielhaft anhand des BNC-Formkörpers und des Nanofasernetzwerkes, das bei einer statischen Kultivierung in einem Erlenmeyerkolben mithilfe verschiedener Bakterienstämme gebildet wird. Diese Bilder zeigen deutlich die Unterschiede in der Masse der unter gleichen Bedingungen kultivierten BNC, ihrer mechanischen Stabilität und Homogenität [6].
Der Formenvielfalt scheinen aufgrund unterschiedlicher Kultivierungsmethoden kaum Grenzen gesetzt zu sein. BNC wird typischerweise in flächiger Form (Abb. 2) oder als Kugeln, faserartige Gebilde (Abb. 3), unregelmäßige Aggregate oder auch in tubulären Formen gewonnen. Möglich machen dies statische und bewegte Arten der Kultivierung [4, 7, 8]. Bei der statischen Kultivierung beispielsweise in einer flachen Schale oder in einem Laborkolben bilden Bakterien BNC an der Grenzfläche zwischen Luft und Kulturmedium. Das Biopolymer entsteht je nach Kultivierungsdauer (meist 3 – 14 Tage) in Form von dünnen Häutchen, Folien bis hin zu Vliesen von mehreren Zentimetern Dicke. Flächige BNC wird auch an festen Phasen wie Agar, Siliconkautschuk oder porösen Membranen gewonnen [9]. Eine Kultivierung unter Schütteln oder Rühren in einem begasten Fermenter oder in Blasensäulen führt dagegen bei der Bildung von BNC zu faserartigen Strukturen, unregelmäßigen Aggregaten oder sphärischen Partikeln [8].
Das Nanofasernetzwerk ist weniger homogen, allerdings kann die bewegte Kultivierung zu einer Erhöhung der BNC-Ausbeute pro Zeit im Vergleich zur statischen Alternative führen. Bisher wurden jedoch nur wenige Gluconacetobacter-Stämme gefunden, die für diese Art der Kultivierung geeignet sind. Grund hierfür sind die bei einer bewegten Kultivierung zum Beispiel durch das Rühren verursachten Scherkräfte, die zu einer Hemmung der BNC-Biosynthese oder einer Zerstörung der Bakterien führen. Darüber hinaus wird die spontane Bildung von Mutationen der aktiven Bakterien zu inaktiven, nicht Cellulose erzeugenden Bakterien begünstigt.
Kultivierungsmethoden, die den statischen und bewegten Ansatz miteinander verbinden, wurden ebenfalls entwickelt. Bekannte Beispiele sind rotierende Scheiben oder Förderbänder, die durch das Kulturmedium geführt werden [10]. Hierbei entstehen typischerweise unregelmäßige BNC-Häutchen, die vom eintauchenden Träger abgenommen werden. Mithilfe einer Matrix-Technologie konnten BNC-Hohlkörper in Form von Röhrchen direkt aus dem Kulturmedium gewonnen werden, die sich derzeit als Gefäßimplantate in der Testung am Tier befinden [11]. Andere Forschergruppen arbeiten daran, BNC beispielsweise für die Herstellung künstlicher Menisken oder als Knorpelersatz bereits während der Biosynthese in die gewünschte Form zu bringen [12]. Die Wahl einer geeigneten Kultivierungsmethode hängt somit wesentlich von der späteren Anwendung des BNC-Materials ab. Sie beeinflusst neben der Form auch die supramolekulare Struktur sowie die physikalischen und mechanischen Eigenschaften der resultierenden BNC.
Die Vielzahl der möglichen Anwendungsgebiete für das hochleistungsfähige Biopolymer BNC hat dazu geführt, dass in den letzten Jahren neue Verfahren entwickelt wurden, die eine automatisierte Gewinnung sowohl flächiger BNC als auch von BNC-Aggregaten erlauben. Das kontinuierliche "Horizontal-Lift-Reactor"-Verfahren (HoLiR-Verfahren, Abb. 4) beruht beispielsweise darauf, dass die an der Grenzfläche zwischen Luft und Kulturmedium entstandene flächige BNC kontinuierlich aus der Kultivierungsapparatur entfernt wird, ohne den Bioprozess zu stören [13]. Während alle übrigen Kultivierungsparameter konstant gehalten werden, entsteht auf diese Weise ein Endlosband an BNC mit großer Homogenität und konstanten Materialeigenschaften.
Durch den Einsatz von Additiven können die Eigenschaften der BNC bereits während der Biosynthese (in situ) oder auch danach angepasst werden. Wasserlösliche Polymere, anorganische und organische Stoffe und Metall- oder Metalloxid-Nanopartikel konnten in die BNC eingebaut werden. Additive wie Methylcellulose oder Carboxymethylcellulose, die während der Biosynthese zum Kulturmedium gegeben wurden, führten beispielsweise zu Veränderungen der Elastizität, des Wasseraufnahme- und Rückhaltevermögens sowie der Porengröße [14]. Eine Abnahme der Porengröße wurde auch bei Zugabe von Polyethylenglykol 4000 beobachtet, während sich die Poren in Gegenwart von β‑Cyclodextrin oder Polyethylenglykol 400 vergrößerten. Die Einlagerung kationischer Stärke führte zur Bildung eines Doppelnetzwerkes beider Komponenten. Diese Vielzahl von Möglichkeiten der Modifizierung eröffnet ein breites Spektrum an Formen und Materialeigenschaften der BNC als biomedizinisches Material.
Ein Biomaterial mit hohem Anwendungspotenzial
Demzufolge ist es nicht verwunderlich, dass dieses Biopolymer ein enormes Potenzial für verschiedenste Anwendungen besitzt und derzeit für eine Vielzahl von Applikationen intensiv untersucht wird (Tab. 2). Interessant sind hierbei sowohl natürlich feuchte Hydrogele als auch gefriergetrocknete Aerogele, bei denen die dreidimensionale Netzwerkstruktur erhalten bleibt, sowie getrocknete strukturkollabierte Folien. Die technische Anwendung der BNC wird seit vielen Jahren umfassend untersucht. BNC wurde als Papier, Trägermaterial z. B. für Katalysatoren, Membranen für Dialysen und amperometrische Sensoren zur Messung von Blutglucosespiegeln, Filtermaterial, zur Materialverstärkung und als Folie und Verpackungsmaterial getestet [5, 15, 16]. Die vielversprechenden Produktentwicklungen, z. B. als Membran in Lautsprechern von Sony, machten auch in diesem Anwendungsfeld deutlich, dass effiziente Herstellungsverfahren dringend benötigt werden, um qualitativ hochwertige BNC in großen Mengen herstellen zu können.
Tab. 2: Übersicht über Anwendungsmöglichkeiten von bakterieller Nanocellulose | |
Technische Anwendungen |
Anwendungen in Medizin, Kosmetik, Ernährung |
|
elektrisch leitfähige
Spezialpapiere Bestandteil von
Kompositwerkstoffen Trägermaterial für
Katalysatoren Membranen, Folien,
Verpackungsmaterial Filtermaterial
|
Material für Wundauflagen
Material für Implantate
(Gefäßprothesen, Knorpel- und Meniskusersatz …) Trägergerüst für Tissue Engeneering
Hilfsstoff in Kosmetika
Inhaltsstoff von Nahrungsergänzungsmitteln und diätetischen Lebensmitteln
|
In der Lebensmittelindustrie kennt man die bakterielle Nanocellulose dagegen schon lange [5]. Gefragt sind hier vor allem das hohe Wasseraufnahmevermögen und die Unverdaulichkeit. Die BNC wird vor allem auf den Philippinen in großen Mengen in Handarbeit in Bottichen kultiviert und ist inzwischen häufig in asiatischen Speisen zu finden. Nata de coco ("Kokossahne") ist eine vor 100 Jahren auf den Philippinen entwickelte Süßspeise, die aus mittels Gluconacetobacter fermentiertem Kokosnusssaft gewonnen wird. Bissfester als Gelatine, mit einem angenehmen Mundgefühl, wird sie meist in Würfelform in Obstsalaten oder Puddings gereicht. Da sie vergleichsweise geschmacksneutral ist, wird sie meistens aromatisiert und in gefärbter Form als Fruchtfleischersatz verwendet.
Aufgrund ihrer verdickenden, emulsions- und suspensionsstabilisierenden und wasserhaltenden Eigenschaften ist die BNC in Chinesischen Fleischbällchen (kung-wan), Speiseeis, Joghurt und Getränken und sogar bei den Vergärungsprozessen des Kombucha-Teepilzes zu finden. Die Hemmung von Verdauungsenzymen, Steigerung der Gallensäurensekretion, Erhöhung der Darmperistaltik sowie die in Tierversuchen beobachtete Senkung von Cholesterol- und Triglyceridspiegeln machen die BNC zu einem interessanten Diätetikum [5]. Die zusätzliche sättigende und quellende Wirkung wird mittlerweile nicht mehr nur in Asien geschätzt, um schlank zu bleiben. Die Kombination von Lactobacillus- und Acetobacter-Arten wird auch als künstliche Darmflora diskutiert [17].
Der hohe Wassergehalt, die hohe Reinheit und mechanische Stabilität, sowie eine angenehme Weichheit und Anschmiegsamkeit haben die BNC in der Kosmetik Fuß fassen lassen. Sie dient als feuchtigkeitsspendende Gesichtsmaske (Nanomasque®, Biocellulose), angereichert mit Propolis-Extrakten, Vitaminen, Algenextrakten, Ölen und Panthenol, oder als Peeling-Maske mit Salicylsäure, Ascorbinsäure, Citronensäure und Natriumhydrogencarbonat [5, 18 – 20]. Sie ist Bestandteil von Lippenstiften, Nagellacken (künstliche Nägeln) und kleinen parfümgetränkten Patches, die zur Freigabe des Parfums auf die Haut geklebt werden. Voraussetzung für die kosmetische Anwendung ist die Endotoxinfreiheit, die mittels Endotoxintest (LAL) belegt wurde, sowie eine hervorragende Biokompatibilität auf der Haut. BNC zeigte sowohl in einem humanen Patchtest über 72 h als auch in repetitiven Epikutantests über sechs Wochen kein irritierendes oder allergisierendes Potenzial auf der Haut. Die Feuchtigkeit der behandelten Hautareale war deutlich höher als die der unbehandelten Hautstellen [5, 21 – 23].
Die BNC erobert Medizin und Pharmazie
Ihre hervorragende Biokompatibilität macht die BNC zu einem attraktiven Material zur Anwendung am Patienten [24]. Die gute Verträglichkeit konnte in zahlreichen Studien an verschiedenen Spezies (Ratte, Maus, Hamster, Schaf, Schwein) in Experimenten von bis zu einem Jahr bestätigt werden. In In-vitro-Untersuchungen konnten Hämolysen, Thrombogenität, Genotoxizität und zelltoxische Effekte ausgeschlossen werden. In Tierexperimenten zeigte die BNC nach Implantation ein vollständiges Einwachsen in Gewebe, keine Fremdkörperreaktionen, chronische Entzündungen und keine Bildung von narbigem oder fibrotischem Gewebe. Das konnektive Gewebe war gleichmäßig in die BNC-Strukturen integriert worden.
Die ersten medizinischen Anwendungen erstreckten sich auf Medizinprodukte wie künstliche Blutgefäße, Implantate als Knorpel- oder Knochenersatz und Wundauflagen. Das nanostrukturierte Netzwerk und die morphologische Ähnlichkeit mit Kollagen machen die BNC attraktiv für Zellimmobilisierungs- und Zellmigrationsprozesse sowie die Produktion extrazellulärer Matrix. Künstliche Blutgefäße (z. B. BASYC® , Bacterial-Synthesized Cellulose), hergestellt nach der Matrix-Reservoir-Methode (WO2001061026A1) [25], oder der Siliconröhrchen-Methode (EP396344A2) [26] sind flexibel, elastisch, druckstabil, durchlässig für Ionen und Wasser und von geringer Rauigkeit, was eine unerwünschte Adhäsion von Blutzellen nach Implantation verhindert [1, 5, 27]. Implantate aus synthetischen Polymeren hingegen zeigen oftmals die Bildung von Thrombosen, insbesondere wenn sie als Mikrogefäßersatz (< 3 – 6 mm) eingesetzt werden. Zyto- und Hämokompatibilität, mechanische Festigkeit, Undurchlässigkeit für Blut und Blutbestandteile sowie die Sterilisierbarkeit sind Voraussetzungen, die die BNC mitbringt. Sie können als Hydrogelgefäße in verschiedenen Längen, mit unterschiedlichen Wandstärken und inneren Durchmessern hergestellt werden. Sie werden auch als Bypass für Koronararterien getestet oder als Trainingsset in der Mikrochirurgie (Nerven, Blutgefäße) zum Erlernen von Nahttechniken eingesetzt [5]. In Tierversuchen waren nach einer Woche, einem Monat und einem Jahr die Blutgefäß-Implantate auf der luminalen Seite vollständig endothelialisiert und auf der Außenseite von Bindegewebe kolonialisiert worden. Kollagen-produzierende Fibroblasten waren eingewachsen. Obwohl die Tiere nicht mit Antikoagulanzien vorbehandelt worden waren, verursachten die Implantate nach Liegezeiten bis zu einem Jahr keine Koagulation oder Thrombosen [1].
Stents, die mit BNC überzogen worden waren, wurden in die Arteria iliaca von Kaninchen implantiert [1]. Es konnten weder akut noch chronisch Gefäßverschlüsse durch Stent-Thrombosen beobachtet werden. Im Bereich Tissue Engineering werden BNC-Materialien gezielt in situ durch Pin-Templates oder nach der Herstellung durch Laserbehandlung mit Poren versehen, die das Einwachsen von Zellen erleichtern sollen [27]. Die Modifikation der BNC mit Peptidsequenzen wie RGD (Arg-Gly-Asp) soll zusätzlich die Zelladhäsion begünstigen [27].
Als limitierend kann sich die fehlende Bioabbaubarkeit der BNC im Organismus erweisen, da der menschliche Organismus nicht über Cellulasen verfügt. Daher wurde eine modifizierte BNC entwickelt, die nach der Synthese einer Periodat-Oxidation unterzogen wird und aufgrund der entstehenden 2,3-Dialdehyd-Cellulosestrukturen bei physiologischen pH-Werten abgebaut werden kann. Die BNC behält trotz der Behandlung ihre hervorragenden Eigenschaften wie Hydrogelstruktur und Kristallinität bei [1].
BNC als Wundauflage
Johnson & Johnson hat in den frühen 1980er Jahren als erste Firma versucht, BNC im Großmaßstab als Wundauflage zu entwickeln und zu kommerzialisieren, hat allerdings keine Daten dazu veröffentlicht, vermutlich weil der Versuch scheiterte. Die brasilianische Firma BioFill Produtos Biotecnologicos entwickelte in dieser Zeit unabhängig davon die Produkte Biofill® und Bioprocess® als künstlichen Hautersatz für die Therapie von Ulzerationen und Verbrennungen sowie Gengiflex® zur Behandlung periodontaler Erkrankungen. In den 1990er Jahren versuchten sich mehrere japanische Firmen in einem Joint Venture (Biopolymer Research Co., Ltd.) zusammen mit verschiedenen öffentlichen Einrichtungen an der Großproduktion von BNC. Dabei entstanden zwar zahlreiche Patente und Veröffentlichungen, aber außer der Verwendung von BNC in Lautsprechern von Sony fand die BNC keine neue Anwendung [28]. 1996 erwarb die US-Firma Xylos eine exklusive Lizenz von Johnson & Johnson und war durch Weiterentwicklungen in der Lage, die Produkte XCell® Cellulose Wound Dressing und XCell® Antimicrobial Wound Dressing (mit dem Antiseptikum Polyhexanid) auf den Markt zu bringen. Diese Technologien wurden 2007 von Lohmann & Rauscher übernommen und werden heute als hydroaktive Wundauflage unter den Handelsnamen Suprasorb® und Suprasorb® X + PHMB (Polyhexamethylenbiguanid) vertrieben [28]. Seit Kurzem ist mit Cuticell® Epigraft der BSN medical GmbH ein weiteres Produkt auf BNC-Basis auf dem Markt. Die BNC-Membranen sind für Spalthautentnahmestellen, Verbrennungen 2. Grades, Hautrisse, Wunden und Hautläsionen indiziert [29].
Als vorteilhaft haben sich bei Wundauflagen aus BNC das schmerzfreie Ablösen von der Wunde, die geringere Verbandswechselhäufigkeit und nicht zuletzt die sehr weiche und anschmiegsame Oberfläche, die zusätzliche Hautirritationen vermeidet, erwiesen. Als Feuchtverband verwendet, kann ein heilungsförderndes Feuchtigkeitsmilieu in der Wunde unter Vermeidung von Austrocknung erzielt werden. Postuliert wird, dass überschüssiges Exsudat aus der Wunde in den Verband aufgenommen wird, gleichzeitig aber Feuchtigkeit aus dem BNC-Vlies in die Wunde abgegeben werden kann. Auch in trockener Form besteht eine sehr gute Wasserdampfdurchlässigkeit aufgrund der vorhandenen Hydroxyl-Gruppen. Die BNC hat zusätzlich eine Barrierefunktion gegen Mikroorganismen und mechanischen Stress. Im Feuchtverband trägt ein kühlender Effekt zum Gefühl der Schmerzreduktion bei.
BNC-Verbände reduzieren proteolytische Enzyme, Zytokine und reaktive Sauerstoffspezies. Komposite mit Kollagen reduzieren spezifisch Proteasen, Interleukine und zeigen eine antioxidative Eigenschaft. Typische Anwendungsbereiche sind leicht bis moderat exsudierende Wunden, Verbrennungen 2. Grades und Epithelialisierungen nach Operationen [6, 24].
BNC selbst hat keine antimikrobielle Aktivität. Durch Eintauchen in eine Silbernitratlösung und anschließende Reduktion konnten jedoch metallische Silber-Nanopartikel eingelagert werden. Die trockene, Silber-beladene BNC zeigte eine starke antimikrobielle Aktivität gegen Bakterien wie Escherichia coli (gramnegativ) und Staphylococcus aureus (grampositiv) [6].
BNC als Arzneistoffträger
Die kommerzielle Anwendung von BNC als Arzneistoffträgersystem beschränkt sich somit bisher auf einige wenige Beispiele. Die Drug-Delivery-Forschung erforscht die BNC als Arzneistoffträgersystem bisher nur im präklinischen Stadium. So wurden Lokalanästhetika und Analgetika zur Schmerztherapie und Entzündungshemmung auf der Haut in Form von gepressten BNC-Vliesen eingesetzt [30, 31]. Die Permeation von Lidocain aus BNC in die Haut war verzögert im Vergleich zu konventionellen Systemen wie Gelen oder wässrigen Lösungen. Die Einbettung des eher lipophilen Ibuprofen in die hydrophile BNC führte dagegen zu einer beschleunigten Freisetzung des Wirkstoffs in die Haut. Ein vakuumgetrockneter BNC-Film wurde als transdermales therapeutisches System für den Betablocker Propranolol beschrieben [32]. BNC-Aerogele, die mittels einer Antisolvent-Präzipitationstechnik mit überkritischem CO2 hergestellt worden sind, ermöglichten eine kontrollierte Freisetzung von Dexpanthenol und Vitamin C und konnten nach der Freisetzung sogar wiederbeladen werden [33]. Vancomycin- und Gentamicin-beladene BNC-Nanofasern wurden mit Polymethacrylaten zu Knochenzement verarbeitet [34]. Die Funktionalisierung von BNC mit Gelatine, Collagen, Alginaten und die Bildung von Kompositen mit Polyvinylalkohol oder Polymethylmethacrylaten, die das BNC-Netzwerk durchziehen oder als Multilayerschichten angeordnet werden, erlauben zusätzlich eine gezielte Veränderung der Materialeigenschaften und damit der Variation von Wirkstofffreisetzungsprofilen [5, 6].
Zusammenfassung
Bakterielle Nanocellulose ist ein ungewöhnliches Beispiel für ein mithilfe von Bakterien gewonnenes Biomaterial, das tatsächlich "heilen helfen" kann. Seine besonderen Materialeigenschaften, die Formenvielfalt und zahlreiche Modifizierungsmöglichkeiten machen es einsetzbar in vielen Bereichen von Medizin, Pharmazie, Kosmetik, Technik und Lebensmittelchemie und bedingen herausragende Vorteile in der Anwendung. Die flächendeckende Anwendung in Medizin und Pharmazie war bisher stark limitiert durch die fehlende Möglichkeit zur kontinuierlichen Herstellung von BNC und damit zur Massenproduktion, ein Problem, das mithilfe des HoLiR-Verfahrens gelöst werden kann. Die Pharmazie und Medizin haben seit einigen Jahren die BNC als biokompatibles Material entdeckt und nutzen sie als variabel einsetzbaren Arzneistoffträger und pharmazeutischen Hilfsstoff. Bakterielle Nanocellulose tritt ihren Siegeszug als innovatives natürliches Polymer für Forschung und Anwendung sowie als Hochleistungswerkstoff für Medizin und Technik an.
Literatur
[1] Klemm D, et al. Nanocelluloses: a new family of nature-based materials. Angew Chem, Int Ed 2011;50(24): 5438 – 5466.
[2] Brown AJ. On an acetic ferment which forms cellulose. J Chem Soc, Trans 1886;49:432 – 439.[3] Hestrin S, Schramm M. Synthesis of cellulose by Acetobacter xylinum. II. Preparation of freeze-dried cells capable of polymerizing glucose to cellulose. Biochem J 1954;58: 345 – 52.
[4] Jonas R, Farah LF. Production and application of microbial cellulose. Polym Degrad Stabil 1998;59(1-3):101 – 106.
[5] Klemm D, et al. Nanocelluloses as innovative polymers in research and application. Adv Polym Sci 2006;205 (Polysaccharides II):49 – 96.
[6] Klemm D, et al. Nanocellulose materials – different cellulose, different functionality. Macromol Symp 2009;280 (Novel Aspects of the Renewable Resource Cellulose): 60 – 71.
[7] Watanabe K, et al. Structural features and properties of bacterial cellulose produced in agitated-culture. Cellulose (London) 1998;5:187 – 200.
[8] Sani A, Dahman Y. Improvements in the production of bacterial synthesized biocellulose nanofibres using different culture methods. J Chem Technol Biotechnol 2010;85(2): 151 – 164.
[9] Onodera M, et al. Silicone rubber membrane bioreactors for bacterial cellulose production. Biotechnol Bioprocess Eng 2002;7:289 – 294.
[10] Bungay HR, Serafica GC. Production of microbial cellulose. Rensselaer Polytechnic Institute, USA, 2000.
[11] Klemm D, et al. Cellulose. BASYC, bacterially synthesized cellulose. Miniaturized tubes for microsurgery. Polym News 1999;24:377 – 378.
[12] Bodin A, et al. Bacterial cellulose as a potential meniscus implant. J Tissue Eng Regen Med 2007;1(5):406 – 408.
[13] Kralisch D, et al. White biotechnology for cellulose manufacturing – The HoLiR concept. Biotechnol Bioeng 2010;105:740 – 747.
[14] Heßler N, Klemm D. Alteration of bacterial nanocellulose structure by in situ modification using polyethylene glycol and carbohydrate additives. Cellulose 2009;16(5): 899 – 910.
[15] Iguchi M, et al. Bacterial cellulose – a masterpiece of Nature‘s arts. J Mater Sci 2000;35(2):261 – 270.
[16] Ammon HPT, et al. Improvement in the long-term stability of an amperometric glucose sensor system by introducing a cellulose membrane of bacterial origin. Anal Chem 1995; 67:466 – 71.
[17] Park HO, et al. Lactobacillus KCTC 0774BP and acetobacter KCTC 0773BP for treatment or prevention of obesity and diabetes mellitus. Bioneer Corp., 2004.
[18] Kim WJ. Preparing method of biocellulose pack containing ethanol-extracted propolis or water-extracted propolis for patient of sensitive skin and acnes. Propolis Co., Ltd., South Korea, 2007.
[19] Legendre J-Y. Film comprising a substrate containing biocellulose and a powdery cosmetic composition. L‘Oreal, 2009.
[20] Nakamura K. Supported vitamins useful for cosmetics or diet foods. 2008.
[21] Legendre JY. Article and device for diffusion of a perfume. L‘Oreal, 2008.
[22] Legendre JY. Product of make-up and/or care containing biocellulose and a dye. L‘Oreal, 2009.[23] Legendre JY. Nail polish process containing biocellulose. L‘Oreal, 2009.
[24] Czaja WK, et al. The future prospects of microbial cellulose in biomedical applications. Biomacromolecules 2007; 8(1):1 – 12.
[25] Klemm D, et al. Method and device for producing shaped microbial cellulose for use as biomaterial, especially for microsurgery. SurA Chemicals GmbH, 2001.
[26] Yamanaka S, et al. Production of hollow cellulose produced by microorganisms for artificial blood vessels. Ajinomoto Co., Inc., 1990.
[27] Petersen N, Gatenholm P. Bacterial cellulose-based materials and medical devices: current state and perspectives. Appl Microbiol Biotechnol 2011;91(5):1277 – 86.
[28] Czaja W, et al. Microbial cellulose – the natural power to heal wounds. Biomaterials 2006;27(2):145 – 151.
[29] BSN medical, Cuticell® Epigraft. Gebrauchsanweisung, 2010.[30] Trovatti E, et al. Biocellulose membranes as supports for dermal release of lidocaine. Biomacromolecules 2011;12: 4162 – 4168.
[31] Trovatti E, et al. Bacterial cellulose membranes applied in topical and transdermal delivery of lidocaine hydrochloride and ibuprofen: In vitro diffusion studies. Int J Pharm 2012 (im Druck).
[32] Bodhibukkana C, et al. Composite membrane of bacterially-derived cellulose and molecularly imprinted polymer for use as a transdermal enantioselective controlled-release system of racemic propranolol. J Contr Rel 2006;113:43 – 56.
[33] Haimer E, et al. Loading of bacterial cellulose aerogels with bioactive compounds by antisolvent precipitation with supercritical carbon Dioxide. Macromol Symp 2010; 294:64 – 74.
[34] Mori R, et al. Increased antibiotic release from a bone cement containing bacterial cellulose. Clin Orthop Relat Res 2011;469:600 – 6.
Autorinnen
Prof. Dr. Dagmar Fischer, Institut für Pharmazie, Otto-Schott-Straße 41, 07745 Jena, Dagmar.Fischer@uni-jena.de
Dr. Dana Kralisch, Institut für Technische Chemie und Umweltchemie, Lessingstraße 12, 07743 Jena






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.