
- DAZ.online
- DAZ / AZ
- DAZ 31/2012
- Neues Kombinationsprä...
Arzneimittel und Therapie
Neues Kombinationspräparat gegen Magenkarzinom
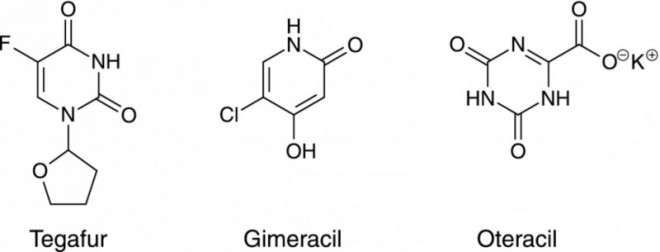
Das schon länger als Zytostatikum eingesetzte orale Fluoropyrimidin Tegafur ist ein Prodrug von 5-Fluorouracil (5-FU) mit guter oraler Bioverfügbarkeit.
Nach der Einname wird Tegafur schrittweise, hauptsächlich durch die CYP2A6-Enzymaktivität in der Leber, zu 5-FU umgewandelt. Dann wird es intrazellulär durch Phosphorylierung zu 5-Fluoro-deoxyuridin-Monophosphat (FdUMP) aktiviert. FdUMP und reduziertes Folat werden an die Thymidylatsynthase gebunden. Dieser Tertiärkomplex hemmt die DNA-Synthese. Zusätzlich wird 5-Fluorouridin-Triphosphat (FUTP) in die RNA integriert, was zu einer Störung der RNA-Funktionen führt.
Steckbrief: Tegafur/Gimeracil/OteracilHandelsname: Teysuno Hersteller: Nordic Pharma, Ismaning Einführungsdatum: 1. Juli 2012 Zusammensetzung: 1 Kapsel enthält 15 mg bzw. 20 mg Tegafur; 4,35 mg bzw. 5,8 mg Gimeracil und 14,7 mg bzw. 19,6 mg Oteracil-Kalium, entsprechend 11,8 mg bzw. 15,9 mg Oteracil. Sonstige Bestandteile: Kapselinhalt: Lactose-Monohydrat, Magnesiumstearat; Kapselhüllen: Gelatine, Eisen(III)-oxid (E172), Titandioxid (E171), Natriumdodecylsulfat, Talkum; Tinte: Eisen(III)-oxid (E172), Eisen(III)-hydroxid-oxid x H2 O (E172), Indigocarmin, Aluminiumsalz (E132), Carnaubawachs, Schellack, Glycerolmonooleat. Stoffklasse: Zytostatika, antineoplastische Mittel; Antimetaboliten. ATC-Code: L01BC53. Indikation: Für die Behandlung von fortgeschrittenem Magenkrebs bei Erwachsenen in Kombination mit Cisplatin. Dosierung: Standarddosis Teysuno® bei Gabe in Kombination mit Cisplatin: 25 mg/m2 (angegeben als Tegafurgehalt) zweimal täglich, morgens und abends, für 21 aufeinander folgende Tage gefolgt von einer siebentägigen Pause; dieser Behandlungszyklus wird alle vier Wochen wiederholt. Bei Unverträglichkeiten muss die Dosis von Teysuno® und Cisplatin entsprechend angepasst werden. Teysuno® sollte mindestens eine Stunde vor oder eine Stunde nach einer Mahlzeit mit Wasser eingenommen werden.
Gegenanzeigen: Schwere und unerwartete Nebenwirkungen gegen Fluoropyrimidin-Therapie in der Vorgeschichte; Mangel an Dihydropyrimidin-Dehydrogenase (DPD); Schwangerschaft und Stillzeit; schwere Knochenmarksuppression; Patienten mit terminaler dialysepflichtiger Niereninsuffizienz; gleichzeitige Gabe mit anderen Fluoropyrimidinen; Behandlung mit DPD-Hemmern innerhalb von vier Wochen, einschließlich Sorivudin oder chemisch verwandten Analoga wie Brivudin. Nebenwirkungen: Sehr häufig: Neutropenie, Leukopenie, Anämie, Thrombozytopenie; periphere Neuropathie; Anorexie; Diarrhö, Erbrechen, Übelkeit, Konstipation; Müdigkeit, Asthenie. Wechselwirkungen: Gleichzeitige Gabe anderer Fluoropyrimidine wie Capecitabin, 5-FU, Tegafur oder Flucytosin kann zu additiven Toxizitäten führen und ist kontraindiziert. Zwischen der Gabe von Teysuno® und anderen Fluoropyrimidinen wird eine Auswaschperiode von mindestens sieben Tagen empfohlen. Die gleichzeitige Gabe eines CYP2A6-Hemmers sollte vermieden werden, da dies die Wirksamkeit von Teysuno® herabsetzen kann. Warnhinweise und Vorsichtsmaßnahmen: Die Nierenfunktion muss engmaschig überwacht werden. Bei Patienten mit Niereninsuffizienz ist die renale Clearance von Gimeracil vermindert und somit die 5-FU-Exposition erhöht. Die Behandlung mit Teysuno® wird bei Patienten mit schwerer Nierenfunktionsstörung nicht empfohlen. |
Gimeracil erhöht Uracil-Konzentration
Gimeracil hemmt das Enzym Dihydropyrimidin-Dehydrogenase (DPD) in der Leber reversibel und selektiv. Die DPD ist das Hauptstoffwechselenzym für 5-FU und inaktiviert den größten Teil von 5-FU. Bei der Kombination mit Gimeracil wird eine höhere 5-FU-Plasmakonzentration erreicht.
Nach Gabe einer Einzeldosis von 800 mg Tegafur kommt es nicht zu ausgeprägten Veränderungen in den Uracil-Plasmakonzentrationen, wohingegen diese nach Gabe einer Einzeldosis von 50 mg Teysuno® deutlich anstiegen, was die DPD-Hemmung durch Gimeracil widerspiegelt. Die Werte der mittleren maximalen 5-FU-Plasmakonzentration (Cmax) und Fläche unter der Konzentration-Zeit-Kurve (AUC) waren nach Teysuno®-Gabe (50 mg Tegafur) ungefähr dreimal höher als nach der Gabe von Tegafur alleine (800 mg), was der Hemmung der Dihydropyrimidin-Dehydrogenase durch Gimeracil zugeschrieben wird. Maximale Plasmakonzentration von Uracil wurde nach vier Stunden beobachtet und erreichte innerhalb von rund 48 Stunden nach Gabe wieder Ausgangswerte, was auf die Reversibilität der DPD-Hemmung durch Gimeracil hinweist.
Oteracil schützt gesundes Darmgewebe
Oteracil, ein Orotat-Phosphoribosyl-Transferase-(OPRT)-Inhibitor, schwächt die Wirkung von 5-FU auf normales, nicht entartetes Gewebe im Darm ab und reduziert so die gastrointestinale Toxizität von 5-FU.
Ein Teil von Oteracil wird nicht-enzymatisch durch den Magensaft zu 5-Azauracil (5-AZU) abgebaut und dann im Darm zu Cyanursäure umgewandelt. In der Leber wird nur ein kleiner Teil von Oteracil metabolisiert. In Tierstudien wurde nach oraler Gabe Oteracil in hohen Konzentrationen im normalen Gewebe des Magen-Darm-Trakts verteilt, während deutlich niedrigere Konzentrationen in Blut und Tumorgewebe auftraten. Das pharmakokinetische Profil von 5-FU ist bei Anwesenheit und Abwesenheit von Oteracil ähnlich.
Therapie in mehreren Zyklen
Die Kombination aus Tegafur, Gimeracil und Oteracil wurde als Optimum auf ein Molverhältnis von 1: 0,4: 1 eingestellt. So soll sichergestellt werden, dass die 5-FU-Exposition aufrechterhalten und – bei gleichzeitiger Reduzierung der mit 5-FU verbundenen Toxizität – somit die Anti-Tumor-Aktivität erhalten wird.
von 1 : 0,4 : 1 eingestellt.
Nach einer Einzeldosis Teysuno® wurden ungefähr 3,8 bis 4,2% des gegebenen Tegafurs, 65 bis 72% des gegebenen Gimeracils und 3,5 bis 3,9% des gegebenen Oteracils unverändert mit dem Urin ausgeschieden.
Die empfohlene Standarddosis Teysuno® bei Gabe in Kombination mit Cisplatin ist 25 mg/m2 (angegeben als Tegafurgehalt) zweimal täglich, morgens und abends, für 21 aufeinander folgende Tage gefolgt von einer siebentägigen Pause.
Dieser Behandlungszyklus wird alle vier Wochen wiederholt. Bei Unverträglichkeiten muss die Dosis von Teysuno® und Cisplatin entsprechend angepasst werden.
Die Einnahme von Teysuno® mit einer Mahlzeit reduziert die Exposition gegen Oteracil und Gimeracil, wobei die Wirkung für Oteracil ausgeprägter ist. Teysuno® sollte daher mindestens eine Stunde vor oder eine Stunde nach einer Mahlzeit mit Wasser eingenommen werden.
Gut wirksam in der Zulassungsstudie
Die Zulassung beruht auf den Ergebnissen von FLAGS (First-Line Advanced Gastric Cancer Study), der bislang größten internationalen Phase-III-Studie an Patienten mit fortgeschrittenem Magenkrebs. Diese Studie hat gezeigt, dass eine Kombinationstherapie mit Teysuno® und intravenös verabreichtem Cisplatin genauso wirksam ist wie eine Vergleichstherapie mit 5-Fluorouracil/Cisplatin i. v., dabei aber ein deutlich besseres Sicherheitsprofil aufweist, sowohl bei hämatologischen als auch nicht-hämatologischen Nebenwirkungen. Auffällig war, dass kein Hand-Fuß-Syndrom Grad 3 bis 4 berichtet wurde.
Teysuno® wurde in Japan im Jahr 1999 zugelassen und wird dort seither von Taiho Pharmaceutical Co., Ltd. vermarktet. Bis heute wurde das Kombinationspräparat bei über 870.000 Patienten in Japan und Asien angewendet.
In Japan wurde das Präparat bereits für sechs weitere Indikationen zugelassen, nämlich für die Behandlung von Krebs im Kopf- und Halsbereich, Kolorektalkarzinom, nicht-kleinzelligem Lungenkrebs sowie nicht operierbarem oder rezidivierendem Brust-, Bauchspeicheldrüsen- und Gallentraktkrebs.
Neben- und Wechselwirkungen
Zu den sehr häufigen Nebenwirkungen gehören Neutropenie, Leukopenie, Anämie, Thrombozytopenie; periphere Neuropathie; Anorexie; Diarrhö, Erbrechen, Übelkeit, Konstipation; Müdigkeit, Asthenie.
Kontraindikationen sind schwere und unerwartete Nebenwirkungen gegen eine Fluoropyrimidin-Therapie in der Vorgeschichte; Mangel an Dihydropyrimidin-Dehydrogenase (DPD); Schwangerschaft und Stillzeit; schwere Knochenmarksuppression; Patienten mit terminaler dialysepflichtiger Niereninsuffizienz; gleichzeitige Gabe mit anderen Fluoropyrimidinen; Behandlung mit DPD-Hemmern innerhalb von vier Wochen, einschließlich Sorivudin oder chemisch verwandte Analoga wie Brivudin.
Die gleichzeitige Gabe anderer Fluoropyrimidine wie Capecitabin, 5-FU, Tegafur oder Flucytosin kann zu additiven Toxizitäten führen und ist kontraindiziert. Zwischen der Gabe von Teysuno® und anderen Fluoropyrimidinen wird eine Auswaschperiode von mindestens sieben Tagen empfohlen.
Sorivudin oder seine chemisch verwandte Analoga wie Brivudin hemmen die Dihydropyrimidin-Dehydrogenase irreversibel, was zu einem signifikanten Anstieg der 5-FU-Exposition führt; dies kann zu klinisch signifikanten Fluoropyrimidin-bedingten Toxizitäten mit potenziell tödlichem Ausgang führen; daher darf Teysuno® nicht zusammen mit Sorivudin oder Brivudin angewendet werden. Die gleichzeitige Gabe eines CYP2A6-Hemmers sollte vermieden werden, da dies die Wirksamkeit von Teysuno® herabsetzen kann.
Nierenfunktion muss überwacht werden
Die Behandlung mit Teysuno® in Kombination mit Cisplatin kann mit einem transienten Abfall der glomerulären Filtrationsrate einhergehen, daher muss die Nierenfunktion engmaschig überwacht werden. Gimeracil wird in erster Linie durch die Nieren ausgeschieden; daher ist bei Patienten mit Niereninsuffizienz die renale Clearance von Gimeracil vermindert und somit die 5-FU-Exposition erhöht. Mit erhöhter 5-FU-Exposition kann mit einer Erhöhung der therapiebedingten Toxizitäten gerechnet werden.
Die Behandlung mit Teysuno® wird bei Patienten mit schwerer Nierenfunktionsstörung aufgrund der möglicherweise höheren Inzidenz unerwünschter Ereignisse auf das blutbildende und das lymphatische System und der Möglichkeit einer unerwartet höheren 5-FU-Exposition als Folge von Schwankungen der Nierenfunktion nicht empfohlen, es sei denn, die Vorteile einer Behandlung überwiegen die Risiken deutlich.
Quelle EPAR Summary for the Public: Teysuno (draft). EMA/467/2011, EMEA/H/C/001242. London, UK: European Medicines Agency, Stand Januar 2011.
hel




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.