
- DAZ.online
- DAZ / AZ
- DAZ 30/2012
- Hygienetest
Qualität
Hygienetest

Sehr lange wurde sie mit Spannung erwartet und jetzt ist sie in Kraft getreten – die neue Apothekenbetriebsordnung (ApBetrO). Damit wird erstmals die schriftliche Erstellung eines Hygieneplans für das Personal und die Betriebsräume sowie die regelmäßige Dokumentation der durchgeführten Reinigungs- und Desinfektionsmaßnahmen in der Apotheke zur Pflicht. Natürlich ist davon auszugehen, dass bisher in allen Apotheken Hygienemaßnahmen – wenn auch in unterschiedlicher Art und Weise – vorgenommen wurden. Eine umfassende Planung, Dokumentation und Kontrolle, wie sie die ApBetrO fordert, wurde aber wohl eher nur bei einer Minderheit an Apotheken durchgeführt.
Die Erstellung eines Hygieneplans und die zugehörige Dokumentation bedeuten sicherlich einen Mehraufwand an Zeit und Kosten. Dennoch ist diese Neuerung der ApBetrO zu begrüßen, bedenkt man die hohen Anforderungen, die das Europäische Arzneibuch (Ph. Eur.) an die mikrobiologische Qualität von Arzneimitteln stellt. Die zulässigen Keimzahlen variieren je nach Darreichungsform bzw. vorgesehener Anwendung (siehe Tab. 1). Für in der Apotheke hergestellte Arzneimittel gelten trotz ungleicher Rahmenbedingungen dieselben Grenzwerte wie für industriell produzierte Fertigarzneimittel.
Tab. 1: Akzeptanzkriterien für die mikrobiologische Qualität nicht steriler Darreichungsformen nach | |||
Anwendung der Darreichungsform |
TAMC KBE/g od. ml |
TYMC KBE/g od. ml |
Spezifizierte Mikroorganismen |
Nicht wässrige Zubereitungen zum Einnehmen |
103
|
102
|
Abwesenheit von E. coli (1 g oder ml) |
Wässrige Zubereitungen zum Einnehmen |
102
|
101
|
Abwesenheit von E. coli (1 g oder ml) |
Rektale Anwendung |
103
|
102
|
|
Anwendung in der Mundhöhle, am Zahnfleisch, in der Nase, am Ohr oder kutan |
102
|
101
|
Abwesenheit von Staph. aureus und Ps. aeruginosa (1 g oder ml) |
Vaginale Anwendung |
102
|
101
|
Abwesenheit von Staph. aureus, Ps. aeruginosa und C. albicans (1 g oder ml) |
Transdermale Pflaster |
102
|
101
|
Abwesenheit von Staph. aureus und Ps. aeruginosa (1 Pflaster**) |
Anwendung durch Inhalation* |
102
|
101
|
Abwesenheit von Staph. aureus, Ps. aeruginosa und Gallensalze tolerierenden gramnegativen Bakterien (1 g oder ml) |
* spezielle Anforderungen für flüssige Zubereitungen zur Zerstäubung
** einschließlich der Haft- und Trägerschicht
Dies macht besonders deutlich, welche große Eigenverantwortung auf jeder einzelnen Apotheke ruht. Es müssen ausreichende Maßnahmen getroffen werden, um sicherzustellen, dass nur mikrobiologisch einwandfreie Arzneimittel an den Patienten abgegeben werden. Die möglichst genaue Beschreibung und schriftliche Festlegung der durchzuführenden Reinigungs- und Desinfektionsschritte führt zu einer Reproduzierbarkeit der Vorgänge. Das Führen von Checklisten zur Dokumentation der erledigten Arbeiten führt zu einer besseren Nachvollziehbarkeit und damit zu einem Gewinn an Sicherheit für die Apotheke und auch den Patienten.
Eine Momentaufnahme des Hygienestatus in 100 Apotheken der Bundesrepublik hat das ZL während des ersten Rezeptur-Ringversuches 2011 erhoben. Einmal jährlich ermöglicht das ZL interessierten Apotheken, für eine der drei Testrezepturen zusätzlich die mikrobiologische Qualität überprüfen zu lassen. Hierbei müssen die Apotheken in der Regel neben der wirkstoffhaltigen Zubereitung, die im Rezeptur-Ringversuch getestet wird, noch eine bestimmte Menge der wirkstofffreien, selbst frisch hergestellten und unkonservierten Grundlage einsenden. Bei selbst hergestellten Cremegrundlagen ist das Einarbeiten von Aqua purificata, des in mikrobieller Hinsicht kritischsten Ausgangsstoffs bei der Rezepturherstellung, erforderlich.
Betriebshygienemonitoring
Die Rezeptur des ersten Rezeptur-Ringversuchs 2011 war „Metronidazol 2,0% in Wasserhaltiger Hydrophiler Salbe DAB“. Von den insgesamt 1824 Apotheken, die an diesem Ringversuch teilnahmen, meldeten sich 518 für die Untersuchung der wirkstofffreien Grundlage an. Von diesen Apotheken nahmen 100 an einem zusätzlichen Umgebungsmonitoring in ihren Räumlichkeiten teil.
Material und Methoden
Die mikrobiologische Prüfung des Keimstatus der wirkstofffreien Grundlage gliederte sich in die Zählung der gesamten vermehrungsfähigen Mikroorganismen gemäß Ph. Eur. 7.0, 2.6.12 und dem Nachweis spezifizierter Mikroorganismen gemäß Ph. Eur. 7.0, 2.6.13.
Gemäß Ph. Eur. 7.0, 5.1.4 müssen für Zubereitungen zur kutanen Anwendung folgende Anforderungen erfüllt sein:
- Gesamtanzahl aerober Mikroorganismen (TAMC) max. 102 KBE / g (ml),
- Gesamtanzahl an Hefen und Schimmelpilzen (TYMC) max. 101 KBE / g (ml),
- Abwesenheit von Pseudomonas aeruginosa und Staphylococcus aureus.
Die TAMC ist die Anzahl aller Kolonien von Mikroorganismen (Bakterien, Hefen, Pilze), die sich auf einem Agarmedium mit Casein- und Sojapepton bei einer Bebrütungstemperatur von 30 bis 35 °C für 3 bis 5 Tage entwickeln. Die TYMC ist die Anzahl der Hefe- und Pilzkolonien, die nach einer Inkubation bei 20 bis 25 °C für 5 bis 7 Tage auf einem Sabouraud-Glucose-Agarmedium gezählt werden; werden auch Bakterienkolonien auf diesem Medium nachgewiesen, werden sie mitgezählt. Die Grenzwerte werden nach Ph. Eur. so interpretiert, dass 101 gezählte KBE einer maximal annehmbaren Anzahl von 20 KBE und 102 gezählte KBE maximal 200 KBE entsprechen, das heißt, es wird mit dem Faktor 2 multipliziert.
Die Überprüfung der wirkstofffreien Grundlagen erfolgte extern in einem mikrobiologischen Labor.
Um den Hygienestatus des Produktionsumfeldes zu ermitteln, wurden Oberflächen-Abklatschtests an folgenden Stellen durchgeführt:
- Handinnenfläche
- Kittelvorderseite
- Waage
- Arbeitsfläche
- Regal (Nähe Herstellungsbereich)
- Boden
Verwendet wurden Agarplatten mit Enthemmer zur Inaktivierung von Desinfektionsmittelrückständen (Art. 234e, CaSo-Agar LTH-RT, Ø 55 mm: Casein-Sojamehl-Pepton-Agar, Inaktivierungsmittel Lecithin, Tween 80, Histidin; Fa. heipha Dr. Müller GmbH, Eppelheim). CaSo-Agar ist ein universelles Komplexmedium, das zur Anzüchtung von anspruchsvollen Bakterien, Hefen und Schimmelpilzen geeignet ist. 60 Apotheken erhielten die Materialien und Gebrauchsanweisungen per Post, führten die Probensammlung selbst durch und sendeten die Platten zur Untersuchung an die Firma Caelo zurück. Die restlichen 40 Apotheken (im Umkreis von 150 km um Bonn) wurden von Firmenmitarbeitern besucht. Hier wurde zusätzlich zu den Abklatschtests eine Bestimmung der Luftkeimzahl in der Offizin (normaler Kundenverkehr), in der Rezeptur (in Abwesenheit von Personal) und – wenn vorhanden – in der Laminar-Air-Flow-Werkbank (Betriebszustand) mittels Impact-Verfahren durchgeführt. Beim Impact-Verfahren wird eine definierte Luftmenge durch den perforierten Deckel des Luftkeimsammelgerätes eingesaugt (Gerät MAS 100; Fa. Merck Millipore). Dort prallen die in der Luft enthaltenen Teilchen auf einen zuvor eingelegten Nährboden auf. Es wurde ein Probenvolumen von 100 Litern (entsprechend einer Minute Ansaugzeit) gesammelt. Eingesetzt wurden ebenfalls Agarplatten, die für hohe Sammelvolumina und lange Inkubationszeiten geeignet sind (Art. 03074e, CaSo-Agar LI, Ø 90 mm; Fa. heipha Dr. Müller GmbH, Eppelheim).
Die Bebrütung der Platten erfolgte bei 20 bis 25 °C für 5 bis 7 Tage zum Nachweis von Hefen und Schimmelpilzen sowie bei 30 bis 35 °C für 2 bis 3 Tage zum Erfassen von aeroben Mikroorganismen. Zur Auswertung wurden die sichtbaren Kolonie-bildenden Einheiten (KBE) pro Platte gezählt.
Ergebnisse für die Prüfung der wirkstofffreien Grundlage
510 der 518 geprüften Zubereitungen (98,5%) entsprachen den Anforderungen für kutane Zubereitungen nach Ph. Eur. Alle Proben waren frei von Staphylococcus aureus und Pseudomonas aeruginosa.
Bei den acht Zubereitungen, die die Vorgaben nicht erfüllten, gab es folgende Mängel: Eine Zubereitung zeigte eine leicht erhöhte Gesamtzahl der aeroben Mikroorganismen (TAMC: < 400 KBE/g), fünf weitere zeigten eine stark erhöhte TAMC (1000 – 9000 KBE/g). In einer Zubereitung wurde die zulässige Gesamtanzahl an Hefen und Schimmelpilzen (TYMC) mäßig überschritten (< 200 KBE/g). In einer Zubereitung schließlich wurden sowohl für die TAMC als auch für die TYMC massiv erhöhte Werte ermittelt, wie sie z. B. entstehen können, wenn ein aus Mikroorganismen bestehender Biofilm, der sich an der Grenzfläche zwischen Wasser und einem festen Medium wie in Rohrleitungen, Schläuchen oder an Gefäßböden und ‑wänden bilden kann, abreißt und in das Produkt gelangt.
Über die Ursachen für die Keimbelastungen dieser acht Rezepturen können nur Vermutungen angestellt werden. Nicht immer sind unzureichende Hygienemaßnahmen für die Kontamination einer Rezeptur verantwortlich, sondern häufig ist die Qualität des eingesetzten Wassers entscheidend. Diese hängt von der Herstellungsmethode (Destillation oder Ionenaustauschverfahren) und insbesondere von den Aufbewahrungsbedingungen (Gefäß, Lagerung, Zeit bis zur Verwendung) ab. Sechs der acht Zubereitungen enthielten Aqua purificata, das in der jeweiligen Apotheke mittels Ionenaustauschverfahren hergestellt worden war. Ionenaustauscherharze sind anfällig für mikrobielle Verkeimung, weshalb diese Methode ein hygienisch nicht einwandfreies Wasser liefert, das vor der Verwendung noch antimikrobiell behandelt werden muss. Entweder muss es frisch aufgekocht werden und fünf Minuten lang abgedeckt sieden, oder es muss ein täglich zu wechselnder bakterienzurückhaltender Filter der maximalen Porenweite 0,2 µm bzw. 0,22 µm (entsprechend Ph. Eur. 5.1.1 Methoden zur Herstellung steriler Zubereitungen) angeschlossen werden.
Kriterien für das Hygienemonitoring
Für das Umgebungsmonitoring stellt sich zunächst die Frage, welche Keimgrenzwerte akzeptabel sind. Diese Entscheidung ist nicht leicht zu treffen, da es für die nicht-sterile Herstellung in der Apotheke keine verbindlichen Vorgaben gibt.
Fixe Akzeptanzkriterien sind nur für die vier Reinraumklassen A bis D zur Sterilherstellung gemäß EG-Leitfaden der Guten Herstellungspraxis (GMP) definiert [1]. Für die nicht-sterile Herstellung hat Hanfried Seyfarth die Klassen E und F vorgeschlagen (Tab. 2) [2]. Die Klasse E steht hierbei für die Herstellung von flüssigen und halbfesten Zubereitungen, die Klasse F für feste Arzneiformen.
Tab. 2: Grenzwerte für die Keimbelastung von Luft und Oberflächen bei der Herstellung nicht-steriler Zubereitungen nach einem Vorschlag von Seyfahrth [2] | ||||
Bereich |
Tisch, Maschine
(KBE/25 cm2)
|
Wand
(KBE/25 cm2)
|
Boden
(KBE/25 cm2)
|
Luft (KBE/m3) |
|
Klasse E*
~, produktberührende Teile
|
100
10
|
100
–
|
100
–
|
400 |
|
Klasse F**
~, produktberührende Teile
|
200
10
|
200
–
|
200
–
|
1000 |
* Herstellung halbfester und flüssiger Darreichungsformen
** Herstellung von Tabletten, Kapseln und Dragees
Eine weitere Empfehlung für Luftuntersuchungen existiert im Aide mémoire 07121105 "Inspektion von Qualifizierung und Validierung in pharmazeutischer Herstellung und Qualitätskontrolle" der Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (Tab. 3).
Tab. 3: Mikrobiologische Luftqualität in Produktionsräumen für nicht-sterile Arzneimittel nach Aide mémoire | |||
Bereich |
Grenzwerte im Betriebszustand (KBE/m3) |
Grenzwerte im Ruhezustand (KBE/m3) |
|
Warngrenze |
Aktionsgrenze |
||
Klasse E* |
250 |
500 |
100 |
Klasse F* |
500 |
800 |
400 |
* Herstellung halbfester und flüssiger Darreichungsformen
** Herstellung von Tabletten, Kapseln und Dragees
Die in Tabelle 3 angegebenen Grenzwerte werden z. B. für die Inspektion von Pharmafirmen, die nicht-sterile Arzneimittel produzieren, angewendet. Das Erreichen einer Warngrenze zeigt eine Abweichung vom gewünschten Status an. Da möglicherweise ein Problem vorliegt, sollte verstärkte Aufmerksamkeit folgen und ggf. Gegenmaßnahmen eingeleitet werden. Überschreitet der Wert eine Aktionsgrenze, bedeutet dies immer unmittelbaren Handlungsbedarf.
Bei einem Übertrag der in Pharmafirmen empfohlenen Grenzwerte auf die Apotheke bleibt zu bedenken, dass dort eine vollkommen unterschiedliche Ausgangssituation vorliegt. In der Apothekenrezeptur werden Arzneimittel für einzelne Patienten hergestellt, nicht für ein großes Kollektiv. Es werden generell kürzere Aufbrauchfristen festgelegt, und die Herstellung erfolgt immer durch qualifiziertes Personal. Insofern ist davon auszugehen, dass eine weniger strenge Beurteilung möglich ist.
Mikrobielle Reinheit der Luft
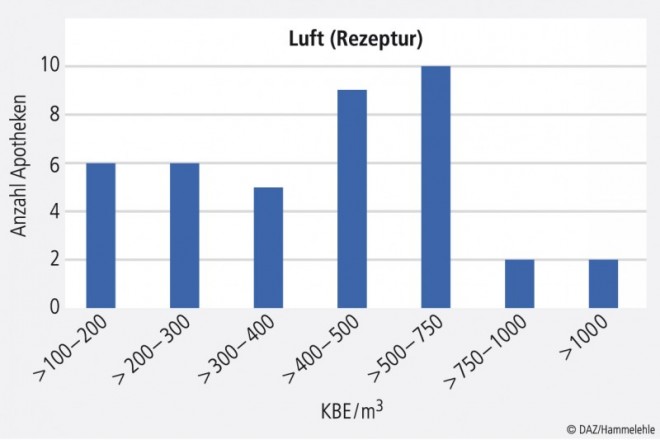
Die Luft im Apothekenlabor entspricht in der Regel der Umgebungsluft, da in der Apotheke keine speziellen raumlufttechnischen Anlagen zur Belüftung verwendet werden. Der empfohlene Aktionsgrenzwert liegt in der Raumklasse E gemäß Aide mémoire (s. o.) bei 500 KBE/m3 Luft im Betriebszustand. Von 40 Apotheken lagen 24 (teilweise deutlich) unter diesem Wert. Zehn Apotheken wiesen eine erhöhte Keimzahl zwischen 500 und 750 KBE/m3 Luft auf, und vier Apotheken zeigten eine relativ hohe Keimzahl; diese sollten ihr Belüftungskonzept optimieren (Abb. 1). Generell sollte die Rezeptur mindestens an drei Seiten mit raumhohen Wänden von der Offizin abgetrennt sein, und die Klimaanlagen sollten regelmäßig gewartet werden, damit sie nicht selbst zu Keim- und Staubschleudern werden.
In zwei der getesteten Apotheken war eine Laminar-Air-Flow-Werkbank vorhanden. Hier konnte kein Wachstum von Bakterien, Hefen und Schimmelpilzen nachgewiesen werden. Dies entspricht der Anforderung für die Reinraumklasse A gemäß GMP-Leitfaden, die bei der Anfertigung von sterilen Zubereitungen für die aseptische Herstellung bzw. Arbeitsvorgängen mit hohem Risiko gilt.
Mikrobielle Reinheit der Oberflächen
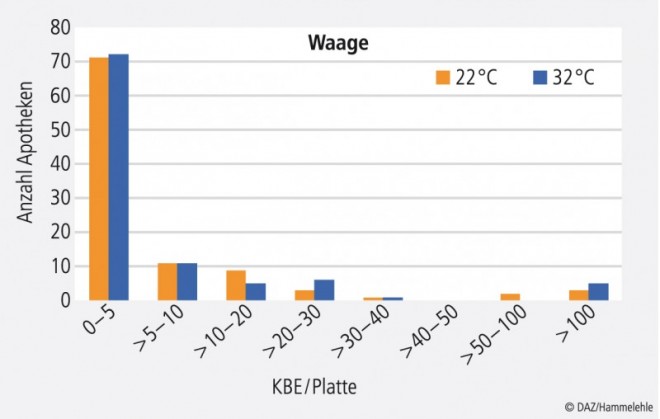
Sehr gute Ergebnisse wurden bei der Überprüfung des Hygienestatus der Waagen erhalten (Abb. 2). Mehr als 90% der Apotheken erfüllten hier die Forderung von maximal 100 KBE pro Platte, die für nicht direkt Produkt-berührende Teile, wie die Waage, gilt. 80% blieben hier sogar im Bereich von maximal 10 KBE pro Platte, der für direkt Produkt-berührende Teile gilt.
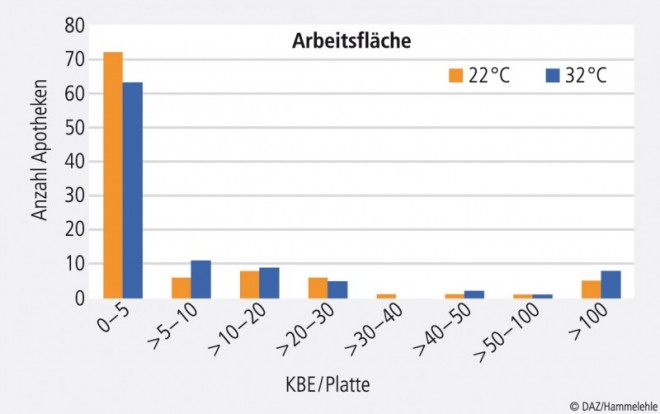
Die Überprüfung der Arbeitsflächen zeigte ebenfalls sehr gute Ergebnisse. 90% der Apotheken erfüllten hier die Forderung von maximal 100 KBE pro Platte (Abb. 3).
Die Apotheken mit erhöhten Keimzahlen für den Wägeteller oder die Arbeitsfläche sollten die eingesetzte Reinigungs- und Desinfektionsmethode überprüfen. Wichtig ist, dass bei der Reinigung nur Utensilien zum einmaligen Gebrauch verwendet werden, um z. B. eine Rekontamination durch verkeimte Putztücher zu vermeiden, und dass ein geeignetes Desinfektionsmittel zum Einsatz kommt, z. B. Isopropanol 70% (V/V) oder andere Stoffe aus der Desinfektionsmittelliste des VAH (Verbund für Angewandte Hygiene).
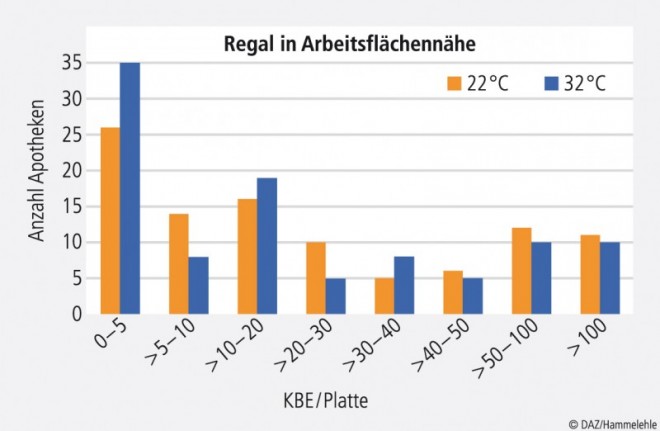
Die Ergebnisse der Überprüfung von Regalen in der Nähe, z. B. an der Wand über der Arbeitsfläche oder der Tür von verschlossenen Regalen zeigten eine breitere Streuung der Keimzahlen als bei den Waagen und Arbeitsflächen (Abb. 4). Jedoch wird auch hier die Forderung von maximal 100 KBE pro Platte von knapp 90% der Apotheken erfüllt. Generell sind geschlossene Regale zu bevorzugen, da sich hier weniger Staub ablagern kann. Offenporige Materialien in der Rezeptur, wie z. B. Regale oder Schränke aus Holz, sind nicht akzeptabel, da hier keine ausreichende Desinfektion erreicht werden kann.
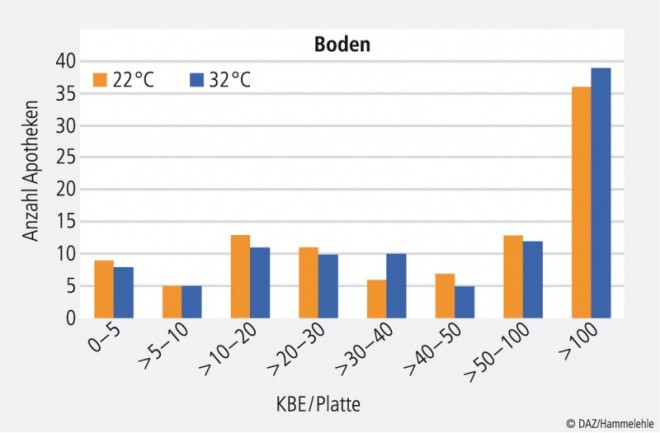
Die beim Abklatschtest des Bodens gefundenen Keimzahlen lagen bei zwei Dritteln der getesteten Apotheken unterhalb des Grenzwertes von maximal 100 KBE pro Platte (Abb. 5). Der Boden in der Rezeptur sollte möglichst glatt und fugenfrei sein, um eine gute Reinigung zu ermöglichen. Feinste Ritzen oder Risse in Wand- und Bodenbelägen stellen potenzielle Keimherde dar. Besonderes Augenmerk muss – wie auch bei der Arbeitsfläche – auf die zur Reinigung verwendeten Utensilien gelegt werden.
Neben einer mangelhaften Reinigung kann das Schuhwerk des Apotheken- oder Reinigungspersonals eine weitere Ursache für eine hohe Keimzahl auf dem Boden sein. Stark verdreckte Straßenschuhe sollten nicht in der Rezeptur getragen werden. Sofern es in der Praxis gut umsetzbar ist, empfiehlt sich das Tragen von eigens dafür bereitgestellten Schuhen während der Arbeitszeit in der Apotheke.
Das Kontaminationsrisiko durch den Boden z. B. durch ein Hochwirbeln von keimbelasteten Partikeln ist jedoch als gering einzustufen. Es sollte allerdings darauf geachtet werden, dass nichts auf dem Boden abgestellt wird, was als Staubfänger dienen und bei einem Zurückstellen auf die Arbeitsfläche zur Keimverschleppung beitragen kann.
Monitoring des Personals
Zur Beurteilung von Abklatschtests der Handinnenfläche bzw. von 5-Finger-Prints stehen in der Literatur nur Werte für die Reinraumklassen A und B zur Verfügung (< 1 KBE/Platte bzw. 5 KBE/Platte). Daher wurden für die Beurteilung der in den Apotheken erhobenen Daten Erfahrungswerte der Firma Caelo zugrunde gelegt.
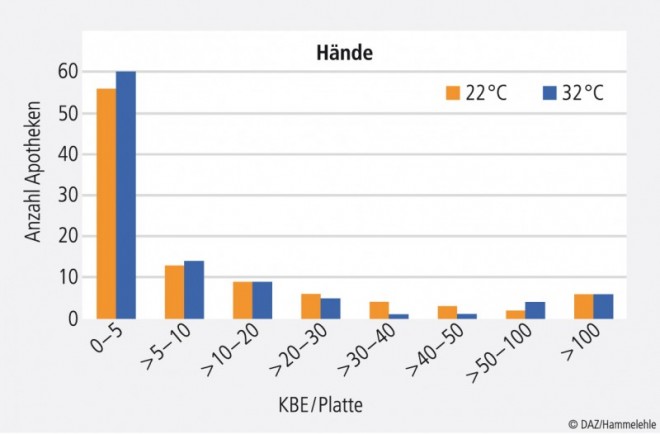
Weniger als 10 KBE pro Platte sind typische Werte für desinfizierte Hände; sie wurden bei ca. 70% der getesteten Personen gefunden. Gut gewaschene Hände und nicht vollständig desinfizierte Hände weisen Werte von ca. 10 bis 30 KBE pro Platte auf; sie fanden sich bei gut 10% der getesteten Apotheken (Abb. 6). Höhere Keimzahlen zeigen ungewaschene oder schlecht desinfizierte Hände an. Teilweise wurden stark unterschiedliche Werte für den Abklatsch der rechten und der linken Hand derselben Person gefunden, was darauf hindeutet, dass Fehler bei der Händedesinfektion gemacht wurden, z. B. eine Hand nicht ausreichend mit dem Desinfektionsmittel benetzt wurde. Die korrekte Händedesinfektion ist in der DIN EN 1500 beschrieben. Poster mit anschaulichen Darstellungen sind von vielen Desinfektionsmittelherstellern kostenlos erhältlich. Im Rahmen von mindestens einmal im Jahr durchzuführenden Personalschulungen zum Thema Hygiene ist auf die richtige Vorgehensweise hinzuweisen.
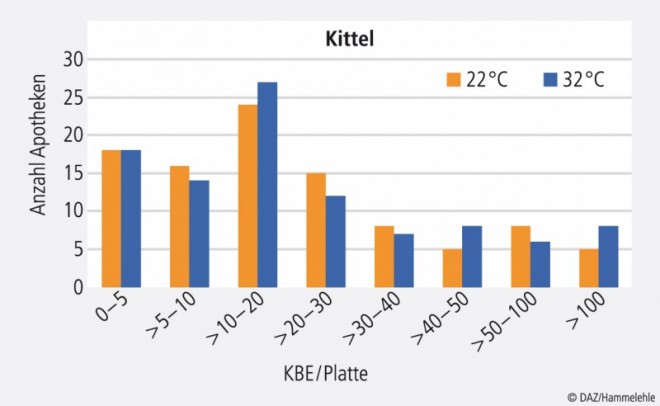
Beim Test der Kittel stuft die Firma Caelo Werte bis ca. 40 KBE pro Platte als sauber ein. Werte darüber können punktuelle Verunreinigungen, aber auch einen allgemein nicht mehr akzeptablen Zustand des Kittels anzeigen. Teilweise hat das Personal keine Kittel getragen. In diesen Fällen wurde der Abklatsch an der Oberbekleidung genommen. Für ca. 75% aller Proben wurden zufriedenstellende Ergebnisse erhalten. Bei 25% wurden leicht bis stärker erhöhte Werte gefunden (Abb. 7).
Der Kittel für die Rezeptur sollte nur im Herstellungsbereich getragen werden, nicht zusätzlich im Handverkauf, wo Kontaminationsgefahren lauern. Der Kittel kann z. B. aus Baumwolle sein. Er sollte möglichst keine Außentaschen haben, einen Stehkragen, enge Bündchen an den Ärmeln und muss selbstverständlich geschlossen getragen werden. Mindestens einmal pro Woche sollte der Kittel gewechselt werden.
Fazit
Zusammenfassend kann festgestellt werden, dass der durchschnittliche Hygienestatus an den Rezepturarbeitsplätzen der getesteten Apotheken als gut bezeichnet werden kann und größtenteils den Empfehlungen für die Klassen E und F zur nicht-sterilen Herstellung gemäß Seyfarth entspricht. In den Fällen, in denen die Grenzwerte überschritten wurden, sollten die Probleme durch kleine Veränderungen in der Arbeitsroutine, wie z. B. korrekt durchgeführte Händedesinfektion, häufigerer Kittelwechsel, ggf. Vermeidung von Straßenschuhen im Labor, Wechsel der Reinigungsutensilien, gelöst werden können. Ein Fokus ist auf die Belüftung der Räumlichkeiten zu legen. Unter anderem sollten die Klimaanlagen regelmäßig gewartet werden.
Zur Erstellung eines Hygienemanagementsystems für die eigene Apotheke und zur regelmäßigen Selbstinspektion eignen sich hervorragend die Leitlinie „Hygienemanagement“ der Bundesapothekerkammer samt Kommentar und Arbeitshilfen sowie der Hygieneleitfaden der Gesellschaft für Dermopharmazie. Weiterhin empfiehlt sich neben der Teilnahme an Ringversuchen zur Qualitätssicherung der Rezepturen eine regelmäßige externe Qualitätskontrolle des gereinigten Wassers, wenn dieses selbst hergestellt wird.
Literaturtipp
Egal ob Rezeptur, Labor oder Handverkauf – ein einwandfreier hygienischer Zustand dient dem Patienten- und Mitarbeiterschutz gleichermaßen. Der Ordner Hygienemanagement leitet Sie einfach und ohne Umschweife durch das Dickicht der Hygiene-Leitlinien. Der Musterhygieneplan sowie die Hygieneanweisungen für verschiedene Arbeitsbereiche können direkt übernommen und mühelos an die individuelle Situation Ihrer Apotheke angepasst werden. Mit den vorgefertigten Protokollen und Abzeichnungslisten gelangen Sie auf geradem Weg zu einem funktionierenden Hygienemanagement, das den aktuellen Standards für Apotheken entspricht. Mithilfe der Mitarbeiterschulung machen Sie Ihre Angestellten bequem mit dem Hygienekonzept Ihres Betriebs vertraut und gewährleisten so die Qualität Ihrer Produkte und Dienstleistungen gemäß den gesetzlichen Vorgaben.
Hygiene gehört zur Apotheke wie das rote A über der Eingangstür.
Hygienemanagement nach ApBetrO Selbstinspektion, Musterpläne, Schulung, Dokumentation
2. Auflage einschließl. 1. Akt.-Lfg. Loseblatt, 1 Ringordner, 39,90 Euro
Deutscher Apotheker Verlag, Stuttgart 2012ISBN 978-3-7692-5874-5
Dieses Buch können Sie einfach und schnell bestellen
unter der Postadresse:
Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart
oder im Internet unter: www.buchoffizin.de
oder per Telefon unter: (07 11) 25 82 - 3 41 oder- 3 42
Quellen[1] Anhang 1 zum EG-Leitfaden der Guten Herstellungspraxis: Herstellung steriler Arzneimittel. BAnz. v. 12.3.2008. [2] Seyfarth H. Mikrobiologisches Monitoring Teil 6: Monitoring in Betrieben zur Herstellung nichtsteriler Arzneimittel. Pharm Ind 2010; 72(5):897 – 904.
Kontakt Zentrallaboratorium Deutscher Apotheker Carl-Mannich-Str. 20, 65760 Eschborn www.zentrallabor.com
DAZ 2012, Nr. 30, S. 52





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.