
- DAZ.online
- DAZ / AZ
- DAZ 29/2012
- Neues Antiepileptikum ...
Arzneimittel und Therapie
Neues Antiepileptikum Perampanel
Mit neuem Therapieprinzip zu weniger Anfällen
Nur knapp die Hälfte aller Patienten mit neu diagnostizierter Epilepsie wird unter einer Monotherapie anfallsfrei, etwa ein Drittel aller Patienten gilt als therapieresistent. Es werden daher neue Antiepileptika bzw. Targets benötigt.
Exzitatorischer Neurotransmitter Glutamat als Target
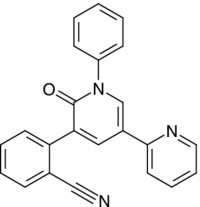
Der Wirkmechanismus von Perampanel unterscheidet sich von dem anderer gebräuchlicher antiepileptischer Wirkstoffe und bietet damit ein neues Therapieprinzip zur Behandlung der Epilepsie. Perampanel blockiert die postsynaptischen AMPA-Glutamat-Rezeptoren hochselektiv und nicht-kompetitiv und hemmt damit die durch den AMPA-Rezeptor vermittelte exzitatorische Neurotransmission. Damit zielt es selektiv auf die Transmission von Anfällen ab. AMPA steht für Alpha-amino-3-hydroxy-5-methyl-4-isoxazol-Säure. AMPA-Rezeptoren, die weithin in fast allen exzitatorischen Neuronen vorhanden sind, übertragen Signale, die vom Neurotransmitter Glutamat im Gehirn angeregt werden. Es wird davon ausgegangen, dass sie eine Rolle bei Erkrankungen des zentralen Nervensystems spielen, die sich durch übermäßige neuroexzitatorische Signalbildung auszeichnen, unter anderem Epilepsie, neurodegenerative Erkrankungen, Bewegungsstörungen, Schmerzen und psychiatrische Störungen.
Perampanel wird einmal täglich in einer Dosis von 2 bis 8 mg eingenommen.
Der neue Wirkstoff konnte eine Wirksamkeit in der Reduktion von Anfällen in Studien der Phasen II und III demonstrieren. Der CHMP gründete seine Entscheidung auf den klinischen Daten aus drei globalen, randomisierten, doppelblinden, placebokontrollierten Phase-III-Zulassungsstudien, an denen insgesamt 1480 Epilepsiepatienten teilnahmen. Jede dieser Studien ergab konsistente Ergebnisse bezüglich Wirksamkeit, Verträglichkeit und Sicherheit von Perampanel als Zusatztherapie bei Patienten mit fokalen Anfällen (mit oder ohne sekundäre Generalisierung). In diesen Studien war Perampanel gut verträglich, konnte die mediane Anfallshäufigkeit reduzieren und die Ansprechraten steigern. Hier reduzierte Perampanel dosisabhängig die mediane Anfallsfrequenz um mehr als 30%, unter der Placebotherapie wurden nur Reduktionen um bis zu 10% erreicht.
Die am häufigsten berichteten behandlungsbedingten Nebenwirkungen waren Benommenheit, Kopfschmerzen und Schläfrigkeit.
hel




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.