
- DAZ.online
- DAZ / AZ
- DAZ 10/2012
- Jeder is(s)t anders
Ernährung
Jeder is(s)t anders
Die "biochemische Individualität" im Zeitalter von Nutrigenetik und Nutrigenomik
In den 20er und 30er Jahren des 20. Jahrhunderts publizierte die US-amerikanische Kinderärztin Clara Davis eine Reihe von Forschungsergebnissen zur bedarfsgerechten Kinderernährung, die die Fachwelt aufhorchen ließen. Eines der Kernergebnisse der Arbeiten war, dass Kleinkinder offenbar imstande sind, eine ihren spezifischen Bedürfnissen entsprechende Lebensmittelauswahl zu treffen – vorausgesetzt, man lässt sie bei der Auswahl frei gewähren und bietet ihnen nur "natürliche" Lebensmittel (Obst, Gemüse, Getreidebreie, Fleisch, Innereien und Fisch, teils in erhitzter, teils in roher Form) an [11; 12]. Interessant war, dass jedes Kind eigene Lebensmittel-Präferenzen entwickelte: Dominierten bei einem Kleinkind Obst, verzehrte ein anderes beachtliche Mengen Knochenmark, während ein drittes Milchprodukten den Vorzug gab [11] – eine "Individualisierungs-Tendenz", die auch nach Monaten und Jahren zu beobachten war [12]. Wie immer man die Studien von Davis heute unter methodischen oder ethischen Gesichtspunkten beurteilen mag [64; 68], so lässt sich festhalten: Jeder Mensch besitzt offenbar ganz spezifische Ernährungsvorlieben, die sich an den individuellen physiologischen Bedingungen orientieren. Im Grunde kann diese Feststellung nicht wirklich verwundern. Denn so wie kein Mensch einem anderen in äußerer Gestalt und Charakter gleicht, so wenig gleichen Menschen einander in all ihren anatomischen und physiologischen Merkmalen und also auch nicht in ihren Ernährungsbedürfnissen.
"Biochemische Individualität" – Konzept und Bedeutung für die Ernährungswissenschaft
Dass Organismen einer Art mitunter deutliche interindividuelle Unterschiede aufweisen, ist spätestens seit den Tagen Charles Darwins (1809 – 1882) allgemein bekannt. Schließlich setzt Evolution via Selektion interindividuelle Variation voraus [10]. Auffallend ist, dass die individuellen Unterschiede bei Homo sapiens besonders ausgeprägt zu sein scheinen – ein Umstand, auf den bereits 1941 der britische Biologe Julian S. Huxley (1887 – 1975) hingewiesen hatte [36]. Allerdings sollte es bis in die 1950er Jahre dauern, bis das Thema "interindividuelle Variation" seitens der biomedizinischen Forschung (wieder) aufgegriffen wurde. Wegweisend hierfür waren die Arbeiten der US-amerikanischen (Bio)Chemiker Linus Pauling (1901 – 1994) und Roger J. Williams (1893 – 1988) (siehe Tab. 1) . Letzterer prägte den Begriff der "biochemischen Individualität" [110]. Konzeptionell umfasst die biochemische Individualität drei Aspekte:
Biochemische Variation: Gestützt auf umfangreiche empirische Befunde postulierte Williams, dass sich Menschen nicht nur auf Organ- und Zellebene, sondern auch (und vor allem) auf biochemischer und genetischer Ebene voneinander unterscheiden [110]. Pauling hat diesen Grundgedanken aufgegriffen und mit den Worten popularisiert [75]: "Man hat festgestellt, dass diese Merkmale (gemeint sind genetisch kodeterminierte Eigenschaften wie etwa das Gewicht der Leber im Verhältnis zum Gesamtgewicht des menschlichen Körpers oder die Konzentration eines bestimmten Enzyms in den roten Blutzellen; Anm. d. Verf.), wenn man sie bei Hunderten von Versuchspersonen untersucht, oft weit voneinander abweichen. Die Variationen entsprechen oft der glockenförmigen Standard-Wahrscheinlichkeitsfunktion. Es ist üblich zu sagen, dass die ‚normalen‘ Werte eines Merkmals in dem Bereich liegen, in dem 95 Prozent von ihnen zu finden sind, und dass die restlichen fünf Prozent der Werte, die an den äußeren Grenzen liegen, anomal seien. Wenn wir annehmen, dass 500 Merkmale unabhängig voneinander vererbt werden, dann bestünde nur die geringe Wahrscheinlichkeit von etwa drei Prozent, dass eine Person in der ganzen Weltbevölkerung hinsichtlich aller 500 Merkmale normal wäre [...]. Die Zahl der Merkmale, die wegen eines Unterschieds in der Natur eines bestimmten Gens variabel sein können, liegt vermutlich irgendwo in der Nähe von 100.000 und nicht von nur 500; und so kommen wir zu dem Schluss, dass kein einziges menschliches Wesen auf dieser Erde (in dem Bereich, der 95 Prozent aller menschlichen Wesen umfasst) im Hinblick auf alle Merkmale normal ist."
Individueller Nährstoffbedarf: Genetisch-biochemische Varianzen korrespondieren mit Varianzen des Makro- und Mikronährstoffbedarfs, so dass gilt: Der Nährstoffbedarf ist eine individuelle Größe (genetotrophes Prinzip) (siehe Kasten "Nährstoffbedarf").
Personalisierte Ernährungsprävention: In Abhängigkeit der genetisch-biochemischen Unterschiede müssen auch die zur Prävention ernährungsassoziierter Erkrankungen ausgesprochenen Ernährungsempfehlungen variieren. "Die" gesunde Ernährung kann es daher ebenso wenig geben, wie es "die" Schuhgröße für alle gibt.
Der Nährstoffbedarf – eine individuelle Größe
Der Begriff des "Nährstoffbedarfs" ist für die moderne biomedizinische Forschung von zentraler Bedeutung, wobei er allerdings meist in unanalysierter Weise verwendet wird: Was darunter genau zu verstehen ist, wird schlicht als bekannt vorausgesetzt. Tatsächlich aber kommt es häufig zu einer Verwechslung der Begriffe "Bedarf" und "Empfehlung".
Nährstoffbedarf
Nach WHO-Definition ist der Nährstoffbedarf (minimum requirement) "die niedrigste Zufuhr an einem Nährstoff, die erforderlich ist, um Mangelerscheinungen zu verhüten, die durch klinische Merkmale und Symptome und/oder durch Messgrößen biochemischer oder physiologischer Funktionen überprüfbar sind" [19]. Aufbauend auf dieser Grunddefinition wird zwischen dem Grundbedarf und einem normativen Speicherbedarf unterschieden:
Grundbedarf (basal requirement): Hierunter ist die Nährstoffmenge zu verstehen, die benötigt wird, um klinisch nachweisbare Funktionsstörungen zu verhüten und normales Wachstum und Reproduktion zu ermöglichen.
Normativer Speicherbedarf (normative storage requirement): Hierbei handelt es sich um diejenige Menge eines Nährstoffs, die zugeführt werden muss, um Körperreserven zu gewährleisten, die ohne nachfolgende Funktionsstörungen in Anspruch genommen werden können.
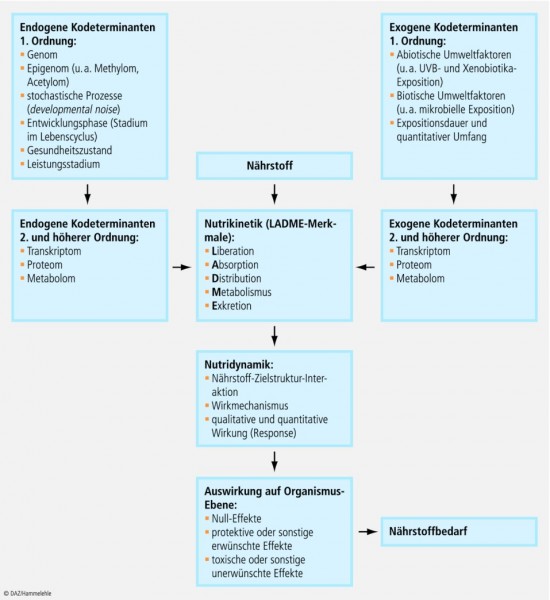
Da zahlreiche endogene und exogene Kodeterminanten existieren, die die Kinetik und Dynamik eines Nährstoffs bestimmen, ist der Nährstoffbedarf eine individuelle Größe, die nicht nur inter- sondern auch intraindividuelle Varianzen aufweist (Abb. 1). Eine genaue Bestimmung des Nährstoffbedarfs ist daher nur unter exakt definierten experimentellen Bedingungen möglich und in vielen Fällen bis heute nur ansatzweise realisiert. Zudem ist zu berücksichtigen, dass der Nährstoffbedarf auf Bevölkerungsebene im Allgemeinen (Ausnahme: Protein) keiner biostatistischen Normalverteilung (Gauß‘sche Glockenkurve) folgt und Daten zu Häufigkeitsverteilungen des Bedarfs nur bei einigen Nährstoffen und sehr kleinen Bevölkerungsgruppen vorliegen.
Empfehlungen für die Nährstoffzufuhr
Die WHO definierte die empfohlene Zufuhr (recommended intake) als "Nährstoffmengen, von denen anzunehmen ist, dass sie genügen, um nahezu alle Personen gesund zu erhalten" [19]. Entsprechend wird als Ziel der für die D-A-CH-Länder (Deutschland, Österreich und Schweiz) gültigen "Referenzwerte für die Nährstoffzufuhr" definiert: "[...] Erhaltung und Förderung der Gesundheit und der Lebensqualität. Im Sinne der WHO und FAO sollen sie bei nahezu allen gesunden Personen der Bevölkerung die lebenswichtigen metabolischen, physischen und psychischen Funktionen sicherstellen [...]. Darüber hinaus sind sie dazu bestimmt, eine gewisse Körperreserve zu schaffen, die bei unvermittelten Bedarfssteigerungen sofort und ohne gesundheitliche Beeinträchtigungen verfügbar ist" [15]. Die Werte sind dabei so bemessen, dass sie die Nährstoffversorgung nahezu aller Personen (etwa 98%) der jeweiligen Bevölkerungsgruppe sicherstellen sollen. Zu diesem Zweck wird bei den meisten Nährstoffen der Durchschnittsbedarf um 20 bis 30% (alternativ: doppelte Standardabweichung) erhöht. Grundsätzlich gelten die Empfehlungen für die Nährstoffzufuhr nur für gesunde Personen. Ein erhöhter Nährstoffbedarf, wie er sich unter bestimmten physiologischen Anforderungen (schwere physische Belastungen, extreme Klimabedingungen, chronische Erkrankungen oder starke Fremdstoffbelastungen) ergibt, wird dagegen nicht berücksichtigt.
Vitamin D als Beispiel
Das Gesagte lässt sich an einem derzeit intensiv diskutierten Mikronährstoff, dem Vitamin D, verdeutlichen. Basierend auf der Annahme, dass bei einem Calcidiolwert von 40 nmol/l der Durchschnittsbedarf für Vitamin D (bemessen anhand der Calciumabsorption und des Knochenmineralgehalts) gedeckt ist, ergibt sich unter Berücksichtigung der Variation in einer Population ein wünschenswerter Calcidiolspiegel von 50 nmol/l; bei diesem Wert sind 97,5% der Erwachsenen ausreichend mit Vitamin D versorgt. Dosis-Wirkungsbeziehungen zeigen, dass die Calcidiol-Serumkonzentration bei Erwachsenen pro 1 µg zugeführtem Vitamin D um durchschnittlich 1 nmol/l steigt. Interindividuell jedoch variiert der Anstieg der Calcidiolspiegel in nicht unerheblichem Maß. Pro 1 µg zugeführtem Vitamin D liegt der Anstieg der Calcidiolspiegel gewöhnlich zwischen 0,6 und 2,9 nmol/l [104]. Bei der Ableitung von Empfehlungen zur Vitamin-D-Zufuhr müssen diese Varianzen berücksichtigt werden. So zeigt sich, dass 10 µg Vitamin D/Tag ausreichen, um bei 50% der Bevölkerung einen Calcidiolwert von ≥ 50 nmol/l zu erzielen. Soll hingegen der Großteil der Bevölkerung ausreichend versorgt werden (Zielwert: ≥ 50 nmol/l), ist eine doppelt so hohe Zufuhr erforderlich [5]. Entsprechend lautet der aktuelle Schätzwert für eine angemessene Vitamin-D-Zufuhr bei Erwachsenen ohne körpereigene Vitamin-D-Synthese: 20 µg/Tag [16].
Bevölkerungsbasierte Ernährungsempfehlungen versus personalisierte Ernährung
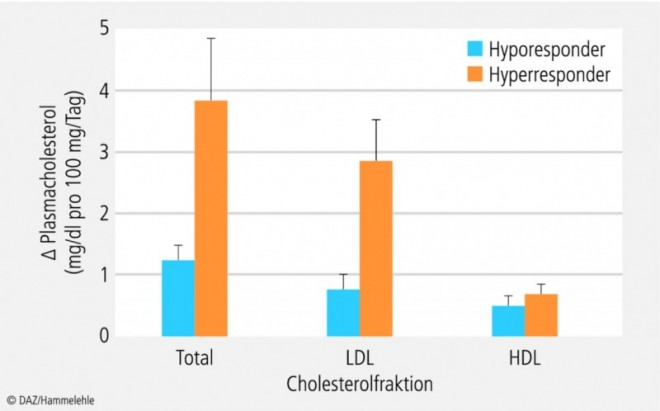
Bislang folgen die von fachwissenschaftlichen Gremien formulierten Ernährungs- und Nährstoffempfehlungen einem populationsbezogenen Ansatz: Ziel ist es, den Großteil der Bevölkerung adäquat mit Nährstoffen zu versorgen (siehe Kasten "Nährstoffbedarf"). Entsprechend pauschalisiert fallen die konkreten Empfehlungen aus; differenziert wird lediglich zwischen bestimmten Personengruppen wie Schwangere und Stillende oder Senioren. Allerdings ist seit Langem bekannt, dass die gleiche Ernährungsweise bzw. Nährstoffzufuhr bei Menschen sehr verschiedenartige, teils sogar gegensätzliche Wirkungen zeigt. So wurde z. B. die individuell unterschiedliche Reaktion des Menschen auf Nahrungscholesterol bereits Mitte der 1960er Jahre beschrieben [46] und durch nachfolgende Studien wiederholt bestätigt [41 – 43]. Schätzungen gehen davon aus, dass 15 bis 25 Prozent der Bevölkerung cholesterolsensitiv sind (sog. Hyperresponder) und bei Zufuhr identischer Mengen Nahrungscholesterol mit einem deutlich stärkeren Anstieg der Plasmacholesterolspiegel reagieren als ihre weniger cholesterolempfindlichen Mitbürger (sog. Hyporesponder): Pro Zufuhr von 100 mg Nahrungscholesterol/Tag beträgt der Anstieg der Plasmacholesterolkonzentration bei Hyporespondern durchschnittlich 1,4 mg/dl, während er bei Hyperrespondern mit 3,9 mg/dl um etwa das Dreifache höher ausfällt [61]. Besonders auffällig sind die individuell unterschiedlichen Reaktionen beim LDL-Cholesterol (Abb. 2). Auch die bei verschiedenen Menschen sehr variable Reaktion des Blutdrucks auf die Kochsalzzufuhr ist seit Längerem bekannt. Manche Personen reagieren bei vermehrter Kochsalzzufuhr mit einem starken Anstieg des Blutdrucks, während bei anderen nur schwache oder keine blutdruckerhöhenden Effekte zu beobachten sind.
tab. 1: Auf dem Weg zu einer personalisierten ernährung – ausgewählte „Meilensteine“ |
| Jahr Forschungsergebnisse Autoren |
| 1859 Publikation von „On the Origin of Species by Means of Natural Selec- Charles Darwin [10] tion“ (dtsch: „Die Entstehung der Arten durch natürliche Zuchtwahl“) |
| 1949
Identifizierung genetischer und biochemischer Variationen im Linus Pauling und H.
Itano [74] Hämoglobin-Molekül als Ursache der Sichelzellanämie. Geburtsstunde der „molekularen Medizin“: Erkrankungen werden auf molekulare Defekte und Dysfunktionen zurückgeführt |
| 1956
Konzeptioneller Erstentwurf der „biochemischen Individualität“ Roger J. Williams [108]
(keine Person gleicht einer anderen in allen biochemischen Merkmalen) und deren Bedeutung für die Ernährungswissenschaft (geneotrophes Konzept) |
| 1968
Konzeptioneller Entwurf der „orthomolekularen Medizin“:
Prävention Linus Pauling [77-78]
und Therapie von Erkrankungen durch eine auf die biochemische Individualität einer Person abgestimmte Variation körpereigener Substanzen, insbesondere durch Modifikation der Zufuhr von Nähr- stoffen |
| 1986 Popularisierung des Konzepts der „biochemischen Individualität“ im Linus Pauling [76] ernährungswissenschaftlichen Kontext |
| 1987 Hinweis, dass
die genetisch-biochemisch bedingten interindividuellen Arno G. Motulsky [63] Unterschiede
größer und ihre Relevanz für die Ernährung bedeut- samer sind, als bislang angenommen |
| 1988 Bedeutung der interindividuellen genetischen Varianz für den Ernäh- Neil A. Holtzman [31] rungsbedarf und das Erkrankungsrisiko ausgewählter Erkrankungen |
| 2001 Abschluss der
Sequenzierung des humanen Genoms (HUGO) J. Craig Venter et al.
[103] Postulate zu den biomedizinischen Implikationen des HUGO-Projekts Subramanian et al. [95] |
| 2002 Bedeutung von genetischen Polymorphismen für die Aktivität Bruce N. Ames et al. [2] Vitamin-abhängiger Enzyme und den Nährstoffbedarf |
| 2003 –
Implementierung der Forschungsansätze „Nutrigenomics“ und David M. Mutch et al.
[66]; 2005 Nutrigenetics“
Martin R. Green und van der Ouderaa [27]; Jose M. Ordovas [71-72] |
| 2006
Weiterentwicklung des Gen-Nährstoff-Interaktionskonzepts Patrick J. Stover
[93] (nutritional genomics) unter besonderer Beachtung von genetischen Polymorphismen |
| 2008 Erstausgabe der internationalen Fachzeitschrift „Journal of – Nutrigenetics and Nutrigenomics“ |
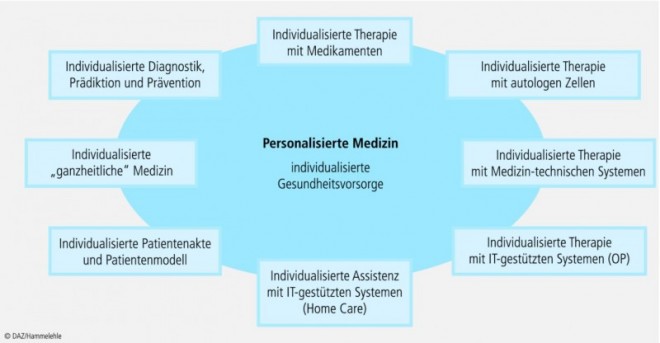
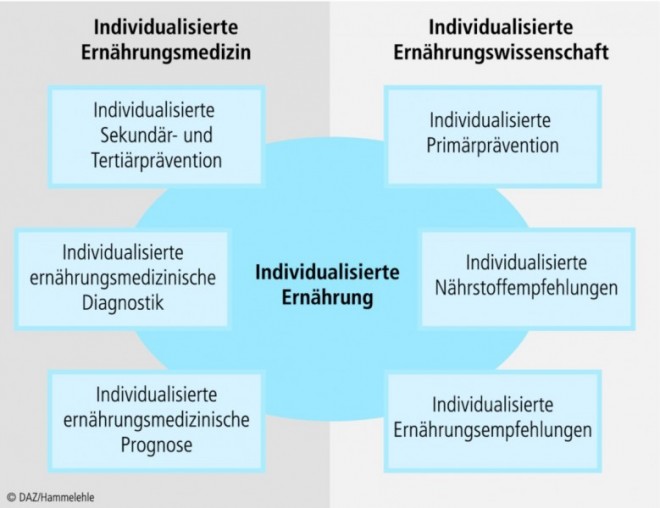
Die (post)moderne Ernährungsforschung strebt nun an, die interindividuellen Unterschiede besser zu erforschen und Ernährungsempfehlungen zu "individualisieren" [9; 39]. Konzeptionell entspricht die "personalisierte Ernährung" [39], wie der Trend genannt wird, dem der "personalisierten Medizin". Ziel ist es, eine auf die individuellen Bedürfnisse einer Person besser abgestimmte und optimierte Ernährungsprävention und diätetische Therapie zu ermöglichen [69] (Abb. 3). Zu diesem Zweck setzt die Forschung auf zwei neuartige Untersuchungsansätze: Nutrigenetik und Nutrigenomik [40; 58; 100].
Forschungsbereiche der personalisierten Ernährung: Nutrigenetik und Nutrigenomik
Die Nährstoff-Organismus-Interaktion lässt sich als zweiseitige Wechselwirkung charakterisieren. Zum einen bestimmt die individuelle genetische Ausstattung, wie eine Person auf spezifische Lebensmittelinhaltsstoffe oder eine Ernährungsweise reagiert. Andererseits sind es Nährstoffart und -menge, die das individuelle Genexpressionsprofil einer Person beeinflussen. Die neuen Forschungsbereiche Nutrigenetik und Nutrigenomik tragen dieser Tatsache Rechnung und untersuchen die Wechselwirkung zwischen Organismus und Nahrung aus entgegengesetzten Blickrichtungen:
Nutrigenetik Etwa 0,1 Prozent (mehrere Millionen DNA-Basen) – in dieser Größenordnung bewegen sich die genetischen Unterschiede von Person zu Person. Quantitativ betrachtet mögen diese Differenzen gering erscheinen; qualitativ jedoch sind sie es nicht. Deutlich wird dies am Beispiel der oben erwähnten Varianzen zwischen Cholesterol-Hyperrespondern und -Hyporespondern. Ursache für das variierende Ansprechen auf Nahrungscholesterol sind Unterschiede im Apolipoprotein-E-Gen. Im Vergleich zu Personen mit dem ApoE3-Typ weisen ApoE4-Träger nicht nur basal erhöhte LDL-Plasmaspiegel auf; auch der Anstieg der LDL-Konzentration fällt nach einer cholesterolreichen Mahlzeit etwa doppelt so hoch aus. Darüber hinaus ist der ApoE4-Genotyp durch ein verändertes antioxidatives und inflammatorisches Reaktionsmuster gekennzeichnet (siehe Kasten "ApoE4-Genotyp"). Dies könnte erklären, warum der ApoE4-Genotyp mit einem um etwa 40 Prozent erhöhten Risiko für kardiovaskuläre Erkrankungen assoziiert ist [35].
ApoE4-GenotypAntioxidatives und inflammatorisches Reaktionsmuster des ApoE4-Genotyps [35]. (↑: erhöht; ↓: erniedrigt) Im Vergleich zum ApoE3-Genotyp ist der ApoE4-Typ charakterisiert durch:
|
Genau solche genetisch mitbedingten, differenziellen Nährstoff-Organismus-Wechselwirkungen bilden den Forschungsgegenstand der Nutrigenetik. Ziel der nutrigenetischen Forschung ist es die Bedeutung genetischer Differenzen für interindividuelle, nahrungsinduzierte Reaktionsmuster aufzuklären (Grundlagenforschung), Suszeptilitätsgene, die das Risiko für die Entstehung und/oder Progression ernährungsassoziierter Erkrankungen (u. a. Adipositas, Diabetes mellitus Typ 2, kardiovaskuläre Erkrankungen und epitheliale Tumoren) beeinflussen, zu identifizieren (angewandte Forschung) und Nährstoff- und Ernährungsempfehlungen zu formulieren, die dem individuellen genetischen Profil Rechnung tragen und eine optimierte Prävention ermöglichen (Technologie). Das Zukunftsideal einer nutrigenetisch-basierten personalisierten Ernährung würde daher lauten: Die richtigen Nährstoffe in der richtigen Dosierung für die richtige Person.
Im Fokus der Nutrigenetik stehen vor allem Gene bzw. Genpolymorphismen (siehe unten), die die Nutrikinetik (u. a. Absorption, Distribution und Metabolismus) und Nutridynamik (Effekte auf die molekularen Zielstrukturen) der Lebensmittelinhaltsstoffe betreffen.
Tab. 2: Pharmakologisch relevante Polymorphismen [67] |
||
| genprodukt | Polymorphismus (angegeben ist der nukleotid- oder Aminosäure- austausch) | Klinischer Phänotyp |
| 5,10-Methylentetrahydrofolat- Reduktase | C(677)T und A(1298)C | T677 erhöht Methotrexat-Toxizität und Resistenz |
| Vitamin-K-Epoxid-Reduktase- Komplex 1 | Viele Haplotypen | Variabler Phenprocoumon-Effekt |
| β2-Adrenozeptor | Arg16Gly, Gln27Glu und Thr164Ile | 16Gly vermindert Ansprechen auf Salbutamol |
| β1-Adrenozeptor | Arg389Gly | Gly389 vermindert kardiovaskuläres Ansprechen auf β1-Adrenozeptor- Antagonisten |
| Serotonin-Transporter | Langer/kurzer Promotor- Polymorphismus | Veränderte Wirkung von Antidepres- siva |
| Serotonin-Rezeptor 2A (5-HT2A- Rezeptor) | His452Tyr | Tyr452 vermindert antipsychotische Wirkung von Clozapin |
| Angiotensin-Konversions-Enzym | Ins/del in Intron 16 | Del/Del-Homozygotie vermindert die ACE-Inhibitor-Wirkung bei Proteinurie |
| Epidermaler Wachstumshormon- rezeptor (EGF-R) | Exon-8-21-Mutationen | Lungenkarzinome mit dieser Muta- tion zeigen besseres Ansprechen auf Gefitinib |
| ERBB2 = HER2/neu, onkogener EGF-R | Überexpression des Proteins | Herceptin-Therapie von Mammakar- zinomen mit ERBB2-Überexpression |
| Genprodukt für X-ray repair cross-complementing gene 1 | Arg194Trp, Arg280His und Arg399Gln | Gln399 ist mit Oxaliplatin/5-Fluoro- uracil-Resistenz assoziiert |
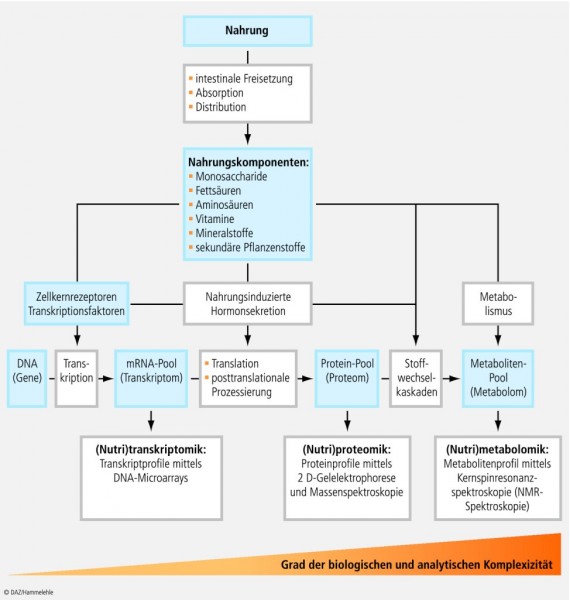
Nutrigenomik Forschungsgegenstand der Nutrigenomik ist klassischerweise der Einfluss der Nahrung bzw. einzelner Nahrungsfaktoren auf die Genexpression (Veränderungen auf mRNA oder Proteinebene). In einem erweiterten Sinne erfasst die Nutrigenomik jedoch das gesamte Stoffwechselgeschehen; sie bezieht daher neben der mRNA- und Proteinebene auch die nachgeschaltete Metabolitenebene mit in ihre Untersuchungen ein [8; 48] (Abb. 4). In Abhängigkeit von der Analysenebene gliedert sich die Nutrigenomik in drei Arbeitsbereiche [8 - 9; 111]:
Transkriptom und Transkriptomik Im Rahmen der Genexpression bildet das Transkriptom, d. h. die Gesamtheit aller zu einem bestimmten Zeitpunkt in einer Zelle, einem Gewebe oder einem Organ lokalisierten mRNA-Spezies die erste Hierarchieebene der Phänotyp-Ausprägung. Dabei umfasst das Transkriptom alle Endprodukte der Transkription, der RNA-Prozessierung und des RNA-Umsatzes [102]. Im Gegensatz zum Genom, das bei den verschiedenen Körperzellen meist identisch ist, kann das Transkriptom je nach Zelltyp stark variieren. Dies ist darauf zurückzuführen, dass ein bestimmtes Gen durch Prozesse wie alternatives Spleißen und RNA-Editing (siehe Glossar) zur Bildung zahlreicher mRNAs führt. Da das Transkriptom von Person zu Person stark variieren kann, intraindividuelle Unterschiede aber geringer ausgeprägt sind, eignet sich die Transkriptom-Analyse insbesondere zur Detektion individueller nahrungsinduzierter Wirkungen und krankheitsspezifischer Abweichungen [9; 48]. Ziel der Nutritranskriptomik ist es, die Effekte der Nahrung oder einzelner Nahrungsfaktoren auf das Transkriptom gesunder oder kranker Personen zu erfassen. Methodisch bedient sich die Transkriptomik der DNA-Mikroarray-Technik (siehe Glossar). Genutzt werden insbesondere Oligonucleotidchips mit hoher Dichte (High Density Oligonucleotid Microarrays). Damit lassen sich Tausende von Transkripten simultan bestimmen. Als Probenquellen für in-vivo-Untersuchungen dienen vor allem leicht zugängliche Körperkompartimente wie zirkulierende Blutzellen [111].
Glossar | |
Begriff |
Erläuterung |
Alternatives Spleißen |
Modifzierte Version des RNA-Spleißens, d. h. der Entfernung nicht-proteinkodierender Abschnitte (Introns) aus der unreifen prä-mRNA und Verknüpfung der angrenzenden proteinkodierenden Sequenzen (Exons) unter Bildung der reifen mRNA. Beim alternativen Spleißen variieren die entfernten RNA-Abschnitte, so dass aus einem RNA-Vorläufermolekül unterschiedliche mRNA-Varianten entstehen. |
DNA Mikroarray |
Miniaturisierte Anordnung von DNA-Sequenzen auf einer Glasoberfläche zur Hybridisierung. |
RNA-Editing |
Form der posttranskriptionalen Modifikation (RNA-Prozessierung) durch Veränderung der RNA-Basen. |
Proteom |
Gesamtheit der Proteine in einer Zelle, einem Gewebe oder einem Organ(ismus). |
Transkriptom |
Gesamtheit der RNA-Transkripte in einer Zelle, einem Gewebe oder einem Organ(ismus) zu einem definierten Zeitpunkt. |
Metabolom |
Gesamtheit der Metaboliten in einer Zelle, einem Gewebe oder einem Organ(ismus) zu einem definierten Zeitpunkt. |
SNP |
Single Nucleotid Polymorphism; Einzelnukleotidpolymorphismus. Jede polymorphe Variabilität eines einzelnen Nukleotids zu einem definierten Zeitpunkt. |
MALDI |
"Matrix-assisted laser desorption/ionization"; matrixgestützte Laserdesorption/Ionisierung. Eine massenspektroskopische Methode, die häufig für die Identifizierung von Proteinen angewandt wird. |
Massenspektrometrie |
Schnelle und sensitive Methode zur Bestimmung der Molekülmasse und von Aminosäureteilsequenzen durch Ionisation. |
zweidimensionale Gelelektrophorese |
Kopplung einer Gel-Elektrophorese mit einer anderen Trennungsmethode, der isoelektrischen Fokussierung. Hierbei erfolgt zunächst eine Trennung der Proteine aufgrund ihres isoelektrischen Punkts, darauf aufbauend nach ihrer Molekülmasse. |
Proteom und Proteomik Dem Transkriptom nachgeschaltet ist das Proteom, worunter die Gesamtheit der Proteine in einer Zelle, einem Gewebe oder einem anderen Körperkompartiment zu einem definierten Zeitpunkt verstanden wird [108]. Ähnlich wie das Transkriptom variiert auch das Proteom von Zelle zu Zelle und in Abhängigkeit von der Stoffwechselsituation sowie der Nahrungszufuhr. Da die auf Basis der mRNAS gebildeten Proteine in vielfältiger Weise prozessiert werden können – etwa durch Proteolyse, das Anheften von Acyl- und Acetylresten (Acylierung und Acetylierung) oder die Kopplung mit Oligosacchariden (Glycosilierung) und OH-Gruppen (Hydroxylierung) – ist das Proteom einer Zelle meist weit komplexer als das korrespondierende Transkriptom. Schätzungen gehen davon aus, dass das menschliche Proteom etwa 100.000 Proteine umfasst. Aufgabe der Nutriproteomik ist es, nahrungsinduzierte Veränderungen des Proteoms von Körperkompartimenten zu identifizieren und krankheitsspezifische Abweichungen aufzuklären. Ziel ist es u. a., neue und valide Biomarker für die Früherkennung und/oder Prognose ernährungsassoziierter Erkrankungen zu etablieren. Hierzu wird Probenmaterial aus leicht zugänglichen Körperkompartimenten (zirkulierende Blutzellen, Blutplasma, Urin und Speichel) entnommen und mit den Methoden der zweidimensionalen Gelelektrophorese und Massenspektrometrie (siehe Glossar) analysiert [111].
Metabolom und Metabolomik Das obere Ende der biologischen Komplexizität bildet das Metabolom, worunter die Gesamtheit der Metaboliten in einer Zelle, einem Gewebe oder einem anderen Körperkompartiment zu einem definierten Zeitpunkt verstanden wird. Zu den Metaboliten zählen Vertreter unterschiedlichster Verbindungsklassen (organische Säuren, Saccharide, Lipide etc.) und Herkunft (exogene versus endogene Quellen).
Mit etwa 10.000 endogen, d. h. im Stoffwechsel gebildeten und weiteren 1 bis 10 Millionen aus der Nahrung stammenden Metaboliten, ist das Metabolom ungleich größer als das Proteom. Ziel der Nutrimetabolomik ist es u. a., nahrungsinduzierte Veränderungen des Metaboloms zu identifizieren und übergeordnete metabolische Netzwerke aufzuklären. Zu diesem Zweck bedient sich die Forschung neben chemisch-analytischen Verfahren (die Metabolitendetektion erfolgt durch Massen- und/oder Nuklear-Magnet-Resonanz-Spektroskopie) verstärkt bioinformatischer Instrumente und spezieller Datenbank-Ressourcen [4; 54; 111].
Von der Pharmakogenetik zur Nutrigenetik: Polymorphismen
In der Pharmakologie ist seit Längerem bekannt, dass interindividuelle genetische Varianzen eine wesentliche Ursache für die individuellen Unterschiede hinsichtlich Verträglichkeit und Wirksamkeit von Arzneimitteln bilden. Meist sind es sog. Genpolymorphismen, die für Veränderungen im Stoffwechsel von Arzneistoffen verantwortlich zu machen sind und im Fokus der pharmakogenetischen Forschung stehen (siehe Kasten "Polymorphismen und Arzneimittelwirkungen"). Dabei wird unter einem Genpolymorphismus das Vorhandensein einer oder mehrerer Genvarianten (Allele) mit einer Häufigkeit von > 1% in einer Population verstanden. Quantitativ am bedeutsamsten sind Einzelnukleotidpolymorphismen (engl.: Single Nucleotide Polymorphisms; SNP). Dabei handelt es sich um "erfolgreiche Punktmutationen" [9], die durch den Austausch einer Base eines Nukleotids innerhalb der DNA charakterisiert sind. Betrifft der SNP die kodierende Region eines Gens, kann das eine veränderte Aminosäuresequenz im korrespondierenden Protein zur Folge haben. "Schlägt" der Genpolymorphismus bis auf diese Ebene durch, ist von einem Proteinpolymorphismus die Rede.
Polymorphismen und ArzneimittelwirkungenDer Fall des englischen Arztes Dr. Smith [62; 67]Die moderne Pharmakogenetik, die sich mit den genetisch bedingten Unterschieden in der Arzneimittelreaktion befasst, ist untrennbar verbunden mit dem Schicksal des englischen Arztes Dr. Smith: Nach der Einnahme einer üblichen Dosis des Blutdrucksenkers Debrisoquin kollabierte Smith unerwartet. Der Arzt ging der Sache auf den Grund und fand heraus, dass sein Körper Debrisoquin nur sehr langsam abbauen konnte; Smith war – verglichen mit anderen Personen – ein "poor metabolizer". Die Geschichte des Dr. Smith ist 25 Jahre her. Heute ist bekannt, dass seine spezifische Reaktion auf Debrisoquin auf einen Polymorphismus des CYP2D6-Gens zurückzuführen ist. Homozygote Merkmalsträger zeichnen sich durch einen Mangel an aktivem CYP2D6-Enzym aus. Die Funktionseinschränkung des Enzyms führt dazu, dass der Abbau von Arzneimitteln, die über das CYP2D6-System metabolisiert werden, verlangsamt erfolgt, mit der Folge, dass bei normaler Dosierung unerwünschte und toxische Wirkungen auftreten. Der CYP2D6-Polymorphismus ist nicht zuletzt deshalb von besonderem Interesse, da etwa 5 bis 10% der Bevölkerung einen CYP2D6-Defekt aufweisen und viele, häufig eingesetzte Pharmaka (u. a. Neuroleptika, Antiarrhytmika und Opioide) über das CYP2D6-System oxidiert werden. Weitere für die Pharmakologie relevante Polymorphismen sind in Tabelle 2 aufgeführt. |
Analog zur Pharmakokinetik stehen auch bei der Nutrikinetik solche Genpolymorphismen im Mittelpunkt des Interesses, die die Kinetik (Absorption, Distribution und Metabolismus) und Dynamik (Effekte auf die molekularen Zielstrukturen) der Lebensmittelinhaltsstoffe betreffen und das Erkrankungsrisiko modifizieren. Zwischenzeitlich liegen umfangreiche Daten zum Einfluss der SNPs auf den Stoffwechsel der Vitamine und Mineralstoffe vor (Tab. 3). Zudem konnten populationsbasierte Genom-weite Assoziationsstudien (GWAS) eine Reihe von Genvarianten identifizieren, die mit einem erhöhten Risiko für ernährungsassoziierte Erkrankungen – darunter Übergewicht und Adipositas, Diabetes mellitus Typ 2 [33; 51; 92; 112] und koronare Herzerkrankungen [80] – in Zusammenhang stehen.
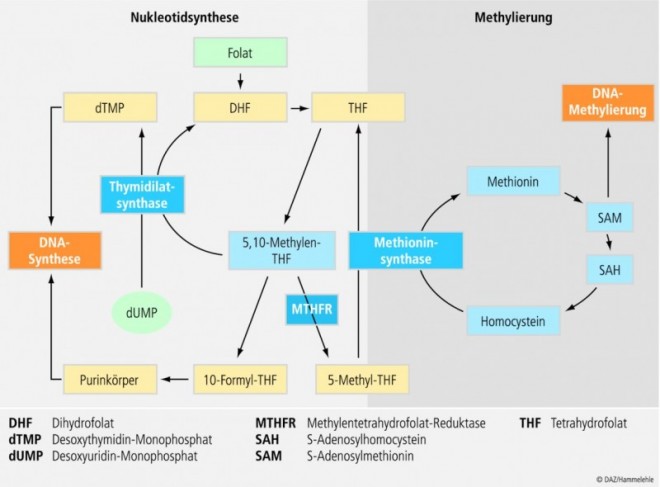
Beispiel 1: MTHFR-Polymorphismus und Folsäurestoffwechsel
In der Diskussion um die präventivmedizinische Bedeutung Vitamin-assoziierter Polymorphismen ist der Folsäurestoffwechsel auf besonderes Interesse gestoßen. Ein in diesem Zusammenhang gut untersuchtes Enzym ist die Methylentetrahydrofolatreduktase (MTHFR). Sie nimmt im C1-Stoffwechsel der Zelle eine zentrale Stellung ein, indem sie die FAD-abhängige Reduktion von 5,10-Methylentetrahydrofolat zu 5-Methyltetrahydrofolat (5-Methyl-THF) katalysiert. 5-Methyl-THF ist der Methylgruppendonator für die Remethylierung von Homocystein zu Methionin. Dieser Prozess ist gleichzeitig auch auf Vitamin B12 angewiesen, das vorübergehend die Methylgruppe von Methyl-THF übernimmt und sie anschließend, unter Bildung von Methionin, auf Homocystein überträgt (Abb. 5). Methionin wiederum ist der Präkursor für die Synthese von S-Adenoslymethionin (SAM), dem wichtigsten Cofaktor bei Methylierungsreaktionen an Stickstoff- und Sauerstoffatomen. Es konnten mehr als 40 SAM-abhängige Methyltransferasen identifiziert werden, u. a. solche, die die Basen der DNA methylieren.
Bislang wurden für das auf Chromosom 1p36 lokalisierte MTHFR-Gen mehrere Polymorphismen beschrieben (u. a. 1289A->C; 1059T->C; 1317T->C; 1793G->A). Im Hinblick auf das Erkrankungsrisiko am intensivsten untersucht ist die an Position 677 lokalisierte Transition (677C->T). Auf Proteinebene manifestiert sich der Polymorphismus als Alanin-Valin-Austausch (Ala222->Val) im MTHFR-Enzym. Verbunden ist dies mit einer verminderten Affinität des Enzymproteins zu seinem Cofaktor FAD und einer reduzierten Enzymaktivität. Verglichen mit dem Wildtyp (CC) erreicht die Aktivität der MTHFR bei heterozygoten Genträgern (CT) nur etwa 65 Prozent, bei homozygotem Genotyp (TT) sogar nur rund 30 Prozent. Damit in Verbindung stehen ein verringerter Methyl-THF-Pool und ein erhöhter Homocysteinspiegel bei TT-Trägern, insbesondere dann, wenn die Folsäure- und Riboflavinversorgung unzureichend sind. Auch die SAM-abhängige Methylierung der DNA ist hiervon offenbar betroffen. Andererseits ist davon auszugehen, dass bei MTHFR-TT-Trägern der Pool an 5,10-Methylen-THF erhöht ist, so dass mehr Substrat für die Thymidilatsynthese und damit für die DNA-Synthese und -Reparatur zur Verfügung steht [94].
Zwischenzeitlich wurde eine Reihe von Erkrankungen identifiziert, die mit dem MTHFR-Polymorphismus in Zusammenhang stehen, darunter kardiovaskuläre Ereignisse, psychiatrische und neurodegenerative Erkrankungen sowie Tumoren des Dick- und Enddarms. Wie die Studienlage zeigt, ist der TT-Polymorphismus generell mit einem geringeren Risiko für kolorektale Karzinome, nicht aber Adenome, assoziiert [94]; ein Befund, der durch eine jüngste Metaanalyse von 29 Beobachtungsstudien mit insgesamt 30.650 Teilnehmern bestätigt werden konnte. Verglichen mit dem CC-Genotyp weisen TT-Träger ein 17 Prozent vermindertes Erkrankungsrisiko auf [97]. Ob bzw. inwieweit der TT-Genotyp das Kolonkarzinomrisiko beeinflusst, wird nicht zuletzt von Nahrungsfaktoren wie z. B. der Folsäureversorgung bestimmt. So zeigte sich in der Physicians Health Study [57], dass Träger des TT-Genotyps ein nur halb so hohes Risiko für kolorektale Karzinome aufweisen, wenn ihre Plasmafolsäurespiegel im Normalbereich lagen. Ähnliche chemopräventive Effekte einer guten Folsäureversorgung zeigen auch andere Beobachtungsstudien [6; 49; 89]. Worauf der protektive Synergismus zwischen der Folsäureversorgung und dem TT-Genotyp zurückzuführen ist, ist nicht abschließend geklärt. Vermutet wird, dass Träger des TT-Genotpys einen erhöhten 5,10-Methylen-THF-Pool aufweisen. Bei ausreichendem Folatstatus ist auch die Verfügbarkeit von 5-Methyl-THF sichergestellt, so dass sowohl DNA-Methylierung als auch DNA-Synthese und -Reparatur normal ablaufen. Das Risiko für DNA-Strangbrüche und Veränderungen im Methylierungsmuster von Protoonkogenen und Tumorsuppressorgenen werden so reduziert [94]. Demgegenüber kann bei Unterschreiten eines Limits an Folat die verminderte Verfügbarkeit von Methyl-THF zu einer reduzierten DNA-Methylierung führen und so zur Entwicklung von Neoplasien beitragen. Eine suboptimale Folsäureversorgung scheint insbesondere dann das Erkrankungsrisiko zu erhöhen, wenn hohe Mengen an Alkohol konsumiert werden [94].
Beispiel 2: CAV2-Polymorphismus und die Wirkung von Nahrungsfett
Lange Zeit galt es als wissenschaftlich erwiesen: Eine fettreiche Ernährung begünstigt die Entstehung von Übergewicht und damit assoziierten Folgeerkrankungen, insbesondere Diabetes mellitus Typ 2. Zwischenzeitlich ist klar, dass die Zusammenhänge komplexer sind. Der Fettanteil der Nahrung, so die zusammenfassende Bewertung der Studiendaten, übt keinen relevanten oder bestenfalls einen geringen Einfluss auf die Gewichtsentwicklung aus [21; 23; 109;]. Ebenso findet sich kein Zusammenhang zwischen dem Gesamtfettgehalt der Nahrung und dem Risiko für kardiovaskuläre Erkrankungen [32], Dickdarmkrebs [53] und Diabetes mellitus Typ 2 [17].
Freie Fahrt also für Nahrungsfett? Nicht ganz, wie jüngste Untersuchungen zeigen. Denn wie die gesundheitlichen Effekte des Fettverzehrs im Einzelfall ausfallen, hängt offenbar von der individuellen genetischen Ausstattung ab. Ins Blickfeld der Forschung gerückt ist dabei das auf Chromosom 7 lokalisierte Caveolin-2-Gen, das beim Menschen in polymorpher Form (CAV2 rs2270188) vorliegt. Es kodiert für das membranständige Protein Caveolin2 (CAV2), das zusammen mit weiteren Caveolinen Cholesterol bindet, in der Zellmembran "Haarnadelstrukturen" ausbildet und sackartige Zelleinstülpungen, die sog. Caveolae, formt. Caveoline sind an verschiedenen zellbiologisch relevanten Mechanismen beteiligt, darunter Fettsäuretransport und Insulin-Signaltransduktion [22]. Damit bilden Caveoline eine Schnittstelle zwischen Fettstoffwechsel und Glucosehomöostase, was sie für die nutrigenetische Forschung besonders interessant macht. Wie Ergebnisse der EPIC-Studie nun belegen, wirkt sich die Zufuhr von Nahrungsfett sehr unterschiedlich auf das Risiko aus, an Diabetes mellitus Typ 2 zu erkranken [22]. Konsumieren Personen des CAV2-TT-Genotyps hohe Mengen Fett, ist die Wahrscheinlichkeit für die Manifestation der Erkrankung etwa doppelt so hoch wie bei fettunempfindlichen Personen des GG-Genotyps. Noch sensitiver reagieren Träger des TT-Genotyps auf die Zufuhr gesättigter Fettsäuren: Wird die Aufnahme von 10 auf 20 Energie% gesteigert, so erhöht sich das Erkrankungsrisiko um 200 Prozent.
Personalisierte Ernährung in der Praxis – Status quo und Ausblick
Dass den Schneider mitunter zerreißt, was dem Schmied bekommt – diese Volksweisheit sieht sich heute auf das Trefflichste bestätigt. Die diesem Sachverhalt zugrunde liegende "biochemische Individualität" ist heute Gegenstand intensiver Forschung und kann auf unterschiedlichen Ebenen biologischer Komplexität (Genom, Proteom, Metabolom) abgebildet werden. Stellt sich zum Schluss die Frage, welche Bedeutung diese Erkenntnisse für die Praxis besitzen.
Schenkt man den zahlreichen Angeboten für genomische Tests im Internet Glauben, lassen sich bereits heute auf Grundlage individueller Genotypisierungen personalisierte Ernährungsempfehlungen formulieren. Auch finden sich Angebote für Gen-basierte, individuell formulierte Mikronährstoffpräparate, die den persönlichen Bedürfnissen in besonderem Maße Rechnung tragen sollen. Ein genauer Blick zeigt jedoch, dass solch Genotyp-basierte Ernährungsempfehlungen keinesfalls halten, was sie versprechen – zumindest nicht zum gegenwärtigen Zeitpunkt. Tatsächlich sieht die Nutrigenetik sich hier einem ähnlichen Problem gegenübergestellt, wie es für die Pharmakogenetik beschrieben wurde: Dem Problem der klinischen Validität [85]. Eine wissenschaftlich fundierte Nutzung genomischer Tests setzt nämlich voraus, dass der genetische Marker mit dem klinischen Ereignis in einem präzisen Zusammenhang stehen muss. Für die Prävention bedeutet das: Die genomischen Tests müssen Erkrankungsrisiken zuverlässig und präzise erfassen und es ermöglichen, geeignete Ernährungsempfehlungen zu formulieren. Hiervon ist man jedoch weit entfernt, da der Beitrag der bisher identifizierten Gen-Biomarker (in Form von SNPs) für das Risiko der meisten ernährungsassoziierten Erkrankungen (u. a. Diabetes mellitus Typ 2, kardiovaskuläre Erkrankungen) relativ gering ist [38].
Obwohl die Nutrikinetik also noch im experimentellen Stadium verharrt, zeichnen sich für die Zukunft vielversprechende Anwendungsmöglichkeiten ab [9; 38]:
Primärprävention: Etablierung von Biomarkern, mit dem Ziel, Krankheitsrisiken zu einem sehr viel früheren Zeitpunkt als bislang möglich zu erfassen und diesen durch geeignete präventive Maßnahmen zu begegnen. Zu diesem Zweck müssten komplexe Algorithmen entwickelt werden, die neben den neuen nutrigenetischen und -genomischen Daten (Genom-, Proteom- und Metabolomprofil) klassische anthropometrische (Körpergröße, -gewicht und Fettverteilung) und laborchemische Parameter (Lipidwerte, Blutglucosekonzentration) erfassen.
Sekundärprävention und Diättherapie: Nutzung der o. g. Algorithmen zu einer auf die individuellen Bedürfnisse besser abgestimmten Ernährungsintervention und zur Beurteilung von deren Effektivität.
Man darf also gespannt bleiben.
Literatur
[1] Al-oanzi ZH, Tuck SP, Mastana SS, Summers GD, Cook DB, Francis RM, Datta HK.Vitamin D-binding protein gene microsatellite polymorphism influences BMD and risk of fractures in men. Osteoporos Int. 2008 Jul;19(7):951-60.[2] Ames BN, Elson-Schwab I, Silver EA. High-dose vitamin therapy stimulates variant enzymes with decreased coenzyme binding affinity (increased K(m)): relevance to genetic disease and polymorphisms. Am J Clin Nutr. 2002[3] Beck U. Risikogesellschaft: Auf dem Weg in eine andere Moderne. Frankfurt, Suhrkamp 1986[4] Brennan L. Session 2: Personalised nutrition. Metabolomic applications in nutritional research. Proc Nutr Soc. 2008 Nov;67(4):404-8.[5] Cashman KD, Hill TR, Lucey AJ, Taylor N, Seamans KM, Muldowney S,Fitzgerald AP, Flynn A, Barnes MS, Horigan G, Bonham MP, Duffy EM, Strain JJ, Wallace JM,Kiely M. Estimation of the dietary requirement for vitamin D in healthy adults. Am J Clin Nutr. 2008 Dec;88(6):1535-42[6] Chen J, Giovannucci E, Kelsey K, Rimm EB, Stampfer MJ, Colditz GA, Spiegelman D, Willett WC, Hunter DJ. A methylenetetrahydrofolate reductase polymorphism and the risk of colorectal cancer. Cancer Res 56, 4862-4, 1996. [7] Chupeerach C, Tungtrongchitr A, Phonrat B, Schweigert FJ, Tungtrongchitr R, Corthésy-Theulaz I, den Dunnen JT, Ferré P, Geurts JM, Müller M, van Belzen N, van Ommen B. Nutrigenomics: the impact of biomics technology on nutrition research. Ann Nutr Metab. 2005 Nov-Dec;49(6):355-65. [8] Corthésy-Theulaz I, den Dunnen JT, Ferré P, Geurts JM, Müller M, van Belzen N, van Ommen B. Nutrigenomics: the impact of biomics technology on nutrition research. Ann Nutr Metab. 2005 Nov-Dec;49(6):355-65. [9] Daniel H, Klein U. Personalisierte Ernährung Wie nah ist die Zukunft? JEM 6-9, 2011[10] Darwin C. On the Origin of Species by Means of Natural Seletion, or the Preservation of Favoured Races in the Struggle for Life. John Murray, London 1859[11] Davis C.M. Self selection of diet by newly weaned infants: an experimental study. Am J Dis Child 1928; 36 (4): 651-79[12] Davis CM. RESULTS OF THE SELF-SELECTION OF DIETS BY YOUNG CHILDREN. Can Med Assoc J. 1939 Sep;41(3):257-61.[13] Delgado-Enciso I, Martinez-Garza SG, Rojas-Martinez A, Ortiz-Lopez R, Bosques-Padilla F, Calderon-Garciduenas AL, Zarate-Gomez M, Barrera-Saldana HA. 677T mutation of the MTHFR gene in adenomas and colorectal cancer in a population sample from the Northeastern Mexico. Preliminary results. Rev Gastroenterol Mex 66, 32-7, 2001. [14] Deng H, Liu F, Pan Y, Jin X, Wang H, Cao J. BsmI, TaqI, ApaI, and FokI polymorphisms in the vitamin D receptor gene and periodontitis: a meta-analysis of 15 studies including 1338 cases and 1302 controls. J Clin Periodontol. 2011 Mar;38(3):199-207.[15] Deutsche Gesellschaft für Ernährung (DGE), Österreichische Gesellschaft für Ernährung (ÖGE), Schweizerische Gesellschaft für Ernährung (SGE), Schweizerische Vereinigung für Ernährung (SVE): Referenzwerte für die Nährstoffzufuhr. 1. Auflage, 3. vollständig durchgesehener und korrigierter Nachdruck. Neuer Umschau Buchverlag, Neustadt an der Weinstraße 2008[16] Deutsche Gesellschaft für Ernährung (DGE), Österreichische Gesellschaft für Ernährung (ÖGE), Schweizerische Gesellschaft für Ernährungsforschung (SGE), Schweizerische Vereinigung für Ernährung (SVE): Referenzwerte für die Nährstoffzufuhr. Umschau/Braus, Frankfurt am Main 2012, S. 87-93[17] Deutsche Gesellschaft für Ernährung (Hrsg.): Evidenzbasierte Leitlinie. Fettkonsum und Prävention ausgewählter ernährungsmitbedingter Krankheiten. Version 206. Im Internet verfügbar unter http://www.dge.de/pdf/ws/ll-fett/DGE-Leitlinie-Fett-11-2006.pdf[18] Devlin AM, Ling EH, Peerson JM, Fernando S, Clarke R, Smith AD, Halsted CH. Glutamate carboxypeptidase II: a polymorphism associated with lower levels of serum folate and hyperhomocysteinemia. Hum Mol Genet. 2000 Nov 22;9(19):2837-44. [19] Elmadfa I, Leitzmann C. Ernährung des Menschen. 3. Auflage, Eugen Ulmer 1998[20] Fichtl B: Arzneistoffkonzentrationen im Organismus in Abhängigkeit von der Zeit: Pharmakokinetik im engeren Sinne. In: Aktories K, Förstermann U, Hofmann B, Starke K. Allgemeine und spezielle Pharmakologie und Toxikologie. Begründet von W. Forth, D. Henschler und W. Rummel. 9. Auflage, Urban & Fischer München/Jena 2005, S. 64-80[21] Field AE, Willett WC, Lissner L, Colditz GA. Dietary fat and weight gain among women in the Nurses' Health Study. Obesity (Silver Spring). 2007 Apr;15(4):967-76. [22] Fisher E, Schreiber S, Joost HG, Boeing H, Döring F. A two-step association study identifies CAV2 rs2270188 single nucleotide polymorphism interaction with fat intake in type 2 diabetes risk. J Nutr. 2011 Feb;141(2):177-81.[23] Forouhi NG, Sharp SJ, Du H, van der A DL, Halkjaer J, Schulze MB,Tjønneland A, Overvad K, Jakobsen MU, Boeing H, Buijsse B, Palli D, Masala G, Feskens EJ,Sørensen TI, Wareham NJ. Dietary fat intake and subsequent weight change in adults: results from the European Prospective Investigation into Cancer and Nutrition cohorts. Am J Clin Nutr. 2009 Dec;90(6):1632-41. [24] Fu L, Yun F, Oczak M, Wong BY, Vieth R, Cole DE. Common genetic variants of the vitamin D binding protein (DBP) predict differences in response of serum 25-hydroxyvitamin D [25(OH)D] to vitamin D supplementation. Clin Biochem. 2009 Jul;42(10-11):1174-7.[25] Gao L, Tao Y, Zhang L, Jin Q. Vitamin D receptor genetic polymorphisms and tuberculosis: updated systematic review and meta-analysis. Int J Tuberc Lung Dis. 2010 Jan;14(1):15-23.[26] Giovannucci E, Chen J, Smith-Warner SA, Rimm EB, Fuchs CS, Palomeque C, Willett WC, Hunter DJ. Methylenetetrahydrofolate reductase, alcohol dehydrogenase, diet, and risk of colorectal adenomas. Cancer Epidemiol Biomarkers Prev 12, 970-9, 2003.[27] Green MR, van der Ouderaa F. Nutrigenetics: where next for the foods industry? Pharmacogenomics J. 2003;3(4):191-3. [28] Gupta N, Gupta S, Dama M, David A, Khanna G, Khanna A, Rajender S. Strong association of 677 C>T substitution in the MTHFR gene with maleinfertility--a study on an indian population and a meta-analysis. PLoS One. 2011;6(7):e22277.[29] Hirai M, Suzuki S, Hinokio Y, Hirai A, Chiba M, Akai H, Suzuki C, Toyota T. Variations in vitamin D-binding protein (group-specific component protein) are associated with fasting plasma insulin levels in Japanese with normal glucose tolerance. J Clin Endocrinol Metab. 2000 May;85(5):1951-3.[30] Holmes MV, Newcombe P, Hubacek JA, Sofat R, Ricketts SL, Cooper J, Breteler MM, Bautista LE, Sharma P, Whittaker JC, Smeeth L, Fowkes FG, Algra A, Shmeleva V, Szolnoki Z, Roest M, Linnebank M, Zacho J, Nalls MA, Singleton AB, Ferrucci L, Hardy J, Worrall BB, Rich SS, Matarin M, Norman PE, Flicker L, Almeida OP, van Bockxmeer FM, Shimokata H, Khaw KT, Wareham NJ, Bobak M, Sterne JA, Smith GD,Talmud PJ, van Duijn C, Humphries SE, Price JF, Ebrahim S, Lawlor DA, Hankey GJ, Meschia JF, Sandhu MS, Hingorani AD, Casas JP. Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk: a meta-analysis of genetic studies and randomised trials. Lancet. 2011 Aug 13;378(9791):584-94[31] Holtzman NA. Genetic variation in nutritional requirements and susceptibility to disease: policy implications. Am J Clin Nutr. 1988 Dec;48(6):1510-6[32] Hooper L, Summerbell CD, Thompson R, Sills D, Roberts FG, Moore H, Davey Smith G. Reduced or modified dietary fat for preventing cardiovascular disease. Cochrane Database Syst Rev. 2011 Jul 6;(7):CD002137. [33] Hu FB. Globalization of diabetes: the role of diet, lifestyle, and genes.Diabetes Care. 2011 Jun;34(6):1249-57. [34] Hua Y, Zhao H, Kong Y, Ye M. Association between the MTHFR gene and Alzheimer's disease: a meta-analysis. Int J Neurosci. 2011 Aug;121(8):462-71.[35] Hübbe P, Rimbach G: Ernährungsabhängige Polymorphismen am Beispiel des Apoliporotein E. In: Biesalski HK, Bischoff SC, Puchstein C (Hrsg.): Ernährungsmedizin, 4. Auflage, Thieme, Stuttgart, S. 317-321, 2010[36] Huxley JS. Man Stands ALone. Harper & Bros, New York and London, 1941[37] Ji GR, Yao M, Sun CY, Li ZH, Han Z. BsmI, TaqI, ApaI and FokI polymorphisms in the vitamin D receptor (VDR) gene and risk of fracture in Caucasians: a meta-analysis. Bone. 2010 Sep;47(3):681-6.[38] Joost HG. Genotyp-basierte Ernährungsempfehlungen. Noch im experimentellen Stadium. Dtsch Ärztebl 102:A2608-A2610, 2005[39] Joost HG, Gibney MJ, Cashman KD, Görman U, Hesketh JE, Mueller M, van Ommen B, Williams CM, Mathers JC. Personalised nutrition: status and perspectives. Br J Nutr. 2007 Jul;98(1):26-31.[40] Kaput J. Nutrigenomics research for personalized nutrition and medicine. Curr Opin Biotechnol. 2008 Apr;19(2):110-20. [41] Katan MB, Beynen AC, de Vries JH, Nobels A: Existence of consistent hypo- and hyperresponders to dietary cholesterol in man. Am J Epidemiol 123: 221–234, 1986.[42] Katan MB, Beynen AC: Characteristics of human hypo- and hyperresponders to dietary cholesterol. Am J Epidemiol 125: 387–399, 1987.[43] Katan MB, Beynen AC: Hyper-response to dietary cholesterol in man [letter]. Lancet 1: 1213, 1983.[44] Kawasaki T, Delea CS, Bartter FC, Smith H. The effect of high-sodium and low-sodium intakes on blood pressure and other related variables in human subjects with idiopathic hypertension. Am J Med. 1978 Feb;64(2):193-8.[45] Keku T, Millikan R, Worley K, Winkel S, Eaton A, Biscocho L, Martin C, Sandler R. 5,10-Methylenetetrahydrofolate reductase codon 677 and 1298 polymorphisms and colon cancer in African Americans and whites. Cancer Epidemiol Biomarkers Prev 11, 1611-21, 2002.[46] Keys A, Anderson JT, Grande F. Serum cholesterol response to changes in the diet. III. Differences among individuals. Metabolism 14; 766-775, 1965[47] Kressel G, Ströhle A, Wolters M, Hahn A (2004): Vitamine in der Prävention. Qualifizierte Ernährungsberatung in der Apotheke, Teil 2., Dtsch Apothek Z 144 (49), S.5615-5625[48] Kussmann M, Rezzi S, Daniel H. Profiling techniques in nutrition and health research. Curr Opin Biotechnol. 2008 Apr;19(2):83-99.[49] Le Marchand L, Donlon T, Hankin JH, Kolonel LN, Wilkens LR, Seifried A. B-vitamin intake, metabolic genes, and colorectal cancer risk (United States). Cancer Causes Control 13, 239-48, 2002.[50] Levine AJ, Siegmund KD, Ervin CM, Diep A, Lee ER, Frankl HD, Haile RW. The methylenetetrahydrofolate reductase 677C-->T polymorphism and distal colorectal adenoma risk. Cancer Epidemiol Biomarkers Prev 9, 657-63, 2000.[51] Lindgren CM, Heid IM, Randall JC, Lamina C, Steinthorsdottir V, Qi L,Speliotes EK, Thorleifsson G, Willer CJ, Herrera BM, Jackson AU, Lim N,Scheet P et al. Genome-wide association scan meta-analysis identifies three Loci influencing adiposity and fat distribution. PLoS Genet. 2009 Jun;5(6):e1000508.[52] Liu H, Yang M, Li GM, Qiu Y, Zheng J, Du X, Wang JL, Liu RW. The MTHFR C677T polymorphism contributes to an increased risk for vascular dementia: a meta-analysis. J Neurol Sci. 2010 Jul 15;294(1-2):74-80[53] Liu L, Zhuang W, Wang RQ, Mukherjee R, Xiao SM, Chen Z, Wu XT, Zhou Y,Zhang HY. Is dietary fat associated with the risk of colorectal cancer? A meta-analysis of 13 prospective cohort studies. Eur J Nutr. 2011 Apr;50(3):173-84[54] Lodge JK. Symposium 2: Modern approaches to nutritional research challenges: Targeted and non-targeted approaches for metabolite profiling in nutritional research. Proc Nutr Soc. 2010 Feb;69(1):95-102[55] Löffler G: Kohlenhydrate, Lipide und Aminosäuren. In: Löffler G, Petrides PE, Heinrich PC (Hrsg.). Biochemie und Pathobiochemie. 8. Auflage, Springer, Heidelberg 2007, S. 21-53[56] Lopreato FR, Stabler SP, Carvalho FR, Hirata RD, Hirata MH, Robi DL, Sampaio-Neto LF, Allen RH, Guerra-Shinohara EM. Relationships between gene polymorphisms of folate-related proteins and vitamins and metabolites in pregnant women and neonates. Clin Chim Acta. 2008 Dec;398(1-2):134-9[57] Ma J, Stampfer MJ, Giovannucci E, Artigas C, Hunter DJ, Fuchs C, Willett WC,Selhub J, Hennekens CH, Rozen R. Methylenetetrahydrofolate reductase polymorphism, dietary interactions, and risk of colorectal cancer. Cancer Res 57, 1098-102, 1997.[58] Mariman EC. Nutrigenomics and nutrigenetics: the 'omics' revolution in nutritional science. Biotechnol Appl Biochem. 2006 Jun;44(Pt 3):119-28.[59] Marugame T, Tsuji E, Inoue H, Shinomiya S, Kiyohara C, Onuma K, Hamada H, Koga H, Handa K, Hayabuchi H, Kono S. Methylenetetrahydrofolate reductase polymorphism and risk of colorectal adenomas. Cancer Lett 151, 181-6, 2000. May;3(2):59-68[60] McNamara DJ, Kolb R, Parker TS, Batwin H, Samuel P, Brown CD, Ahrens EH, Jr: Heterogeneity of cholesterol homeostasis in man. Response to changes in dietary fat quality and cholesterol quantity. J Clin Invest 79: 1729–1739, 1987.[61] McNamara DJ. The impact of egg limitations on coronary heart disease risk: do the numbers add up? J Am Coll Nutr. 2000 Oct;19(5 Suppl):540S-548S[62] Meier-Abt PJ, Stieger B. Bedeutung der Genetik für die Arzneimitteltherapie. Uni-Magazin, Universität Zürich 31-33, 2000[63] Motulsky AG. Human genetic variation and nutrition. Am J Clin Nutr. 1987 May;45(5 Suppl):1108-13.[64] Munro N: A Review of the 1928 Research by Clara Davis, "Self Selection of Diet by Newly Weaned Infants" Journal of Home Economics, Vol. 58, Nr. 8 1966, S. 655–658.[65] Muray S, Parisi E, Cardús A, Craver L, Fernández E. Influence of vitamin D receptor gene polymorphisms and 25-hydroxyvitamin D on blood pressure in apparently healthy subjects. J Hypertens. 2003 Nov;21(11):2069-75. [66] Mutch DM, Wahli W, Williamson G. Nutrigenomics and nutrigenetics: the emerging faces of nutrition. FASEB J. 2005 Oct;19(12):1602-16.[67] Mutschler E, Geisslinger G, Kroemer HK, Ruth P, Schäfer-Korting M.Mutschler Arzneimittelweirkungen. Lehrbuch der Pharmakologie und Toxikologie. 9. vollständig überarbeitete und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft mbH Stuttgart 2008[68] N.N. Clara Davis revisited. Nutr Rev. 1987 Jul;45(7):200-2[69] Niederlag W, Lemke HU, Rienhoff O. [Personalized medicine and individual nutritional research. Proc Nutr Soc. 2008 Nov;67(4):404-8.[70] Niederlag W, Lemke HU, Rienhoff O. [Personalized medicine and individual healthcare : Medical and information technology aspects]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2010 Aug;53(8):776-82.[71] Ordovas JM, Mooser V. Nutrigenomics and nutrigenetics. Curr Opin Lipidol. 2004 Apr;15(2):101-8. [72] Ordovas JM. The quest for cardiovascular health in the genomic era: nutrigenetics and plasma lipoproteins. Proc Nutr Soc. 2004 Feb;63(1):145-52. [73] Park KS, Mok JW, Kim JC. The 677C > T mutation in 5,10-methylenetetrahydrofolate reductase and colorectal cancer risk. Genet Test 3, 233-6, 1999.[74] Pauling L, Itano HA, et al. Sickle cell anemia a molecular disease. Science. 1949 Nov 25;110(2865):543-8.[75] Pauling L. Das Vitamin Programm. Topfit bis ins hohe Alter. Goldmann, München 1990[76] Pauling L. How to live longer and feel better. Freeman and Company, New York 1986[77] Pauling L. Orthomolecular psychiatry. Varying the concentrations of substances normally present in the human body may control mental disease. Science. 1968a Apr 19;160(3825):265-71.[78] Pauling L.: Orthomolecular Somatic and Psychiatric Medicine. Journal of Vital Substances and Diseases of Civilization, 14:1-3, 1968b[79] Pufulete M, Al-Ghnaniem R, Leather AJ, Appleby P, Gout S, Terry C, Emery PW, Sanders TA. Folate status, genomic DNA hypomethylation, and risk of colorectal adenoma and cancer: a case control study. Gastroenterology 124, 1240-8, 2003. [80] Qi Q, Workalemahu T, Zhang C, Hu FB, Qi L. Genetic variants, plasma lipoprotein(a) levels, and risk of cardiovascular morbidity and mortality among two prospective cohorts of type 2 diabetes. Eur Heart J. 2012 Feb;33(3):325-34.[81] Raimondi S, Johansson H, Maisonneuve P, Gandini S. Review and meta-analysis on vitamin D receptor polymorphisms and cancer risk. Carcinogenesis. 2009[82] Röhm K-H. Stoffwechsel der Aminosäuren. In: Löffler G, Petrides PE, Heinrich PC (Hrsg.). Biochemie und Pathobiochemie. 8. Auflage, Springer, Heidelberg 2007, S. 427-476[83] Sachse C, Smith G, Wilkie MJ, Barrett JH, Waxman R, Sullivan F, Forman D, Bishop DT, Wolf CR. Colorectal Cancer Study Group. A pharmacogenetic study to investigate the role of dietary carcinogens in the etiology of colorectal cancer. Carcinogenesis 23, 1839-49, 2002.[84] Schürks M, Rist PM, Kurth T. MTHFR 677C>T and ACE D/I polymorphisms in migraine: a systematic review and meta-analysis. Headache. 2010 Apr;50(4):588-99.[85] Schwab M, Schaeffeler E, Zanger UM, Brauch H, Kroemer HK. Pharmacogenomics: Hype oder Hope?. Dtsch Med Wochenschr. 2011 Mar;136(10):461-7.[86] Shannon B, Gnanasampanthan S, Beilby J, Iacopetta B. A polymorphism in the methylenetetrahydrofolate reductase gene predisposes to colorectal cancers with microsatellite instability. Gut 50, 520-4, 2002. [87] Sharp L, Little J, Brockton N et al. Genetic polymorphisms in folate metabolism, dietary folate intake and colorectal cancer: a population-based case-control study. J Epidemiol Community Health 55, A27, 2001.[88] Sharp L, Little J, Brockton N, Cotton SC, Haites NE, Cassidy J. Dietary Intake of Folate and Related Micronutrients, Genetic Polymorphisms in MTHFR and Colorectal Cancer: A Population-Based Case-Control Study in Scotland. J Nutr 132 (11Supl), 3542S, 2002. [89] Slattery ML, Potter JD, Samowitz W, Schaffer D, Leppert M.Methylenetetrahydrofolate reductase, diet, and risk of colon cancer. Cancer Epidemiol Biomarkers Prev 8, 513-8, 1999.[90] Speeckaert M, Huang G, Delanghe JR, Taes YE. Biological and clinical aspects of the vitamin D binding protein (Gc-globulin) and its polymorphism. Clin Chim Acta. 2006 Oct;372(1-2):33-42.[91] Speliotes EK, Willer CJ, Berndt SI, Monda KL, Thorleifsson G, Jackson AU, Stover PJ. Influence of human genetic variation on nutritional requirements. Am J Clin Nutr. 2006 Feb;83(2):436S-442S.[92] Speliotes EK, Willer CJ, Berndt SI, Monda KL, Thorleifsson G, Jackson AU, Allen HL, Lindgren CM et al. Association analyses of 249,796 individuals reveal 18 new loci associated with body mass index. Nat Genet. 2010 Nov;42(11):937-48.[93] Stover PJ. Influence of human genetic variation on nutritional requirements. Am J Clin Nutr. 2006 Feb;83(2):436S-442S.[94] Ströhle A, Wolters M, Hahn A. Folic acid and colorectal cancer prevention: molecular mechanisms and epidemiological evidence (Review). Int J Oncol. 2005 Jun;26(6):1449-64.[95] Subramanian G, Adams MD, Venter JC, Broder S. Implications of the human genome for understanding human biology and medicine. JAMA. 2001 286(18):2296-307. [96] Suzuki Y, Yang X, Aoki Y, Kure S, Matsubara Y. Mutations in the holocarboxylase synthetase gene HLCS. Hum Mutat. 2005 Oct;26(4):285-90.[97] Taioli E, Garza MA, Ahn YO, Bishop DT, Bost J, Budai B, Chen K, Gemignani F,Keku T, Lima CS, Le Marchand L, Matsuo K, Moreno V, Plaschke J, Pufulete M,Thomas SB, Toffoli G, Wolf CR, Moore CG, Little J. Meta- and pooled analyses of the methylenetetrahydrofolate reductase (MTHFR) C677Tpolymorphism and colorectal cancer: a HuGE-GSEC review. Am J Epidemiol. 2009 Nov 15;170(10):1207-21[98] Ulrich CM, Kampman E, Bigler J, Schwartz SM, Chen C, Bostick R, Fosdick L, Beresford SA, Yasui Y, Potter JD.Colorectal adenomas and the C677T MTHFR polymorphism: evidence for gene-environment interaction? Cancer Epidemiol Biomarkers Prev 8, 659-68, 1999. [99] Ulvik A, Evensen ET, Lien EA, Hoff G, Vollset SE, Majak BM, Ueland PM. Smoking, folate and methylenetetrahydrofolate reductase status as interactive determinants of adenomatous and hyperplastic polyps of colorectum. Am J Med Genet 101, 246-54, 2001.[100] Vakili S, Caudill MA. Personalized nutrition: nutritional genomics as a Van Hove JL, Josefsberg S, Freehauf C, Thomas JA, Thuy le P, Barshop BA, van Ommen B, Fairweather-Tait S, Freidig A, Kardinaal A, Scalbert A, Wopereis S. A network biology model of micronutrient related health. Br J Nutr. 2008 Jun;99 Suppl 3:S72-80.[101] Van Hove JL, Josefsberg S, Freehauf C, Thomas JA, Thuy le P, Barshop BA, Woontner M, Mock DM, Chiang PW, Spector E, Meneses-Morales I, Cervantes-Roldán R, León-Del-Río A. Management of a patient with holocarboxylase synthetase deficiency. Mol Genet Metab. 2008 Dec;95(4):201-5.[102] Velculescu VE, Zhang L, Zhou W, Vogelstein J, Basrai MA, Bassett DE Jr, Hieter P, Vogelstein B, Kinzler KW. Characterization of the yeast transcriptome. Cell. 1997 Jan 24;88(2):243-51.[103] Venter JC, Adams MD, Myers EW, Li PW, Mural RJ, Sutton GG, Smith HO, Yandell M, Evans CA, Holt RA, Gocayne JD, Amanatides P, Ballew RM, Huson DH, Wortman JR, Zhang Q et al.The sequence of the human genome. Science. 2001 Feb 16;291(5507):1304-51. Erratum in: Science 2001 Jun 5;292(5523):1838. [104] Vieth R. Experimentally observed vitamin D requirements are higher than extrapolated ones. Am J Clin Nutr. 2009 Oct;90(4):1114-5[105] Vijaya Lakshmi SV, Naushad SM, Seshagiri Rao D, Kutala VK. Oxidative Stress is Associated with Genetic Polymorphisms in One-Carbon Metabolism in Coronary Artery Disease. Cell Biochem Biophys. 2011 Dec 7. 3: [106] Vinukonda G, Shaik Mohammad N, Md Nurul Jain J, Prasad Chintakindi K, Rama Devi Akella R. Genetic and environmental influences on total plasma homocysteine and coronary artery disease (CAD) risk among South Indians. Clin Chim Acta. 2009 Jul;405(1-2):127-31.[107] Wald DS, Morris JK, Wald NJ. Reconciling the evidence on serum homocysteine and ischaemic heart disease: a meta-analysis. PLoS One. 2011 Feb 2;6(2):e16473.[108] Wasinger VC, Cordwell SJ, Cerpa-Poljak A, Yan JX, Gooley AA, Wilkins MR, Duncan MW, Harris R, Williams KL, Humphery-Smith I. Progress with gene-product mapping of the Mollicutes: Mycoplasma genitalium. Electrophoresis. 1995 Jul;16(7):1090-4.[109] Willett WC. Dietary fat plays a major role in obesity: no. Obes Rev. 2002[110] Williams RJ. Biochemical Individuality: The Basis for the Genetotrophic Concept John Wiley & Sons, 1956; University of Texas Press, 1969 to 1979; Keats Publishing, 1998 (With a new foreword by Jeffrey Bland)[111] Wittwer J, Rubio-Aliaga I, Hoeft B, Bendik I, Weber P, Daniel H.Nutrigenomics in human intervention studies: current status, lessons learned and future perspectives. Mol Nutr Food Res. 2011 Mar;55(3):341-58.[112] Yeung E, Qi L, Hu FB, Zhang C. Novel abdominal adiposity genes and the risk of type 2 diabetes: findings from two prospective cohorts. Int J Mol Epidemiol Genet. 2011;2(2):138-44.
Autor
Dr. Alexander Ströhle, Am Landwehrgraben 8, 30519 Hannover,
E-Mail: stroehle@nutrition.uni-hannover.de



















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.