
- DAZ.online
- DAZ / AZ
- DAZ 25/2011
- Manuka-Honig
DAZ wissenswert
Manuka-Honig
Manuka-Honig wird in Deutschland mit einer medizinischen Zweckbestimmung angeboten. Er befindet sich in verschiedenen Wirkstufen im Handel und kostet ein Vielfaches des üblichen Honigs. Was sind seine besonderen Eigenschaften?
Zusammensetzung des Honigs
Honig wird von Honigbienen aus dem Nektar von Blüten oder aus Honigtau erzeugt. Seine chemische Zusammensetzung ist so verschieden wie die Futterquellen der Bienen. Je 20 bis 45% Fructose und Glucose und ca. 20% Wasser stellen die Hauptinhaltsstoffe dar; weitere Komponenten sind bis 7% Disaccharide (Saccharose, Maltose, Isomaltose), bis 2% Oligosaccharide, Pollen, Mineralstoffe, Proteine, Enzyme (Glucoseoxidase, Invertase, Phosphatase, Diastase, Katalase, Amylase u. a.), freie Aminosäuren (Prolin u. a.), Vitamine, Farb- und Aromastoffe [2].
In der alten Welt verzehrten die Menschen schon in der Steinzeit Honig, in Amerika erst seit Kolumbus. Honig ist – wie Wein – ein Produkt mit örtlichen und witterungsbedingten Qualitätsunterschieden und "reift" während der Lagerung.
Aufgrund der hohen Zuckerkonzentration verursacht Honig bei lebenden Zellen eine Osmose und kann dadurch bakterizid wirken. Zudem bildet die Glucoseoxidase Wasserstoffperoxid, das desinfizierend wirkt. Die klinische Evidenz der physikalischen und der chemischen Wirkung von Honig ist allerdings umstritten [22]. Gleiches gilt für eine dem Honig nachempfundene Polyvidon-Iod-Zucker-Salbe (NRF 11.42.) [1].
Unique Manuka Factor
Manuka-Honig verfügt – über die beschriebenen physikalischen und chemischen Wirkungen hinaus – über einen "einzigartigen Manuka-Effekt" (Unique Manuka Factor, UMF®). Entsprechend der in vitro gemessenen Bakterienhemmung wird Manuka-Honig in verschiedenen Wirkstärken angeboten, z. B. UMF 10 oder UMF 25.
Die Arbeitsgruppe des Lebensmittelchemikers Professor Thomas Henle, TU Dresden, hat gezeigt, dass der UMF auf den Aldehyd Methylglyoxal (MGO®) zurückzuführen ist [3]. MGO kommt in Konzentrationen von 20 bis 800 mg/kg im Manuka-Honig vor; ab ca. 100 mg/kg wirkt es bakteriostatisch oder bakterizid (Tab. 1).
Tab. 1: Korrelation von Unique Manuka Factor (UMF) und MGO-Konzentration | |
UMF |
MGO-Konzentration |
10 |
100 mg/kg |
15 |
250 mg/kg |
20 |
400 mg/kg |
25 |
550 mg/kg |
Methylglyoxal entsteht bei der Umwandlung des Nektars zu Honig im Darm der Biene (s. u.) – allerdings nur dann in größeren Mengen, wenn der Nektar vom Manuka-Baum oder Manuka-Strauch (auch: Südseemyrte, Leptospermum scoparium) stammt, der in Neuseeland endemisch vorkommt.
Auf der Südhalbkugel der Erde gibt es etwa 50 Arten und Unterarten der Gattung Leptospermum , die mit dem Teebaum (Melaleuca alternifolia) und dem Kanuka-Baum (Kunzea ericoides) nah verwandt sind (Familie Myrtaceae). Ihre Honige können aufgrund von Pollenanalysen differenziert werden; doch versagt diese Methode bei Kanuka-Honig [16, 17]. Da der Kanuka-Baum etwas später blüht als der Manuka-Baum, können die Imker dennoch einen nicht mit Kanuka-Honig vermischten Manuka-Honig gewinnen, indem sie den Honig gleich nach der Manuka-Tracht schleudern, bevor die Bienen Kanuka-Nektar sammeln können. Dies ist jedoch kaum zu kontrollieren; daher wird Manuka-Honig als "rein" bezeichnet, wenn er zu mindestens 51% aus dem Nektar von Manuka oder Kanuka gebildet wurde.
Da Kanuka- und andere Honigsorten nur etwa 10 mg/kg MGO enthalten, schwankt auch der MGO-Gehalt von "reinem" Manuka-Honig beträchtlich [19].
Wie MGO entsteht
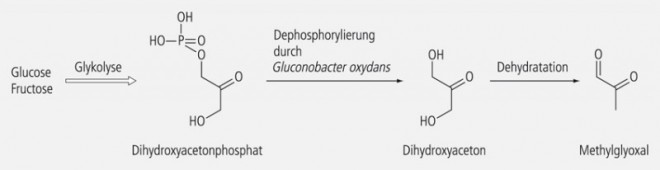
Dihydroxyaceton (DHA) ist als Selbstbräunungsmittel bekannt und in diversen hierfür angebotenen Cremes enthalten. Sein Phosphat ist ein Zwischenprodukt der Photosynthese und entsteht auch bei der Glykolyse von Glucose und Fructose. Das endosymbiontisch im Darm der Honigbiene lebende und am Reifungsprozess des Honigs beteiligte Bakterium Gluconobacter oxydans kann das Dihydroxyacetonphosphat zu DHA dephosphorylieren [5]; durch Dehydratation von DHA entsteht dann MGO (s. Grafik). Dieser Prozess läuft in größerem Ausmaß nur im Manuka-Honig ab. Die Ursache dafür ist noch nicht geklärt.
Heute wird mancher neuseeländische Honig mit MGO, das als preiswerte Laborchemikalie zur Verfügung steht, versetzt, um ein niederpreisiges Lebensmittel in ein hochwertiges "Naturarzneimittel" zu verwandeln. Das entsprechende Verfahren wurde zum Patent angemeldet [7]. Kanuka-Honig (von Kunzea ericoides) ist nach dieser Behandlung von Manuka-Honig (von Leptospermum scoparium) nicht zu unterscheiden, denn die sonst bei Honig übliche Pollenanalyse ist hier nicht anwendbar (s. o.).
Wirkungen und Nebenwirkungen von MGO
Eine Korrelation der Konzentration des Wirkstoffs MGO und der bakteriziden Wirkung des Manuka-Honigs konnte klar gezeigt werden [3]; ebenso, dass MGO generell zytotoxisch wirkt, so auch gegen Protozoen, Pilze /Hefen und Krebszellen [10].
Methylglyoxal und seine Reaktionsprodukte mit Zuckern und Aminosäuren wurden aufgrund von Tierversuchen mit Diabetes und anderen neurodegenerativen Erkrankungen in Verbindung gebracht [4]; daher sollten Patienten, die an Diabetes leiden, nicht mit Manuka-Honig behandelt werden [9]. Mutagene Wirkungen von MGO wurden ebenfalls nachgewiesen [11]. MGO hat jedoch unter physiologischen Bedingungen in der Regel keine negativen Folgen, weil es durch Glyoxalasen abgebaut wird. Eine kritische Bewertung ergab, dass MGO mehr nützliche als schädliche Wirkungen auf den Organismus ausübt [10].
Arzneimittelrechtliche Einstufung
Mit Manuka-Honig kann am menschlichen Körper eine immunologische Wirkung erzielt werden. Wenn darin seine bestimmungsgemäße Hauptwirkung liegt, ist er nicht als Medizinprodukt (§ 3 MPG), sondern als (Funktions)arzneimittel zu bewerten (§ 2 AMG). Diese Bewertung orientiert sich an einem Urteil des Verwaltungsgerichts Düsseldorf von 1997 über den Status von Teebaumöl: Dieses ist je nach der überwiegenden Zweckbestimmung entweder als Kosmetikum oder als Arzneimittel einzustufen [11].
Dagegen ist das zur Behandlung von Wunden dienende Präparat Medihoney™, das von verschiedenen Leptospermum-Arten stammt, im August 2005 europaweit als Medizinprodukt zugelassen worden. Der Hersteller hatte in dem vorausgegangenen Zertifizierungsverfahren dargelegt, dass die Wirkung auf dem osmotischen Effekt beruht und damit auf rein physikalische Weise zustande kommt [1, 8]. Aufgrund der ausgeprägten mikrobiziden Wirksamkeit von Manuka-Honig wurde schon 2007 die Einstufung als Medizinprodukt Klasse IIa angezweifelt [21] – lange bevor der eigentliche Wirkstoff MGO identifiziert war. Nach den heutigen Kenntnissen über den Inhaltsstoff MGO ist die Einstufung als Medizinprodukt infrage zu stellen, zumal die analytisch nachgewiesene Konzentration im Handelspräparat ein Vielfaches der für eine bakterizide Wirkung notwendigen Mindestkonzentration ausmacht.
Da Manuka-Honig-Produkte nicht als Arzneimittel zugelassen sind, ist deren Abgabe in der Apotheke nur als Rezeptur bzw. verlängerte Rezeptur zulässig (§ 21 Abs. 2 Nr. 1 AMG). Somit trägt der verschreibende Arzt die Verantwortung für eventuelle Komplikationen bei der Therapie.
Fazit
Größere publizierte Studien belegen keine klinische Evidenz für Honigprodukte zur Heilung chronischer Wunden [12 – 15]. Manuka-Honig sollte daher nur bei nicht chronischen Wunden, z. B. infolge einer Verbrennung, einer Verletzung oder eines chirurgischen Eingriffs, oder bei Hautschädigungen durch eine Strahlentherapie zur Anwendung kommen. Bisher gibt es nur wenige tierexperimentelle oder klinische Studien zu dieser Variante der feuchten Wundbehandlung [18, 20].
Literatur
[1] Probst W, Vasel-Biergans A. Wundmanagement. 2. Aufl. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2010, S. 225 f.
[2] Herold E, Weiß K. Neue Imkerschule. 9. Aufl. Ehrenwirth Verlag, München 1995.
[3] Mavric E, et al. Identification and quantification of methylglyoxal as the dominant antibacterial constituent of Manuka (Leptospermum scoparium) honeys from New Zealand. Mol Nutr Food Res 2008;52. doi: 10.1002/mnfr.200700282.
[4] Adams CJ, et al. The origin of methylglyoxal in New Zealand manuka (Leptospermum scoparium) honey. Carbohydr Res 2009;344:1050 – 1053 [5] Ruiz-Argueso T, Rodriguez-Navarro A. Microbiology of Ripening Honey. Appl Microbiol 1975;30:893 – 896.
[6] Kloesel/Cyran. Arzneimittelrecht Kommentar, § 2, Blatt 4z, Teebaumöl. – VG Düsseldorf 4.9.1997, Az.: 16 L 1641/97, in: Pharmarecht 1997:441.
[7] WO0020100082845 (Originaldokument: NZ2009/000301), publiziert 2010-07-22.
[8] (du). Renaissance eines Naturheilmittels: Honig heilt fast alle Wunden. Dtsch Apoth Ztg 2006;146: 3404 – 3405.
[9] Majtan J. Methylglyoxal – A Potential Risk Factor of Manuka Honey in Healing of Diabetic Ulcers. Evid Based Complem Altern Med 2011, Article ID 295494,5. doi:10.1093/ecam/neq013.
[10] Talukdar D, et al. Critical evaluation of toxic versus beneficial effects of methylglyoxal. Biochemistry (Moscow) 2009;74:1059-1069. doi: 10.1134/S0006297909100010.
[11] Murata-Kamiya N, Kamiya H. Methylglyoxal, an endogenous aldehyde, crosslinks DNA polymerase and the substrate DNA. Nucl Acids Res 2001;29:3433 – 3438.
[12] Jull A, et al. Randomized clinical trial of honey-impregnated dressings for venous leg ulcers. Br J Surg 2008;95(2):175-182. – Jull AB, et al. Honey as a topical treatment for wounds. Cochrane Database of Systematic Reviews 2008, Issue 4. Art. No.: CD005083; doi:10.1002/ 14651858.CD005083.pub2.
[13] Medhi B, et al. Topical Application of Honey in the Treatment of Wound Healing: A Metaanalysis. JK Science 2008;10(4).
[14] Rosengren H, Dixon A. Antibacterial Prophylaxis in Dermatologic Surgery: An Evidence-Based Review. Am J Clin Dermatol 2010;11:35 – 44. [15] Weller CD. A simple guide to randomised control trials in wound care. EWMA J 2009;9(2):5 – 13.
[16] Stephens JM, et al. Phenolic compounds and methylglyoxal in some New Zealand manuka and kanuka honeys. Food Chem 2010;120: 78 – 86.[17] Kaskoniene V, Venskutonis PR. Floral Markers in Honey of Various Botanical and Geographic Origins: A Review. Comp Rev Food Sci Food Safety 2010;9:620-634. doi: 10.1111/j.1541-4337.2010.00130.x.
[18] Farrokhi MR, et al. Effect of Honey on Peridural Fibrosis Formation after Laminectomy in Rats: A Novel Experimental Study. Evid Based Complem Altern Med 2011, Article ID 504967,6. doi: 10.1155/2011/504967.
[19] Adams CJ, et al. Isolation by HPLC and characterisation of the bioactive fraction of New Zealand manuka (Leptospermum scoparium) honey. Carbohydr Res 2008;343:651 – 659.
[20] Simon A, et al. Wound care with antibacterial honey (Medihoney) in pediatric haematology-oncology. Support Care Cancer 2006;14: 91 – 97. [21] Igelbrink D, et al. Mikrobiozide Wirksamkeit von Medihoney™. GMS Krankenhaushyg Interdiszip 2007;2(2):Doc50.
[22] Santos K, Sellmer W. Honig – Renaissance eines alten Heilmittels? Die Schwester Der Pfleger 2007;46:412 – 414.
Autoren
Daria Heuer, Dr. Lutz Heuer und Dr. Valentin Saalfrank
Korrespondenzautor
Dr. Lutz Heuer, Am Krausberg 31, 41542 Dormagen























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.