
- DAZ.online
- DAZ / AZ
- DAZ 25/2011
- Langkettige Omega-3-Fetts...
Ernährung
Langkettige Omega-3-Fettsäuren: Bedeutung und Versorgungskonzept
Die den gesundheitsfördernden Effekten der Omega-3-Fettsäuren zugrunde liegenden Mechanismen sind multifaktoriell. Wesentliche Grundlagen sind die Regulation der Genexpression und eine hiermit verbundene Beeinflussung verschiedener Stoffwechselwege sowie die Veränderung der Zusammensetzung zellulärer Membranen – auch ihrer physikalischen Eigenschaften wie Mikrofluidität – und ihrer Funktionen. Weiterhin ist im Stoffwechsel der Omega-3-Fettsäuren die Synthese zahlreicher bioaktiver, als Lipidmediatoren im Organismus regulatorisch wirksamer Moleküle bedeutsam.
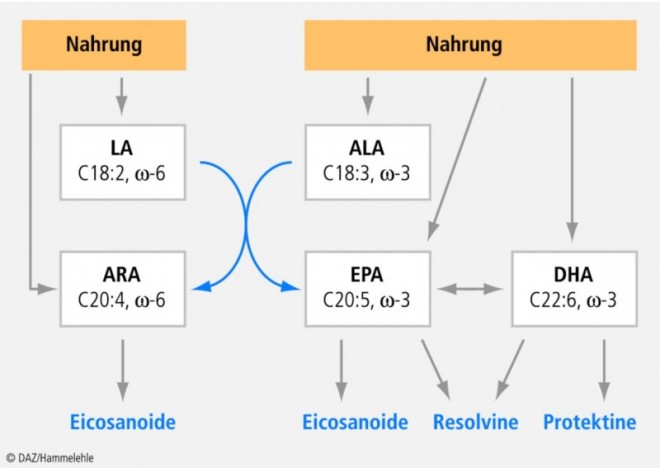
Der Stoffwechsel mehrfach ungesättigter Fettsäuren
Sowohl Omega-3- als auch Omega-6-Fettsäuren gehören zu den mehrfach ungesättigten Fettsäuren. Sie unterscheiden sich in der Position der ersten Doppelbindung, vom Methylende des Moleküls her betrachtet. Diese befindet sich bei Omega-3-Fettsäuren am dritten und bei den Omega-6-Fettsäuren am sechsten Kohlenstoffatom. Im Organismus weisen die beiden Fettsäurefamilien einen getrennten Stoffwechsel auf, und ihr Wirkprofil ist ebenfalls unterschiedlich.
Omega-3-Fettsäuren
Alpha-Linolensäure (ALA) mit einer Kettenlänge von 18 Kohlenstoffatomen und drei Doppelbindungen (C 18:3, ω-3) ist eine pflanzliche Omega-3-Fettsäure und zählt zu den essenziellen Fettsäuren. Sie ist reichlich in Raps-, Lein- und Walnussöl enthalten. Zu den langkettigen Omega-3-Fettsäuren zählen die Eicosapentaensäure (EPA) mit 20 Kohlenstoffatomen und fünf Doppelbindungen (C 20:5, ω-3) und die Docosahexaensäure (DHA) mit 22 Kohlenstoffatomen und sechs Doppelbindungen (C 22:6, ω-3). EPA und DHA kommen in größeren Mengen in fettreichen Meeresfischen wie Lachs, Thunfisch, Hering, Makrele und Sardine, in bestimmten Mikroalgen (z. B. Ulkenia) sowie in Krill-Öl vor, DHA auch in Eiern. Docosapentaensäure (DPA) mit 22 Kohlenstoffatomen und fünf Doppelbindungen (C 22:5, ω-3) wird in geringen Mengen auch in Fleisch gefunden [1, 2, 3].
Eine Kettenverlängerung von ALA ist im menschlichen Organismus möglich. Die durchschnittliche Konversionsrate liegt jedoch bei unter 5 Prozent für die Bildung von EPA und bei etwa 0,5 Prozent für die Bereitstellung von DHA. Hieraus resultiert das gesundheitsfördernde Potenzial einer Zufuhr von EPA und DHA [1, 4, 5].
Omega-6-Fettsäuren
In der heute üblichen Kost ist die häufigste mehrfach ungesättigte Fettsäure die Linolsäure (LA), eine Omega-6-Fettsäure mit 18 Kohlenstoffatomen und zwei Doppelbindungen (C 18:2, ω-6), die ebenso wie ALA essenziell ist [2]. Sie kommt reichlich in vielen pflanzlichen Ölen – z. B. Sonnenblumen-, Distel-, Soja- und Maiskeimöl – vor und besitzt kardioprotektive Wirkungen. Durch Kettenverlängerung entsteht aus ihr im menschlichen Organismus Eicosatetraensäure, allgemein als Arachidonsäure (ARA) bezeichnet, eine Omega-6-Fettsäure mit 20 Kohlenstoffatomen und vier Doppelbindungen (C 20:4, ω-6).
Omega-3 und Omega-6 sowie aus ihnen gebildete Lipidmediatoren sind Konkurrenten im Stoffwechsel
Omega-3- und Omega-6-Fettsäuren sind nicht ineinander umwandelbar. Die jeweilige Kettenverlängerung von LA (ω-6) einerseits und ALA (ω-3) andererseits verläuft getrennt, wird jedoch durch dasselbe Enzymsystem katalysiert, woraus sich Konkurrenzbeziehungen im Stoffwechsel ergeben (Abb. 1). Eine kompetitive Hemmung des geschwindigkeitsbestimmenden Enzyms der Kettenverlängerung – der Delta-6-Desaturase – durch eine hohe LA-Zufuhr vermindert die Konversion von ALA zu EPA. Eine niedrige LA-Zufuhr kann umgekehrt zu einer erhöhten Konversionsrate von ALA führen [6]. Die Aktivität der Delta-6-Desaturase wird noch von weiteren Faktoren beeinflusst, darunter dem Geschlecht, dem Alter, der Versorgung mit Co-Faktoren für die Enzymfunktion, der Zufuhr gesättigter Fettsäuren, Alkoholkonsum und Rauchen.
Von grundlegender Bedeutung ist die Metabolisierung der langkettigen mehrfach ungesättigten Fettsäuren zu bioaktiven Verbindungen, d. h. die Bildung von Eicosanoiden aus ARA (ω-6) und EPA (ω-3). Zu den Eicosanoiden gehören die Prostaglandine und Thromboxane sowie die Leukotriene. Als Gewebshormone wirken sie lokal in äußerst geringen Mengen als Stoffwechselmediatoren.
Die Balance zwischen den aus ARA und aus EPA abgeleiteten Eicosanoiden ist wesentlich: Summarisch wird angenommen, dass eine Gleichgewichtsverschiebung zugunsten der aus ARA (d. h. zu Ungunsten der aus EPA) gebildeten Eicosanoide vorrangig gefäßverengende und gerinnungsfördernde Bedingungen verstärkt und gleichzeitig das Entzündungsgeschehen fördert [1, 4].
In jüngster Zeit konnte die Bildung weiterer Lipidmediatoren aus EPA und DHA mit antiinflammatorischen, antifibrotischen und antiapoptotischen Effekten nachgewiesen werden. Hierzu gehören vor allem Resolvine, die lokal in die aktive Rückbildung von Entzündungen einbezogen sind. Es wurden sowohl von EPA als auch von DHA abgeleitete Resolvine charakterisiert (Resolvine der E- und D-Serie). Letztere sind den Docosanoiden zuzuordnen und besitzen als Signalmoleküle vor allem im Nervengewebe und im Gehirn als Protektine verschiedene Schutzfunktionen [7, 8].
Physiologische und präventive Bedeutung von EPA und DHA
Vor der Geburt und im Kindesalter
DHA ist ein wesentlicher struktureller und funktioneller Membranbestandteil von Nervenzellen – im Gehirn und in der Retina. Sie ist ein Baustein des Phospholipids Phosphatidylserin, das an der Freisetzung von Neurotransmittern und an synaptischen Aktivitäten beteiligt ist. Dementsprechend wirkt sich die Anreicherung von DHA in Gehirn und Retina während des Fetalstadiums und im frühen Säuglingsalter auf kognitive und motorische Funktionen sowie visuelle Fähigkeiten des Kindes aus. Deshalb ist die DHA-Zufuhr während der Schwangerschaft und Stillzeit für die kindliche Entwicklung entscheidend [9, 10]. Eine ausreichende Versorgung mit langkettigen Omega-3-Fettsäuren wirkt weiterhin dem Risiko für Frühgeburten entgegen. Aus all diesen Gründen beinhalten grundlegende Empfehlungen für Schwangere und Mütter in der Stillperiode eine mittlere tägliche Aufnahme von mindestens 200 mg DHA [11, 12].
Auch im weiteren Kindesalter ist ein ausreichendes Angebot der "Gehirnfettsäure" DHA wichtig für die Entwicklung des Verhaltens und Lernvermögens und möglicherweise von protektiver Bedeutung bezüglich Aufmerksamkeitsstörungen [13, 14].
Im mittleren und höheren Lebensalter
Multiple gesundheitsfördernde Effekte von EPA und DHA bestehen in sämtlichen Lebensperioden. Einerseits tragen sie zur Prävention verschiedener Erkrankungen bei, die mit zunehmendem Lebensalter gehäuft auftreten (Tab. 1). Andererseits wirken sie verschiedenen normalen Veränderungen entgegen, die mit dem biologischen Altern verbunden sind.
Für EPA und DHA wird unabhängig von einem Beitrag zur Prävention definierter Erkrankungen ein günstiger Einfluss auf Prozesse des biologischen Alterns diskutiert. So wirken DHA und die aus ihr gebildeten Neuroprotektine kognitiven Funktionsverlusten während des normalen biologischen Alterns entgegen [35]. Im Zellkern ist eine inverse Beziehung zwischen der Verkürzung von Telomeren (Chromosomen-Enden) als Indikator der Zellalterung und dem EPA/DHA-Blutspiegel zu beobachten [36].
Tab. 1: Erkrankungen, die durch langkettige Omega-3-Fettsäuren günstig beeinflusst werden | |
Erkrankung |
Literatur |
Kardiovaskuläre Erkrankungen einschließlich Risikofaktoren wie Lipidstoffwechselstörungen, Hypertonie, gesteigerte Thrombozytenaggregation |
[1, 3, 4, 5, 15 – 26] |
Neurologische Erkrankungen, vor allem Depressionen, sowie Neurodegenerative Erkrankungen wie M. Alzheimer |
[1, 27, 28, 29] |
Gelenk- und Knochenerkrankungen, speziell Rheuma und Osteoporose |
[1, 30] |
Augenerkrankungen, insbesondere altersbedingte Makuladegeneration und Sicca-Syndrom |
[1, 31, 32] |
Hauterkrankungen und Allergien, u. a. Psoriasis und Neurodermitis |
[1, 33] |
Entzündliche Darmerkrankungen wie Colitis ulcerosa |
[1, 34] |
Kardiovaskuläre Erkrankungen und langkettige Omega-3-Fettsäuren
Epidemiologische und klinische Studien
Epidemiologische Studien weltweit weisen auf eine günstige Beeinflussung kardiovaskulärer Risikofaktoren durch eine hohe Zufuhr langkettiger Omega-3-Fettsäuren hin und zeigen inverse Beziehungen zwischen ihrer Aufnahme und dem Risiko für plötzlichen Herztod und Koronare Herzkrankheit. Dabei wird eine niedrige Prävalenz kardiovaskulärer Erkrankungen in der Bevölkerung von Ländern mit traditionell hohem Fischverzehr beobachtet [17, 37].
Umfassende randomisierte, kontrollierte klinische Studien unter Einbeziehung von Patienten mit und ohne bekannte kardiovaskuläre Erkrankungen haben einen hohen Stellenwert von Fischverzehr und langkettigen Omega-3-Fettsäuren in der Primär- und Sekundärprävention ergeben [19, 20, 22].
Dabei lässt sich bei Tagesdosen von 250 mg bis 500 mg EPA/DHA ein nichtlinearer Dosis-Wirkungsverlauf bezüglich der kardiovaskulären Mortalität erkennen [3].
Das kardioprotektive Potenzial langkettiger Omega-3-Fettsäuren wird durch antiarrhythmische, antihypertensive sowie antiinflammatorische Wirkungen, eine herabgesetzte Thrombozytenaggregation und eine verbesserte Endothelfunktion begründet [20, 21]. Ihr Wirkprofil umfasst weiterhin eine ausgeprägte Senkung des Plasma-Triglyceridspiegels, zurückzuführen auf eine verringerte Synthese und einen verstärkten Abbau triglyceridreicher Lipoproteine, und einen Anstieg des HDL-Cholesterolspiegels. Der LDL-Cholesterolspiegel bleibt unverändert, teilweise wird auch ein geringer Anstieg beobachtet. Dabei ist der Anteil der atherogenen "small dense LDL-Partikel" vermindert [20].
Fischöl- und Omega-3-Fettsäuren-Präparate werden mit der Indikation einer Hypertriglyceridämie therapeutisch eingesetzt, wenn durch diätetische Maßnahmen allein kein ausreichendes Ansprechen erreichbar ist. Die dosisabhängige Senkung des Triglyceridspiegels durch EPA/DHA ist bereits bei lebensmitteltypischen Dosierungen von 200 bis 500 mg pro Tag zu beobachten [24]; die Therapie von Hypertriglyceridämien erfolgt mit höheren Dosierungen. Bei Patienten mit gemischter Hyperlipidämie (Hypercholesterolämie / Hypertriglyceridämie) ist der kombinierte Einsatz langkettiger Omega-3-Fettsäuren mit Statinen (Hemmstoffen der Cholesterolsynthese) sinnvoll, da sich das Wirkungsspektrum beider Substanzgruppen effektiv ergänzt [4, 38]. Wesentliche kardiologische Fachgesellschaften empfehlen EPA und DHA zur Prävention des plötzlichen Herztodes und im Rahmen der Sekundärprophylaxe nach Myokardinfarkt [18].
Der "Omega-3-Index" als Risikomarker
Der "Omega-3-Index" ist eine standardisiert messbare Größe zur Charakterisierung des Versorgungsstatus mit langkettigen Omega-3-Fettsäuren. Er drückt den prozentualen Anteil von EPA und DHA bezogen auf die Gesamtfettsäuren in der Membran von Erythrozyten aus. Somit spiegelt er die Gewebekonzentrationen an langkettigen Omega-3-Fettsäuren wider. Bei Patienten mit kardiovaskulären Erkrankungen ist der "Omega-3-Index" ein grundlegender Risikomarker, denn eine ausgeprägte Verminderung des Wertes stellt einen Risikofaktor dar [23, 39].
Zufuhrempfehlungen für EPA und DHA
Die aktuelle Versorgungssituation
Die Versorgung mit langkettigen Omega-3-Fettsäuren hat sich in Deutschland in den letzten Jahren gebessert. Während in der Vergangenheit im Mittel weniger als 100 mg EPA/DHA pro Tag aufgenommen wurden, nehmen die Deutschen im statistischen Durchschnitt heute ca. 200 mg EPA/DHA pro Tag auf [40]. Diese Menge ist jedoch vor dem Hintergrund der vielen positiven Eigenschaften von EPA und DHA für die Gesundheit als zu niedrig einzustufen. Besonders im Jugend- und jungen Erwachsenenalter ist eine unzureichende Zufuhr zu verzeichnen [41]. Auch der relative Anteil mehrfach ungesättigter Fettsäuren insgesamt an der Zufuhr von Fettsäuren ist zu gering [42].
Zufuhrempfehlungen
Der Arbeitskreis Omega-3 e.V. empfiehlt für die Allgemeinbevölkerung eine durchschnittliche Aufnahme von mehr als 300 mg der langkettigen Omega-3-Fettsäuren EPA/DHA pro Tag [43, 44]. Diese Zufuhrempfehlungen stehen in Einklang mit Empfehlungen, die von wesentlichen Fachgesellschaften und Gremien formuliert wurden.
Frauen in der Schwangerschaft und Stillzeit sollen durchschnittlich täglich mindestens 200 mg DHA zu sich nehmen [11]. Auch bei Kindern und Jugendlichen, bei Vegetariern/Veganern sowie Leistungssportlern ist auf eine gute Versorgung mit Omega-3-Fettsäuren zu achten [41, 45, 46]. Für verschiedene Erkrankungen bestehen Indikationen zum therapeutischen Einsatz mit Dosierungen von 1000 mg EPA/DHA pro Tag oder höher [4, 18, 38].
Gemischtes Versorgungskonzept
Weiterhin empfiehlt der Arbeitskreis Omega-3 ein gemischtes Versorgungskonzept, das den Verzehr von Fisch, die Bevorzugung ALA-reicher Pflanzenöle gegenüber Ölen mit hohem LA-Anteil, den Verzehr von mit EPA/DHA angereicherten Produkten und situationsbedingt die Einnahme von Präparaten zur Nahrungsergänzung einschließt [1, 44]. Öle mit hohem ALA-Anteil (ω-3) sind zu bevorzugen, weil LA (ω-6) die ohnehin geringe Konversion von ALA zu EPA im Organismus noch weiter drosselt. ALA-reich sind Raps-, Lein- und Walnussöl, während Sonnenblumen-, Distel- und Weizenkeimöl LA-reich sind. Der Anteil gesättigter Fettsäuren in der Nahrung soll grundsätzlich begrenzt sein.
Die Zufuhrempfehlungen für EPA und DHA für Gesunde können durch den Verzehr von Fisch und Fischzubereitungen wie Fischkonserven erreicht werden; fettreiche Kaltwasserfische zeichnen sich durch einen besonders hohen Gehalt an langkettigen Omega-3-Fettsäuren aus [1, 4].
Eine gezielte Aufnahme von EPA und DHA ist durch Nahrungsergänzungsmittel möglich. Fischölkapseln mit einer standardisierten (und deklarierten!) Menge an EPA und DHA spielen hierbei eine große Rolle, ebenso DHA-Algenöl. Den Präparaten sollte Vitamin E als Antioxidanz zugesetzt sein. Wie bei anderen Nahrungsergänzungsmitteln darf die empfohlene tägliche Verzehrsmenge nicht überschritten werden [48].
Um die Aufnahme langkettiger Omega-3-Fettsäuren zu erhöhen, ist der Konsum von mit EPA/DHA angereicherten Lebensmitteln sinnvoll. Derartige funktionelle Lebensmittel schließen Brot / Brötchen, Fischzubereitungen, Joghurt, Margarine und Eier ein [1, 44].
Für die Versorgung mit langkettigen Omega-3-Fettsäuren entsprechend definierten Zweckbestimmungen sind ergänzende bilanzierte Diäten verfügbar. Als "Diätetisches Lebensmittel für besondere medizinische Zwecke (bilanzierte Diät)" sind sie für die Behandlung von Personen vorgesehen, für die eine normale Ernährung nicht ausreichend ist [48]. Zum therapeutischen Einsatz bei definierten Indikationen wie Sekundärprophylaxe nach Herzinfarkt und Hypertriglyceridämie [4, 18, 19] stehen langkettige Omega-3-Fettsäuren in Form von Arzneimitteln zur Verfügung.
Fazit
Als Fazit ergibt sich, dass ein praktikables gemischtes Versorgungskonzept für breite Bevölkerungskreise mehrere Komponenten einschließen sollte. Die Grundlage stellt eine Ernährungsweise mit optimaler Relation der Hauptklassen von Nahrungsfettsäuren, Fischkonsum und auch eine weitgehende Verwendung von Pflanzenölen mit hohem ALA-Gehalt dar. Weiterhin ist der Verzehr von mit EPA und DHA angereicherten Lebensmitteln empfehlenswert, ebenso eine nahrungsergänzende Einnahme von Fischölkapseln, insbesondere für Personengruppen mit erhöhtem Bedarf und präventivmedizinisch zu erwartendem Nutzen. Spezielle Indikationen liegen für die therapeutische Anwendung langkettiger Omega-3-Fettsäuren bei verschiedenen Erkrankungen vor.
Literatur
[1] Hamm M, Neuberger D (2008): Omega-3 aktiv – Gesundheit aus dem Meer. Hannover: Schlütersche Verlagsges.
[2] Kasper H (2009): Ernährungsmedizin und Diätetik. München: Elsevier Urban & Fischer, 11. Auflage.
[3] Harris WS, et al (2009): Towards establishing dietary reference intakes for eicosapentaenoic and docosahexaenoic acids. J Nutr 139: 804 – 819.
[4] Singer P (2010): Praktische Aspekte bei der Zufuhr von Omega-3-Fettsäuren. E&M – Ernährung und Medizin 25 (Suppl 1): 3 – 18.
[5] Wang CH, et al (2006): N-3 fatty acids from fish or fish-oil supplements, but not α-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr 84: 5 – 17.
[6] Liou YA, et al (2007): Decreasing linoleic acid with constant α-linolenic acid in dietary fats increases (n-3) eicosapentaenoic acid in plasma phospholipids in healthy men. J Nutr 137: 945 – 952.
[7] Bannenberg G, Serhan CN (2010): Specialized pro-resolving lipid mediators in the inflammatory response: An update. Biochim Biophys Acta 1801: 1260 – 1273.
[8] Arnold C, et al (2010): Cytochrome P450-dependent metabolism of omega-6 and omega-3 long-chain polyunsaturated fatty acids. Pharmacol Rep 62: 536 – 547.
[9] Saldanha LG, Salem N Jr., Brenna JT (2009): Workshop on DHA as a nutrient: Overview. Prostaglandins Leukot Essent Fatty Acids 81: 233 – 236.
[10] Bakker EC, et al (2009): Relationship between long-chain polyunsaturated fatty acids at birth and motor function at 7 years of age. Eur J Clin Nutr 63: 499 – 504.
[11] Koletzko B, et al; World Association of Perinatal Medicins Dietary Guidelines Working Group (2008): The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations. J Perinat Med 36: 548 – 549.
[12] Jordan RG (2010): Prenatal omega-3 fatty acids: review and recommendations. J Midwifery Womens Health 55: 520 – 528.
[13] Frölich J, Döpfner M (2008): Die Behandlung von Aufmerksamkeitsdefizit-Hyperaktivitätsstörungen mit mehrfach ungesättigten Fettsäuren – eine wirksame Behandlungsoption? Z Kinder- Jugendpsychatr Psychother 36: 109 – 116.
[14] Ryan AS, et al (2010): Effects of long-chain polyunsaturated fatty acid supplementation on neurodevelopment in childhood: A review of human studies. Prostaglandins Leukot Essent Fatty Acids 82: 305 – 314.
[15] Deutsche Gesellschaft für Ernährung e.V. (2006): Evidenzbasierte Leitlinie Fettkonsum und Prävention ausgewählter ernährungsmitbedingter Krankheiten. www.dge.de/leitlinie.
[16] American Heart Association (2006): Diet and lifestyle recommendations Revision 2006. A statement from the American Heart Association Nutrition Committee. Circulation 114: 82 – 96.
[17] Iso H, et al (2006): Intake of fish and n-3 fatty acids and risk of coronary heart disease among Japanese: The Japan Public Health Center-Based (JPHC) Study Cohort I. Circulation 113: 195 – 202.
[18]. von Schacky C (2007): Omega-3-Fettsäuren in der Kardiologie. Neueste Entwicklungen. MMW Fortschr Med 149: 97 – 101.
[19] Marchioli R, et al (2007): Efficacy of n-3 polyunsaturated fatty acids according to clinical characteristics of patients with recent myocardial infarction: insights from the GISSI-Prevenzione trial. J Cardiovasc Med 8 (Suppl 1): 34 – 37.
[20] Richter V, Rassoul F, Hamm M (2008): Omega-3-Fettsäuren und kardiovaskuläres Risiko: Konsens trotz weiteren Forschungsbedarfs. Perfusion 21: 50 – 55.
[21] Massaro M, et al (2008): Basic mechanisms behind the effects of n-3 fatty acids on cardiovascular disease. Prostaglandins Leucot Essent Fatty Acids 79: 109 – 115.
[22] Lavie CJ, et al (2009): Omega-3 polyunsaturated fatty acids and cardiovascular diseases. J Am Coll Cardiol 54: 585 – 594.
[23] von Schacky C (2009): Cardiovascular disease prevention and treatment. Prostaglandins Leukot Essent Fatty Acids 81: 193 – 198.
[24] Musa-Velosa K, et al (2010): Long-chain omega-3 fatty acids eicosapentaenoic acid and docosahexaenoic acid dose-dependently reduce fasting serum triglycerides. Nutr Rev 68: 155 – 167.
[25] Di Minno MN, et al (2010): Exploring newer cardioprotective strategies: ω-3 fatty acids in perspective. Thromb Haemost 104: 664 – 680.
[26] Defilippis AP, Blaha MJ, Jacobson TA (2010): Omega-3 fatty acids for cardiovascular disease prevention. Curr Treat Options Cardiovasc Med 12: 365 – 380.[27] Das UN (2008): Folic acid and polyunsaturated fatty acids improve cognitive function and prevent depression, dementia, and Alzheimer’s disease – But how and why? Prostaglandins Leucot Essent Fatty Acids 78: 11 – 19.
[28] Orr SK, Bazinet RP (2008): The emerging role of docosahexaenoic acid in neuroinflammation. Curr Opin Investig Drugs 9: 735 – 743.
[29] Jicha GA, Markesbery W (2010): Omega-3 fatty acids: potential role in the management of early Alzheimer’s disease. Clin Intervent Aging 5: 45 – 61.
[30] Bahadori B, et al (2010): Omega-3 fatty acids infusions as adjuvant therapy in rheumatoid arthritis. J Parenter Enteral Nutr 34: 151 – 155.
[31] Tan JS, et al (2009): Dietary fatty acids and the 10-year incidence of age-related macular degeneration: the Blue Mountains Eye Study. Arch Ophthalmol 127: 656 – 665.
[32] Hamm M, Neuberger D (2011): Gesunde Augen – ein Leben lang. Mit Antioxidanzien, Omega-3 und Mikronährstoffen gegen Makuladegeneration, trockene Augen, grauen Star, Nachtblindheit. München: Mosaik bei Goldmann.
[33] Koch C, et al (2008): Docosahexaenoic acid (DHA) supplementation in atopic eczema: a randomized, double-blind, controlled trial. Br J Dermatol 158: 786 – 792.
[34] Rajendran N, Kumar D (2010): Role of diet in the management of inflammatory bowel disease. World J Gastroenterol 18: 1442 – 1448.
[35] Yurko-MauroK, et al, MIDAS investigators (2010): Beneficial effects of docosahexaenoic acid on cognition in age-related cognitive decline. Alzheimers Dement 6: 456 – 464.
[36] Farzaneh-Far R, et al (2010): Association of marine omega-3 fatty acid levels with telomeric aging in patients with coronary heart disease. JAMA 303: 250 – 257.
[37] Hibbeln JR, et al (2006): Healthy intakes of n-3 and n-6 fatty acids: estimations considering worldwide diversity. Am J Nutr 83: 1483 – 1493.
[38] Nambi V, Ballantyne CM (2006): Combination therapy with statins and omega-3 fatty acids. Am J Cardiol 98 [suppl]: 34i – 38i.
[39] Harris WS (2010): The omega-3 index: clinical utility for therapeutic intervention. Curr Cardiol Rep 12: 503 – 509.
[40] DGE-Ernährungsbericht 2004, Hrsg.: Deutsche Gesellschaft für Ernährung e.V. (DGE), Bonn.
[41] Richter V, Rassoul F, Hamm M (2007): Jugendliche oft mit Omega-3-Fettsäuren unterversorgt. Dtsch Apoth Ztg 147: 5269 – 5272.
[42] DGE-Ernährungsbericht 2008, Hrsg.: Deutsche Gesellschaft für Ernährung e.V. (DGE), Bonn.
[43] Arbeitskreis Omega-3 e.V. (2002): Bedeutung und empfehlenswerte Höhe der Zufuhr langkettiger Omega-3-Fettsäuren. Ernährungs-Umschau 49: 1 – 4.
[44] Arbeitskreis Omega-3; www.ak-omega-3.de.
[45] Singer P (2008): Geringer Gehalt von Omega-3-Fettsäuren bei Vegetariern und Veganern. Komplement integr Med 49: 16 – 23.
[46] Simopoulos AP (2007): Omega-3-fatty acids and athletics. Curr Sports Med Reports 6: 230 – 236.
[47] Brenna JT, et al; for the International Society for the Study of Fatty Acids and Lipids, ISSFAL (2009): ISSFAL Official Statement Nr 5: alpha-Linolenic acid supplementation and conversion to n-3 long chain polyunsaturated fatty acids in humans. Prostaglandins Leukot Essent Fatty Acids 80: 85 – 91.
[48] Hamm M, et al (2010): NEM in der fachlichen und öffentlichen Diskussion. Dtsch Apoth Ztg 150: 3906 – 3915.
Autoren
Prof. Dr. Volker Richter
Prof. Dr. Michael Hamm
Dipl. oec. troph. Iris Löhlein
Dr. Ing. David Bahri
Prof. Dr. Heinrich Kasper
Prof. Dr. Hans-Ulrich Klör
Dipl. oec. troph. Dirk Neuberger
Priv.-Doz. Dr. Peter Singer
Prof. Dr. Ursel Wahrburg
Arbeitskreis Omega-3 e. V., Postfach 70 08 42, 60558 Frankfurt/Main
Tel. (0 69) 96 36 52-36, Fax (0 69) 96 36 52-15
info@ak-omega-3.de, www.ak-omega-3.de
DAZ 2011, Nr. 25, S. 43





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.