
- DAZ.online
- DAZ / AZ
- DAZ 48/2010
- Verwirrung um die N-...
AMNOG
Verwirrung um die N-Kennzeichen
Was Prof. Schaefer und ihre Mitarbeiterinnen in ihrem Ergebnisbericht letztlich vorschlugen, war die Beibehaltung der bisher gewohnten Packungsgrößen N1, N2 und N3, für die jedoch keine festen Messzahlen mehr vorgegeben sein sollten. Vielmehr sollten die Messzahlen auf Basis der jeweiligen Tagesdosierung berechnet werden und auf die Reichdauer bzw. Behandlungsdauer ausgerichtet sein:
- für eine Kurzzeitbehandlung oder Akuttherapie eine Behandlungsdauer von zehn Tagen;
- für die mittlere Behandlungsdauer 30 Tage oder ein Monat;
- für die langfristige Behandlung 100 Tage oder ungefähr ein Quartal.
Entsprechend diesen Vorgaben sollten die Messzahlen zugeordnet werden (Abb. 1).
Nach Ansicht der Gutachterinnen hätte ein reichdauerorientiertes System zahlreiche Vorteile. Es sei z. B. grundsätzlich geeignet, Arzneimittelhersteller zur Durchführung gut geplanter Dosisfindungsstudien zu bewegen und nicht nur die Einzel- und Maximaldosis, sondern auch den therapeutisch optimalen Bereich für die Tagesdosis und die Dauertherapie zu belegen und zu begründen. Ärztinnen und Ärzte wiederum sähen sich veranlasst, die Packungsgröße und die damit verbundene Behandlungsdauer stärker in die Verordnungsentscheidung einzubeziehen.
Klare Empfehlung – große Verwirrung
Kaum jemand hätte wohl bei der Vorlage dieses Ergebnisberichts damit gerechnet, welch große Verwirrung die Vorschläge im Laufe des Jahres bei den Marktbeteiligten auslösen würden. Natürlich würde die Umstellung der Packungsgrößenverordnung auf ein reichdauerorientiertes System etliche Veränderungen des Arzneimittelmarktes mit seinen vielen Tausend Fertigarzneimitteln nach sich ziehen. Deshalb war die Empfehlung der Charité-Arbeitsgruppe zu begrüßen, die Neuregelung zur Bestimmung der Packungsgrößen nur für Neuzulassungen als Standardverfahren vorzugeben. Für bereits auf dem Markt befindliche Arzneimittel sollte stattdessen eine Kann-Bestimmung gelten. Ein Arzneimittelhersteller wäre somit frei in der Entscheidung gewesen, ob er bei seinen bisherigen Messzahlen bleiben oder sie nach den neuen Regeln anpassen möchte.
Umsetzung in drei Stufen
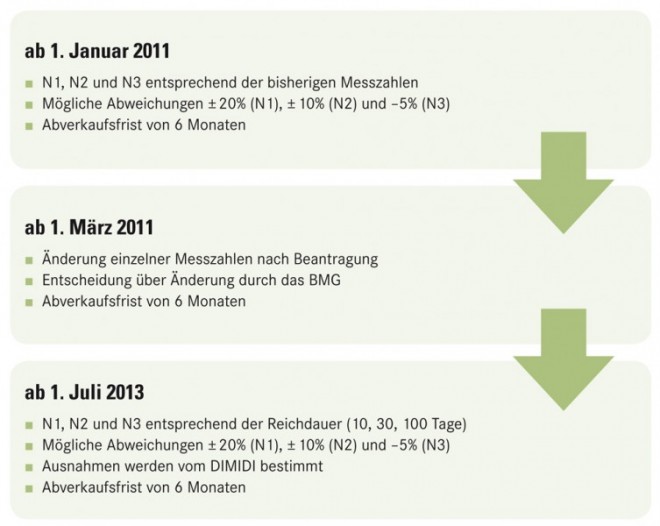
Es ist jedoch anders gekommen. Im Entwurf des Arzneimittelmarktneuordnungsgesetzes (AMNOG), den die Koalitionsfraktionen CDU/CSU und FDP im Juli vorgelegt hatten, war vorgesehen, dass die Umstellung der Packungsgrößenverordnung auf das reichdauerorientierte System für den gesamten Arzneimittelmarkt erfolgen soll, und zwar zum 1. Januar 2011. Diese Pläne riefen heftige Proteste der Marktbeteiligten hervor; insbesondere die Arzneimittelhersteller meldeten sich zu Wort. Schnell war klar geworden, dass ein immenser Umstellungsmarathon auf die Unternehmen zukommen würde, da ein Großteil der im Markt befindlichen Fertigarzneimittel nicht mehr den Vorgaben der neuen N-Kennzeichnung entsprechen würde. Und dies, obwohl die Regierung beabsichtigte, die neuen N-Kennzahlen mit einer Spannbreitenregelung zu versehen, die eine gewisse Über- bzw. Unterschreitung zugelassen hätte (Abb. 2).
Darüber hinaus wurde u. a. befürchtet, dass neue PZN-Kennzeichen nicht ausreichend zur Verfügung stehen würden und dass das zuständige Bundesinstitut für Arzneimittel und Medizinprodukte eine große Zahl an Anträgen auf Packungsänderung wohl kaum würde bewältigen können. Vor diesem Hintergrund ist die von vielen Marktbeteiligten erhobene Forderung zu sehen, eine solch weitreichende Veränderung des Arzneimittelmarktes nicht im Rahmen des parlamentarischen Verfahrens zum AMNOG und somit recht kurzfristig zu beschließen, sondern als eigenständiges Verordnungsverfahren vorzulegen, sobald die offensichtlichen Probleme diskutiert und möglichst gelöst sind.
Zu Letzterem hat sich die Regierung zwar nicht durchringen können. Wohl aber ist sie den Marktbeteiligten im Verlauf des parlamentarischen Verfahrens entgegengekommen, indem sie das Inkrafttreten der reichdauerorientierten Packungsgrößenverordnung auf den 1. Juli 2013 verschoben und somit mehr Zeit für die Umstellung zur Verfügung gestellt hat. Bis zu diesem Zeitpunkt sollten die bisherigen Messzahlen für die Normgrößen gelten, wie sie in den sechs Anlagen der bestehenden Packungsgrößenverordnung seit vielen Jahren festgelegt sind. Problematisch war nur, dass mit dem AMNOG ebenso vorgesehen war, die ständigen Diskussionen um die Austauschbarkeit verschiedener Packungsgrößen endgültig zu beenden, und zwar durch das Einführen einer Vorschrift, mit der im Hinblick auf die Aut-idem-Substitution Packungsgrößen mit demselben Packungsgrößenkennzeichen als identisch angesehen werden. Letztlich müsste die Frage, ob eine 100er- gegen eine 98er-Packung substituiert werden kann bzw. muss, dann nicht mehr beantwortet werden. Doch dieses Ziel hätte man nicht erreicht, wenn die bestehende Packungsgrößenverordnung gänzlich unverändert bis 2013 gelten würde, und so hat der Gesetzgeber bei der Verabschiedung des AMNOG im November nicht nur die Verschiebung der Reichdauerorientierung auf das Jahr 2013, sondern auch die Einführung der o. g. Spannbreiten bereits zum 1. Januar 2011 beschlossen, an dem das AMNOG in Kraft tritt.
Arzneimittelhersteller und weitere Marktbeteiligte stehen nun vor einem großen Problem, denn bislang waren die Messzahlen für N1, N2 und N3 als Obergrenzen zu verstehen, d. h. im Falle von N1 = 20 und N2 = 50 wurden alle Packungen zwischen 21 und 50 Einheiten schlicht mit der Kennzeichnung N2 versehen. Dies ändert sich im kommenden Jahr grundlegend, weshalb zahlreiche Fertigarzneimittel nicht in die Spannbreiten fallen und damit ihre N-Kennzeichnung verlieren werden. Dass dies nicht nur Einzelfälle sind, zeigt eine Betrachtung der Gruppe der Protonenpumpenhemmer. Bei Omeprazol liegen rund 65% aller PZN außerhalb der Spannbreiten, bei Pantoprazol sind dies sogar über 75%!
Änderung der Messzahlen möglich
Doch die Sache ist noch komplizierter. So sollen bis zur Umstellung auf das reichdauerorientierte System im Jahr 2013 jährliche Änderungsverfahren zur Packungsgrößenverordnung durchgeführt werden, wie sie bereits in den Vorjahren erfolgten und in denen die Arzneimittelhersteller Anträge zur Neuaufnahme bzw. Änderung von Messzahlen stellen können. Über diese entscheidet dann das Bundesministerium für Gesundheit. Das nächste dieser Verfahren soll am 1. März 2011 in Kraft treten, also bereits zwei Monate nach Aktivierung der Spannbreitenregelung, und es ist durchaus zu erwarten, dass vor dem Hintergrund der o. g. Probleme zahlreiche Anträge auf Änderung von Messzahlen beim Ministerium eingehen werden.
Darüber hinaus ist zu berücksichtigen, dass bei jeglicher Änderung einer Messzahl dem betroffenen Hersteller eine halbjährige Frist zum Abverkauf seiner Arzneimittel zusteht. Natürlich gilt dies sowohl im Hinblick auf die neue Spannbreitenregelung ab Jahresanfang als auch für mögliche Änderungen ab dem 1. März 2011. Somit werden nächstes Jahr zahlreiche Packungen mit einer N-Kennzeichnung im Markt sein, obwohl diese Arzneimittel nicht innerhalb der Spannbreiten liegen und eigentlich kein Kennzeichen mehr tragen dürften – was in der Apothekensoftware auch schon angezeigt wird!
Im Hinblick auf die Erstattung durch die Krankenkassen ist dies jedoch unerheblich, denn Arzneimittel ohne N-Kennzeichnung sind entgegen der landläufigen Meinung trotzdem zulasten der Gesetzlichen Krankenversicherung verordnungsfähig. Dies hat der Gesetzgeber in seiner Begründung zum AMNOG klargestellt, und der Parlamentarische Staatssekretär beim Bundesgesundheitsministerium, Daniel Bahr, hat es in einem kürzlich erfolgten Schreiben bestätigt. Wie sich die Neuregelungen zu den Packungsgrößen auf die zahlreichen Rabattvereinbarungen zwischen den Arzneimittelherstellern und den Krankenkassen auswirken, ist jedoch weit weniger klar und muss im Moment als offen bezeichnet werden.
Hoffnung auf Verwaltungsvorschrift
Trotz allem sind die Rahmenbedingungen für die Weiterentwicklung der Packungsgrößenverordnung durch das AMNOG vorgegeben und stellen sich dar, wie in Abbildung 3 zusammengefasst ist. Hoffnung muss dabei in eine Verwaltungsvorschrift des Deutschen Instituts für Medizinische Dokumentation und Information (DIMDI) gelegt werden, in der Näheres zur Bestimmung von Packungsgrößen festgehalten werden soll. Was sich dahinter verbirgt, sind aller Voraussicht nach zahlreiche Ausnahmeregelungen von der zukünftigen Reichdauerorientierung, wenn aufgrund der Fachinformation eine Abweichung als medizinisch notwendig erscheint. Und dies dürfte weitaus häufiger der Fall sein als gedacht. Jedenfalls hat der Gesetzgeber in seiner Begründung zum AMNOG vorsorglich festgehalten, dass die Vorschrift so auszugestalten ist, dass die Packungsgrößen im Bestandsmarkt weitestgehend unverändert bleiben. Nur wie dieser Bestandsmarkt im Jahr 2013 aussehen wird, nachdem ab Januar 2011 die Spannbreiten eingeführt wurden, ist ungewiss.
Autor
Dr. Frank Münchberg, Bundesverband der Arzneimittel-Hersteller e.V. (BAH),
Ubierstr. 71 – 73, 53173 Bonn, muenchberg@bah-bonn.de






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.