
- DAZ.online
- DAZ / AZ
- DAZ 47/2010
- Austausch von starken ...
Therapeutische Qualität
Austausch von starken Opioiden?
Biopharmazeutische Qualitätsunterschiede
Für den Therapieerfolg spielt auch die biopharmazeutische Qualität der eingesetzten Retardpräparate eine wichtige Rolle, da von ihr die Arzneistoffkonzentrationen im Blut entscheidend abhängen. Je unabhängiger die Wirkstofffreisetzung von den Einnahmebedingungen ist (z. B. vor oder nach dem Essen, mit oder ohne Alkohol), desto geringer ist die Gefahr therapeutisch ungeeigneter Wirkstoffspiegel. In dieser Hinsicht können sich die verschiedenen Handelspräparate beachtlich unterscheiden, was der Arzt bei der Verordnung berücksichtigen muss. Vor allem sind diese Unterschiede beim Wechsel eines Retardpräparates zu beachten.
Präparatewechsel – ein Therapierisiko
Patienten mit chronischen Schmerzzuständen werden in der initialen Phase der Therapie, in der die individuell optimalen Dosierungen und Applikationsschemata getestet werden, bisweilen ganz gezielt auf ein anderes Präparat umgestellt. Denn einzelne Präparate können sich für einen bestimmten Patienten als weniger oder besser geeignet herausstellen. Wenn auf diese Weise eine optimale Einstellung des Patienten erreicht worden ist, sollten weitere Präparatewechsel unterbleiben. Die Erfahrungen haben nämlich gezeigt, dass mit ihnen das Risiko verbunden ist, dass der Patient mit dem neuen Präparat auch neu eingestellt werden muss; diese Problematik betrifft auch die Opioid-Analgetika [1 – 5].
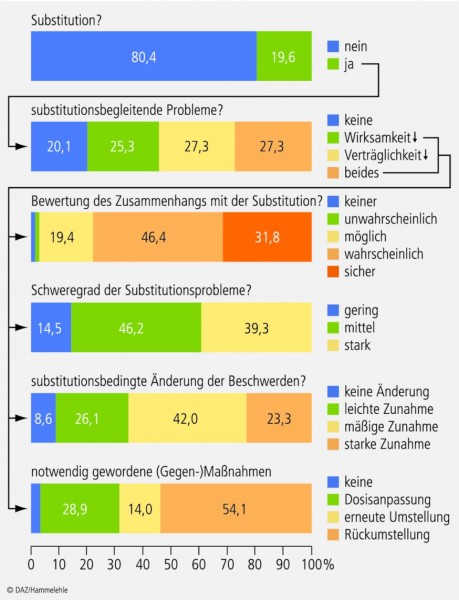
Die Therapieprobleme, die mit einem medizinisch nicht indizierten, nur durch die Aut-idem-Regelung [6] und die Rabattverträge [7] begründeten Präparatewechsel verbunden sein können, wurden in einer Studie zur Substitution von Opioid-Analgetika transparent gemacht: In 80% der Fälle traten Probleme auf, die zu 78% "sicher" oder "wahrscheinlich" mit der Substitution in Zusammenhang standen. 85% der Probleme waren mittelschwer oder stark. 54% der Patienten erhielten daraufhin wieder ihr altes Präparat ("Rückumstellung"; Abb. 1).
Die Autoren schlussfolgerten, dass für die Betroffenen nicht nur die Verschlechterungen des Beschwerdebildes problematisch sind, sondern "insbesondere auch die reaktiv notwendigen Folgemaßnahmen, wie z. B. erneute Dosisanpassungen, weitere Ein-/Umstellungen auf alternative Opioid-Analgetika oder die Rückumstellung auf das Ursprungspräparat" [5].
Diese Erkenntnisse stehen im Einklang mit der bereits früher erarbeiteten Leitlinie "Gute Substitutionspraxis (GSP)", die die Opioid-Anlagetika zu den Arzneimittelgruppen zählt, bei denen eine Substitution kritisch sein kann (siehe Kasten) [8]. Opioid-Anlagetika sind für Krankheiten indiziert, bei denen eine konstante Therapie besonders wichtig erscheint, sodass empfohlen wird, auf einen Präparatewechsel gänzlich zu verzichten oder einen solchen nur unter sorgsamer Beachtung restriktiver Grundsätze zur Arzneimittelqualität vorzunehmen. Weiterhin wird die Substitution von Darreichungsformen als kritisch angesehen, deren biopharmazeutische Produkteigenschaften die Resorption des Wirkstoffs wesentlich bestimmen. Dazu gehören insbesondere die Retardarzneimittel.
Die Behandlung chronischer Schmerzzustände mit Opioid-Retardpräparaten gehört demnach sicherlich zu jenen Fällen, für welche die GSP-Leitlinie besondere Sorgfalt bei jeder Therapieumstellung anmahnt. Die Unterschiede zwischen den Präparaten müssen dabei konsequent berücksichtigt werden, um den Patienten wieder gut einzustellen; ein Präparatewechsel unter der Prämisse "einfach weiter therapieren" wäre dagegen nicht angemessen.
Cave: Aut idemArzneimittelgruppen, bei denen eine Substitution kritisch sein kann [8]
Darreichungsformen, bei denen eine Substitution kritisch sein kann [8]
|
Opioid-Retardpräparate – ein Rückblick
In Deutschland waren die Voraussetzungen für die medikamentöse Therapie von Patienten mit starken Schmerzen nicht nur deshalb jahrzehntelang eher suboptimal, weil die Ärzte eine gewisse Zurückhaltung beim Einsatz von Opioiden übten, sondern auch weil geeignete galenische Zubereitungen nicht zur Verfügung standen. Erst als es in den 1980er Jahren gelang, besser retardierte orale Morphinpräparate [9] zu entwickeln, änderte sich die Situation signifikant. Nun konnten die Patienten deutlich besser therapiert werden, allerdings mussten sie die Präparate nach wie vor mehrmals täglich nach einem festen Dosierungsschema ("nach der Uhr") einnehmen.
Es dauerte nahezu eine weitere Dekade, bis erstmals ein noch stärker retardiertes Morphinpräparat ausgeboten wurde, bei dem eine einmal tägliche Einnahme ausreicht, um selbst starke chronische Schmerzen sicher zu therapieren. Nicht unerwartet weckte diese Neuentwicklung Begehrlichkeiten, und in der Folge wurde eine Reihe weiterer Produkte in die Therapie eingeführt. Bei diesen handelte es sich nicht nur um generische Formen mit dem lange Zeit als "Goldstandard" geltenden Wirkstoff Morphin, sondern es wurden auch retardierte Zubereitungen mit anderen Opioiden entwickelt, z. B. mit Oxycodon oder Hydromorphon. Hinzu kamen schließlich auch Kombinationsprodukte mit dem Opiatantagonisten Naloxon, mit denen die typischen, für die Patienten sehr unangenehmen Obstipationen verhindert oder erheblich reduziert werden können.
Bei der Entwicklung galenischer Alternativen werden unterschiedlichste Prinzipien verwendet [9]. Neben Matrixtabletten, bei denen die Wirkstoffabgabe über Erosion und/oder Diffusion gesteuert wird, kamen Kapseln mit Pellets oder osmotisch kontrollierte Arzneiformen (z. B. OROS oder GITS) in den Handel. Alle diese Produkte unterscheiden sich z. T. beachtlich in ihren biopharmazeutischen Eigenschaften. Daraus resultieren abweichende Freisetzungscharakteristiken, die zudem von den Einnahmebedingungen mehr oder weniger stark beeinflusst werden, sowie Differenzen im Magen-Darm-Transit.
Probleme bei Einnahme mit oder nach dem Essen
Der Zeitpunkt der Einnahme eines Arzneimittels – vor, während oder nach einer Mahlzeit – wirkt sich auf die Passage durch den Magen-Darm-Trakt aus:
- Nüchterneinnahme: Bei der Einnahme vor einer Mahlzeit werden nicht zerfallende monolithische Arzneiformen innerhalb von 30 Minuten (bis maximal 2 Stunden) aus dem Magen entleert, um anschließend den Dünndarm innerhalb von drei bis fünf Stunden zu passieren und danach für längere Zeit im Kolon zu verbleiben.
- Einnahme mit dem Essen: Bei der Einnahme während (oder kurz nach) einer Mahlzeit ist die Verweildauer im Magen erheblich verlängert und kann (nachts) mehr als zehn Stunden betragen. Der Dünndarmtransit und die Verweildauer im Kolon unterscheiden sich dagegen nicht gravierend von der Nüchterneinnahme.
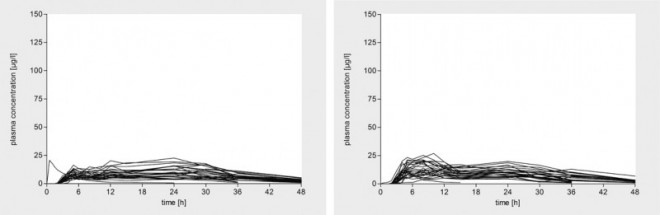
Diese Abweichungen sind für die Arzneimittelwirkung von erheblicher Relevanz, da die Wirkstoffe nur aus dem Dünndarm resorbiert werden. Bei einer langen Verweildauer im Magen wird der Wirkstoff zwar aus der Darreichungsform freigesetzt, aber nicht resorbiert. Erst nach der Magenentleerung wird der bereits gelöste Arzneistoff im Dünndarm sehr rasch – und nicht mehr kontrolliert durch die retardierte Freisetzung aus der Darreichungsform – resorbiert, woraus z. T. sehr hohe Konzentrationsspitzen im Plasma resultieren, die beachtliche Nebenwirkungen induzieren können. Solche Probleme sind bei anderen kritischen Arzneistoffen, z. B. Antihypertensiva, systematisch untersucht worden [10 – 13]. Die Abbildungen 2 und 3 verdeutlichen die unterschiedlichen Plasmaspiegelverläufe anhand von zwei Nifedipin-Retardpräparaten, einer OROS-Tablette (osmotisches Freisetzungssystem) und einer konventionellen Matrixtablette. Die im Fall der Matrixtablette beobachteten sehr hohen Konzentrationsspitzen können zu einer Reflextachykardie führen, die die erwünschte Blutdrucksenkung verhindert.
Die verschiedenen galenischen Formen werden in ihrer Magen-Darm-Passage mehr oder weniger stark durch gleichzeitig eingenommene Mahlzeiten beeinträchtigt. So kann nach Einnahme von polydispersen Formen (z. B. Kapseln mit Pellets) erwartet werden, dass die einzelnen Pellets etwas rascher aus dem Magen entleert und gleichmäßiger durch den Darm transportiert werden als nicht zerfallende, monolithische Präparationen.
Erschwerend kommt bei Opioiden hinzu, dass sie die Motilität des Gastrointestinaltraktes – und dadurch auch die Magenentleerung – deutlich einschränken. Somit ist zu erwarten, dass die unterschiedlichen biopharmazeutischen Eigenschaften von wirkstoffgleichen Opioid-Retardzubereitungen bei einem Präparatewechsel noch stärker zum Tragen kommen.
Interaktionen mit Alkohol
In den letzten Jahren wurden die Fachkreise durch Meldungen über gefährliche Interaktionen [14] zwischen Hydromorphon-Retardpräparaten und hochprozentigen alkoholischen Getränken aufgeschreckt. In den USA nahm ein Unternehmen in Absprache mit der Zulassungsbehörde FDA ein solches Präparat vom Markt, weil es den Wirkstoff unkontrolliert und rasch freisetzte, wenn es zusammen mit Spirituosen eingenommen wurde [15]. Bis zu 16-fach erhöhte Plasmakonzentrationsspitzen wurden bei einzelnen Personen festgestellt.
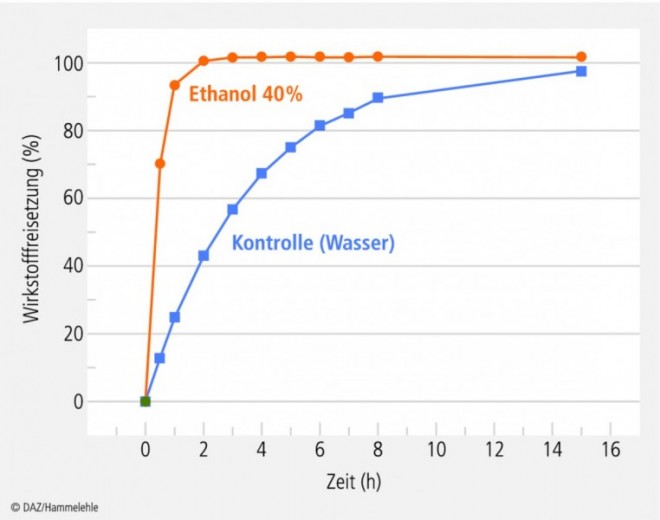
Ein In-vitro-Versuch sollte das unerwartete Verhalten des Präparates aufklären: Dabei zeigte sich, dass das Präparat den Wirkstoff in 40%igem Alkohol viel schneller freisetzt als in Wasser (Abb. 4). Die FDA schloss daraus, dass das Problem eine direkte Interaktion von Alkohol mit dem die Freisetzung kontrollierenden galenischen System ist.
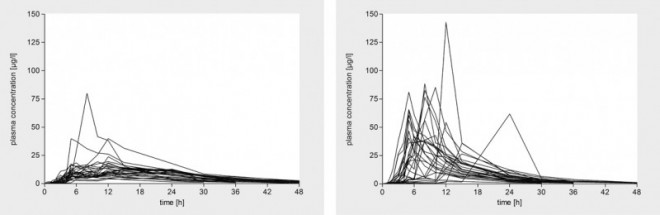
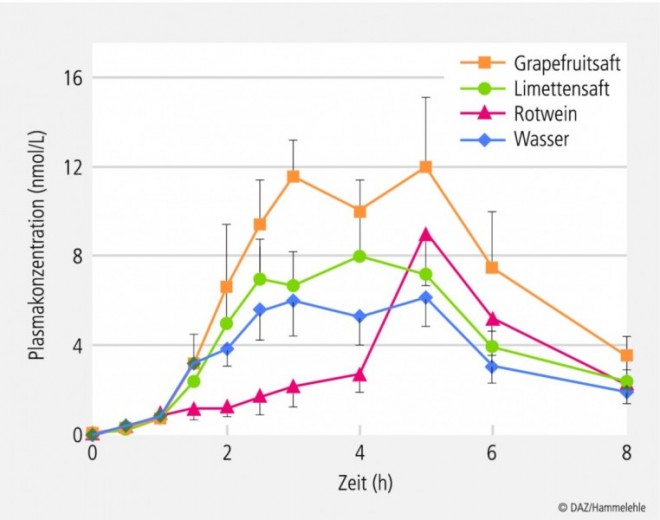
Allerdings wurde auch ein anderer Erklärungsansatz für die unkontrollierte Freisetzung in die Debatte eingebracht [16]: Alkoholische Getränke verlängern die Verweildauer des Präparates im Magen, sodass die Wirkstoff-Plasmaspiegel erst sehr langsam und danach plötzlich sehr schnell ansteigen, wie dies bereits oben bei der Einnahme von Retardpräparaten während einer Mahlzeit beschrieben wurde. Eine In-vivo-Studie mit Felodipin-Retardtabletten zeigte solche Plasmaspiegelverläufe, wenn sie zusammen mit einem Glas Wein eingenommen wurden (Abb. 5) [17].
Inzwischen wurden zahlreiche Handelspräparate bezüglich ihrer Empfindlichkeit gegenüber Alkohol untersucht. Die bisher bekannt gewordenen Befunde zeigen, dass die Interaktion nicht bei allen Produkten als problematisch zu beurteilen ist. Es muss also von Fall zu Fall eine begründete Entscheidung vorgenommen werden.
Auch die europäische Arzneimittelbehörde (European Medicines Agency, EMA) hat diverse Morphin-, Hydromorphon- oder Oxycodon-haltige Retardpräparate auf ihre Empfindlichkeit gegenüber Alkohol untersucht [18 – 20]. Als Konsequenz empfahl die EMA Ende Juli 2010 die Marktrücknahme von Morphin-Retardpräparaten mit einem besonders problematischen Überzug auf Polymethylacrylat-triethylcitrat-Basis [20, 33]. Dieser kann sich in 20%igen alkoholischen Lösungen auflösen, wodurch es zu einer sehr raschen Wirkstofffreisetzung kommt. (In Deutschland war damals kein entsprechendes Präparat mehr im Handel).
Schlussfolgerung: Austausch vermeiden
Die medikamentöse Behandlung schwerer chronischer Schmerzzustände gehört zu den besonderen therapeutischen Herausforderungen. Für die adäquate Schmerzkontrolle sind möglichst gleichmäßige Plasmakonzentration-Zeit-Profile erforderlich [21, 22]. Dieses Ziel kann nur mit optimal retardierten Opioid-Präparaten realisiert werden, wenn diese vom Patienten zuverlässig zu vorbestimmten Zeitpunkten angewendet werden. Dabei spielt auch die Art der Einnahme eine wichtige Rolle. Da sich die am Markt angebotenen Arzneimittel in ihren biopharmazeutischen Eigenschaften erheblich unterscheiden, ist ein Austausch von Produkten ohne Berücksichtigung ihrer speziellen Charakteristika sehr problematisch und unbedingt zu vermeiden.
Einnahmebedingungen
Die Einnahme von Retardpräparaten auf nüchternen Magen oder nach einer Mahlzeit kann zu sehr unterschiedlichen Wirksamkeiten führen. Auch ein vermehrtes Auftreten unerwünschter Effekte ist möglich und sogar wahrscheinlich, wenn es zu einer unkontrollierten Freisetzung größerer Arzneimittelmengen (Dose dumping) kommt. Deshalb sollen Patienten mit Dauermedikation instruiert werden, die Arzneimittel mit einem bestimmten Abstand vor der Mahlzeit einzunehmen.
Darüber hinaus sollte auch die Einnahme mit alkoholischen Getränken vermieden werden, um folgende Risiken zu vermeiden
- Interaktion mit der Galenik,
- verzögerte Magenentleerung durch die damit verbundene Kalorienaufnahme,
- pharmakodynamische Wechselwirkungen.
Probleme durch die Aut-idem-Regelung
Durch das Arzneimittelausgaben-Begrenzungsgesetz (AABG) wurde die Aut-idem-Regelung für die generische Substitution in Deutschland grundsätzlich verändert: Der Präparate-Austausch wurde zum Regelfall. Die hierfür relevanten Konditionen wurden in einem Rahmenvertrag nach § 129 Absatz 2 SGB V konkretisiert [23].
Diese Situation wurde noch problematischer durch die Einführung von Rabattverträgen, die die Apotheken verpflichten, bestimmte, für die jeweilige Krankenversicherung rabattbegünstigte Arzneimittel abzugeben und gegebenenfalls die Patienten auf ein anderes Präparat umzustellen. Die Spielräume für die Berücksichtigung von Qualitätsaspekten bei der Auswahl sind gering und müssen durch "pharmazeutische Bedenken" begründet werden.
Infolge des Präparate-Austausches bei bestimmten Indikationsgruppen traten viele Fälle nicht unerheblicher Probleme auf, die zum Teil schon vorher bekannt waren, z. B. bei Antihypertonika [24], Antiepileptika [25, 26], Schilddrüsenhormonpräparaten [27], Opioid-Analgetika [4, 5] und Kontrazeptiva [28].
Um solche Probleme im Interesse einer optimalen Therapie der Patienten zu vermeiden, haben verschiedene Fachgesellschaften Resolutionen verfasst, in denen sie eine Rücknahme der Verpflichtung zur generischen Substitution bei bestimmten Indikationen verlangen, z. B. bei Opioiden [29], Antiepileptika [30] oder Schilddrüsenhormonpräparaten [31] sowie auch bei wirkstoffidentischen topischen Dermatika [32].
Ausweg "Pharmazeutische Bedenken"?
Der Rahmenvertrag zwischen dem Spitzenverband Bund der Krankenkassen und dem Deutschen Apothekerverband eröffnet die Möglichkeit, unter Verweis auf relevante pharmazeutische Bedenken im Einzelfall von der Verpflichtung zur Abgabe eines rabattbegünstigten Arzneimittels abzuweichen. Nähere Ausführungen zur Umsetzung dieser Regelung werden nicht gemacht. Daher überrascht es nicht, dass in dieser Frage eine breite Verunsicherung in den Fachkreisen herrscht.
Die in diesem Beitrag aufgezeigten Probleme bei der generischen Substitution von opioidhaltigen Retardpräparaten sind so schwer, dass die Substitution generell unterbleiben sollte. Es sind weniger pharmazeutische als vielmehr therapeutische Bedenken, die gegen einen Präparatewechsel sprechen. Dies lässt die Verpflichtung, in jedem dieser Fälle pharmazeutische Bedenken vorbringen zu müssen, um einen Präparatewechsel zu vermeiden, nicht adäquat erscheinen. Eine generelle Herausnahme dieser Indikationsbereiche aus der Substitutionspflicht wäre eine sehr viel bessere Lösung.
Fazit
Die Therapie chronischer Schmerzzustände mit Opioid-Retardpräparaten gehört zu den besonderen Herausforderungen der Pharmakotherapie. Daher überrascht es nicht, dass sich klinisch relevante Probleme bei den Schmerzpatienten häufen, seitdem die generische Substitution aufgrund der Rabattverträge forciert wird. Solche Schwierigkeiten bei der Therapieumstellung treten insbesondere dann auf, wenn sich die ausgetauschten Arzneimittel in ihren biopharmazeutischen Eigenschaften unterscheiden. Dies gilt auch für Retardarzneimittel mit unterschiedlichen galenischen Prinzipien wie Matrixtabletten, Kapseln mit Pellets oder osmotische Freigabesysteme.
Vor diesem Hintergrund ist bei jedem Präparatewechsel prinzipiell eine sorgfältige Neueinstellung der Patienten vorzunehmen, um therapeutische Probleme möglichst auszuschließen. Eine unkritische Aut-idem-Substitution, wie sie die gesetzlichen Rahmenbedingungen nahelegen, ist dagegen zu vermeiden.
Literatur [1] Schweim HG, Wasem J. Zur Austauschbarkeit von stark wirksamen Analgetika im Rahmen der Aut-Idem-Regelung. Pharm Ztg 2008;153:2158 – 2162. [2] Berger A, et al. Therapy switching in patients receiving long-acting opioids. Ann Pharmacother 2004;38:389 – 395. [3] Dickman A, Gibbs M. The problem with generic scrips for m/r strong opioids. Prescriber 2007;18:389 – 395. [4] Müller-Schwefe G. Austauschpflicht belastet Schmerzpatienten. Dtsch Apoth Ztg 2009;149:3878 – 3879. [5] Überall M, Müller-Schwefe G. Häufigkeit und Verlauf medizinisch nicht indizierter Umstellungen einer Therapie mit stark wirksamen Opioid-Analgetika aus ärztlicher Sicht – mehr Folgen als vermutet mit zahlreichen Konsequenzen für Patient und Arzt. MMW Fortschr Med 2009;151(Suppl 1):18 – 23. [6] Gesetz zur Begrenzung der Arzneimittelausgaben der gesetzlichen Krankenversicherung (Arzneimittelausgaben-Begrenzungsgesetz, AABG). 2002. [7] Gesetz zur Stärkung des Wettbewerbs in der gesetzlichen Krankenversicherung (GKV-Wettbewerbsstärkungsgesetz, GKV-WSG). 2007. [8] Deutsche Pharmazeutische Gesellschaft: Leitlinie Gute Substitutionspraxis (GSP). Dtsch Apoth Ztg 2002;142: 129 – 138. [9] Bartholomäus J. Moderne Darreichungsformen für Opioide: Situationsgerechte Verabreichung von Analgetika. Pharm Unserer Zeit 2002;31:74 – 81. [10] Schug BS, et al. The effect of food on the pharmacokinetics of nifedipine in two slow release formulations: pronounced lag-time after a high fat breakfast. Br J Clin Pharmacol 2002;53:582 – 588. [11] Schug BS, et al. Dosage form-related food interaction observed in a marketed once-daily nifedipine formulation after a high-fat American breakfast. Eur J Clin Pharmacol 2002;58:119 – 125. [12] Schug BS, et al. Formulation-dependent food effects demonstrated for nifedipine modified-release preparations marketed in the European Union. Eur J Pharm Sci 2002; 15:279 – 285. [13] Wonnemann M, et al. Significant food interactions observed with a nifedipine modified-release formulation marketed in the European Union. Int J Clin Pharmacol Ther 2006;44:38 – 48. [14] Alcohol-Palladone Interaction. FDA Alert, 2005. [15] Meyer RS, Hussain AS. Mitigating the risks of ethanol induced dose dumping from oral sustained/controlled release dosage forms. Office of New Drugs and Office of Pharmaceutical Science, Center for Drug Evaluation and Research, FDA, 2005. [16] Adam U, Aurich K, Weitschies W, Blume H. Retardierte Opioide: Dose Dumping durch Alkohol? Dtsch Apoth Ztg 2008;148:1824 – 1832. [17] Bailey DG, Dresser GK, Bend JR. Bergamottin, lime juice, and red wine as inhibitors of cytochrome P450 3A4 activity: comparison with grapefruit juice. Clin Pharmacol Ther 2003;73:529 – 537. [18] Questions and answers on Ethirfin and associated names (morphine sulfate, prolonged release capsules, 20, 60, 120 and 200 mg). EMA, London 2010. [19] Questions and answers on the review of modified release oral opioid medicines of the WHO level III scale for the management of pain. EMA, London 2010. [20] European Medicines Agency concludes review of modified-release opioids of the WHO level III scale for the management of pain. EMA, London 2010. [21] (du). 12. SocraTec Expertengespräch, Visionen für eine optimierte Opioidtherapie. Dtsch Apoth Ztg 2007;147: 5343 – 5344. [22] Sabatowski R, Grond S, Blume H. Anforderungen an eine optimierte Opioidtherapie chronischer Schmerzen: Gleichmäßige Plasmaspiegel versus chronoadjustierte Analgesie. MMW Fortschr Med 2010;152:12 – 15. [23] Fünftes Buch Sozialgesetzbuch – Gesetzliche Krankenversicherung. 2008. [24] Meredith PA, Elliott HL. Dihydropyridine calcium channel blockers: basic pharmacological similarities but fundamental therapeutic differences. J Hypertens 2004;22: 1641 – 1648. [25] McAuley JW, et al. An assessment of patient and pharmacist knowledge of and attitudes toward reporting adverse drug events due to formulation switching in patients with epilepsy. Epilepsy Behav 2009;14:113 – 117. [26] Steinhoff BJ, et al. Substitution of anticonvulsant drugs. Ther Clin Risk Manag 2009;5:449 – 457. [27] Hennessey JV, et al. Adverse Event Reporting in Patients Treated with Levothyroxine: Results of the Pharmacovigilance Task Force Survey of the American Thyroid Association, American Association of Clinical Endocrinologists and The Endocrine Society. Endocr Pract 2010;16:1 – 41. [28] ACOG Committee Opinion No. 375: Brand versus generic oral contraceptives. Obstet Gynecol 2007;110:447 – 448. [29] Deutsche Gesellschaft für Schmerztherapie: Expertenkonsensus zur qualitätsgesicherten Opioidversorgung von GKV-versicherten Schmerzpatienten. www.schmerz-therapie-deutschland.de (2008). [30] Deutsche Gesellschaft für Epileptologie: Empfehlung Generika. www.dgfe.info (2008). [31] American Thyroid Association. Joint statement on the U.S. Food and Drug Administration‘s Decision Regarding Bioequivalence of Levothyroxine Sodium. Thyroid 2004:14;486. [32] Gesellschaft für Dermopharmazie: Resolution zur Nicht-Substituierbarkeit von wirkstoffidentischen topischen Dermatika. www.gd-online.de (2010). [33] (du). Retardierte Opioide und das Alkohol-Interaktionsrisiko. Dtsch Apoth Ztg 2010;150:3604 – 3605.
Korrespondenzautor
Prof. Dr. Henning Blume, Socratec R&D
Im Setzling, 61440 Oberursel
info@socratec-pharma.de


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.