
- DAZ.online
- DAZ / AZ
- DAZ 3/2010
- Untersuchungen zur ...
Analytik
Untersuchungen zur Arzneistofffreisetzung
Die Freisetzung von Arzneistoffen aus Arzneiformen ist ein Qualitätsattribut von Arzneimitteln, da sie oft in direktem Zusammenhang zu ihrer therapeutischen Wirksamkeit steht. Freisetzungsuntersuchungen werden als analytische Methode in der Arzneimittelentwicklung benutzt, um schon in einer frühen Phase eine Aussage über die spätere Bioverfügbarkeit des jeweiligen Arzneistoffs machen zu können; sie dienen somit als Surrogatparameter für die spätere therapeutische Wirksamkeit. Außerdem dienen Freisetzungsuntersuchungen als Kontrollwerkzeug in der Qualitätskontrolle.
Das Freisetzungsverhalten eines Arzneistoffs wird von den chemischen und physikalischen Eigenschaften des Arzneistoffs, der Hilfsstoffe und des Freisetzungsmediums bestimmt. Dazu zählen z. B. die Löslichkeit und die Partikelgröße des Arzneistoffs sowie seine Verteilung in der Arzneiform. Diese Eigenschaften können sich während der Freisetzung ändern und folglich auch die Freisetzungsrate beeinflussen.
Die Rahmenbedingungen für pharmazeutische Freisetzungsuntersuchungen und die Standardmethoden, die für verschiedene Arzneiformen geeignet und etabliert sind, sind in den Arzneibüchern beschrieben. Feste orale Arzneiformen, die normalerweise aus Hilfs- und Arzneistoffen bestehen, werden in ein Freisetzungsmedium definierten Volumens überführt, in welchem die Konzentration des freigesetzten Arzneistoffs in bestimmten Zeitintervallen gemessen wird. Methoden, die dafür eingesetzt werden können, sind z. B. die UV-Spektroskopie oder die HPLC. Die auf solche Weise ermittelten Freisetzungsprofile geben Aufschluss über Verlauf und Variationen in der Freisetzung. Sie können in der Formulierungsentwicklung oder in Bioäquivalenzstudien bei der Entwicklung von Generika sowie zur Qualitätssicherung eingesetzt werden.
Dass mit diesen Methoden nur die Konzentration des freigesetzten Arzneistoffs im Freisetzungsmedium bestimmt wird, ist insofern problematisch, als die Festkörpereigenschaften von Arznei- und Hilfsstoffen in Arzneiformen einen großen und nicht immer vorhersehbaren Einfluss auf die Freisetzung des Arzneistoffs haben können. Durch Interaktionen mit dem Freisetzungsmedium kann es z. B. zu Transformationen des Arzneistoffs kommen wie Hydratbildung, Kristallisation oder Umwandlungen in andere polymorphe Formen. Die neue Form des Arzneistoffs kann z. B. eine erhöhte Stabilität oder verringerte Löslichkeit und damit eine veränderte Freisetzungsrate aufweisen. Da die Freisetzungsrate zusammen mit der Löslichkeit des Arzneistoffs die Bioverfügbarkeit im Körper beeinflusst, besteht ein großes wissenschaftliches Interesse, die Festkörpereigenschaften während der Freisetzung zu überwachen.
Da die geschilderten Freisetzungsuntersuchungen keine direkte Information über das Festkörperverhalten liefern, wird das Freisetzungsverhalten des Arzneistoffs in vielen Fällen nicht komplett verstanden. Sobald es zu Abweichungen vom Freisetzungsprofil kommt, ist es schwierig, den Grund für die Veränderung zu finden. Zudem steht die Probe nicht mehr für eine weitergehende Analyse zur Verfügung, da sie nach der Freisetzung nicht mehr im Originalzustand vorliegt. Daher ist es notwendig, die Festkörpereigenschaften während der Freisetzung in Echtzeit zu bestimmen und insbesondere zu visualisieren.
Methodische Ansätze
Es gab in den letzten Jahren verschiedene Ansätze, neben der Konzentration des Arzneistoffs im Freisetzungsmedium andere Kenngrößen über die Zeit zu detektieren.
Ex situ wurden verschiedene analytische Methoden erfolgreich eingesetzt, um die Festkörpereigenschaften der Arzneiformbestandteile zu erfassen. Mittels Röntgen-Diffraktometrie wurde die Kristallstruktur der Arzneiform nach der Freisetzung untersucht [1]; auch Tiefenprofile der Arzneiform konnten mit dieser Methode erstellt werden [2]. Veränderungen der Oberflächenmorphologie wurden nach der Freisetzung mittels Elektronenmikroskopie analysiert [3].
Voraussetzung für die angestrebte In-situ-Analyse ist ein Versuchsaufbau, der die Freisetzung nicht durch zusätzliche Einflüsse beeinträchtigt. Außerdem müssen Interaktionen des Versuchsaufbaus mit der Probe oder dem Freisetzungsmedium ausgeschlossen werden. Die Probe darf durch die Messung nicht zerstört werden. Die Datenaufnahme muss eine lange zeitliche und hohe räumliche Auflösung gewährleisten.
Da die Freisetzung von Arzneistoffen zum großen Teil von der Geometrie der Arzneiform abhängt, ist es wichtig, die analysierten Arzneiformen räumlich darzustellen (Imaging) [4]. Neben der Röntgen-Diffraktometrie eignen sich Nah-Infrarot-Spektroskopie (NIR), Infrarot-Spektroskopie (IR), Terahertz-Spektroskopie [5] und Raman-Spektroskopie [6] für das Imaging von physikalischen oder chemischen Veränderungen nach der Freisetzung ex situ, sie weisen aber ernstzunehmende Mängel im Hinblick auf die In-situ-Analyse auf.
Bei der Messung mittels NIR- [7], IR- [8, 9] und Terahertz-Spektroskopie wird die jeweilige Strahlung stark von Wasser absorbiert, was die Anwendung dieser Methoden in wässriger Umgebung einschränkt.
Dagegen eignet sich die Raman-Spektroskopie [10, 11] für eine In-situ-Analyse von festen Arzneiformen während der Freisetzung, da ihre Empfindlichkeit gegen Wasser im Vergleich zu den anderen Methoden gering ist. Vorteilhaft ist außerdem die hohe Auflösung (bis 1 μm). Potenzielle Nachteile liegen in der langen Aufnahmezeit der Daten (Minuten bis Stunden) und in der möglichen Interferenz durch Fluoreszenz.
Vor Kurzem wurden mit der Raman-Spektroskopie Festkörpertransformationen während der Freisetzung in situ detektiert [3, 12]. Dabei wurden zwar die Spektren verschiedener polymorpher Formen auf der Oberfläche erfasst, jedoch blieb die Messung auf das Sensorfeld beschränkt, welches nur einen kleinen Teil der Arzneiform darstellt. Zusätzlich wurde die Probe durch die Messung thermisch belastet, was zu Verfälschungen des Ergebnisses führen kann.
Die Kernspinresonanztomographie bietet zwar einen interessanten Ansatz, aber als problematisch erweist sich die räumliche und zeitliche Auflösung.
Mit den vorgestellten Methoden ist es zum derzeitigen Zeitpunkt noch nicht gelungen, die Festkörpereigenschaften von festen Arzneiformen während der Freisetzung in situ zu visualisieren. Hierzu bedarf es einer anderen Methode.
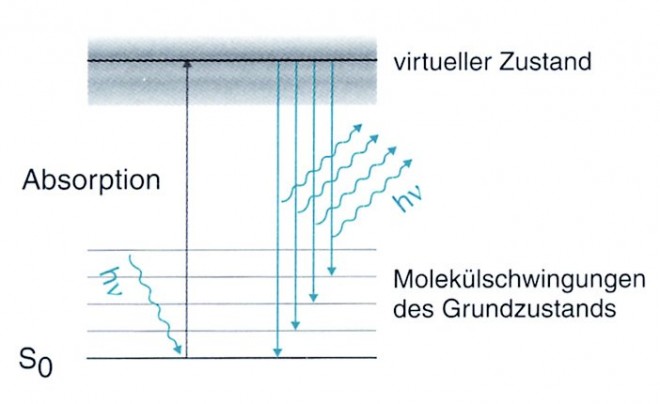
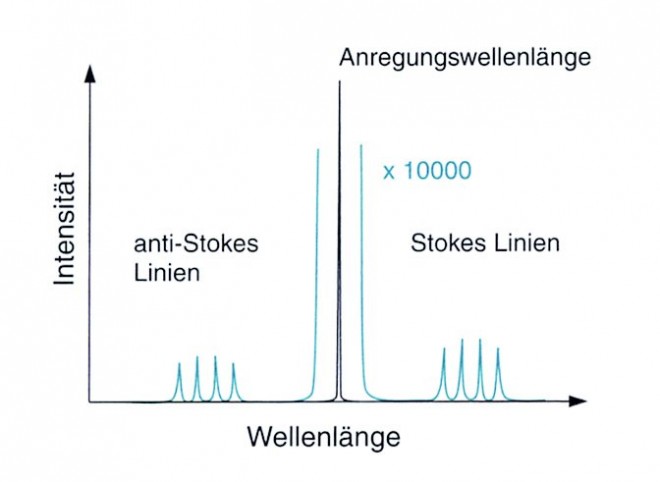
Raman-StreuungRaman-Streuung bezeichnet die spezifische Änderung der Wellenlänge eines Lichtstrahls durch ein Molekül. Sie beruht auf einem 2-Photonen-Prozess: Ein Quant des einfallenden Lichtstrahls wird vom Molekül absorbiert, worauf das Molekül ein zweites Quant (mit anderer Energie) emittiert (Grafik 1). Bezüglich der Wellenlänge des emittierten Lichtes gibt es zwei Möglichkeiten (Grafik 2): Stokes-Streuung: Die Molekülkerne der Probe befinden sich im energetischen Grundzustand, sie absorbieren Energie durch die Bestrahlung und gehen in den angeregten Zustand über. Beim Zurückfallen in einen energetisch tieferen Zustand (nicht in den Grundzustand !) emittieren sie Licht, dessen Wellenlänge länger ist als die des eingestrahlten Lichtes. Anti-Stokes-Streuung: Die Molekülkerne der Probe sind bereits in einem angeregten Zustand und absorbieren zusätzlich Energie durch die Bestrahlung. Beim Zurückfallen in einen energetisch tieferen Zustand emittieren sie Licht, dessen Wellenlänge kürzer ist als die des eingestrahlten Lichtes. |
Kohärente Anti-Stokes-Raman-Streuung (CARS)
Zur In-situ-Visualisierung von Festkörpereigenschaften von Arzneiformen während der Freisetzung bietet die Kohärente Anti-Stokes-Raman-Streuung (CARS) sehr vielversprechende Möglichkeiten. Die Methode wurde 1965 zum ersten Mal beschrieben. Sie basiert auf zwei Laserstrahlen, von welchen einer variabel in der Wellenlänge zu verstellen ist. Die Laserstrahlen werden überlappt und auf die Probe gerichtet, welche sich auf einem Mikroskoptisch befindet. Durch Interaktion zwischen Probe und Laserstrahlen entsteht ein substanzabhängiges CARS-Signal in Anti-Stokes-Frequenz, welches mittels eines Photomultipliers detektiert werden kann. Ein CARS-Signal kann generiert werden, wenn die Wellenlängen der einfallenden Strahlen mit einer Raman-aktiven Resonanzfrequenz übereinstimmen. Je nach einfallender Strahlung ist somit ein chemisch selektives Imaging der Probe möglich. Die Auflösung der Methode liegt im Submikrometer-Bereich in drei Dimensionen.
CARS wird derzeit in der Biologie und Biophysik erfolgreich zur Visualisierung von Geweben [13] und lebenden Zellen eingesetzt [14]. Außerdem können Stoffwechselvorgänge in Zellen sowie die Verteilung verschiedener Moleküle in biologischen Membranen abgebildet werden. Auch Polymerfilme wurden schon erfolgreich mittels CARS untersucht [15].
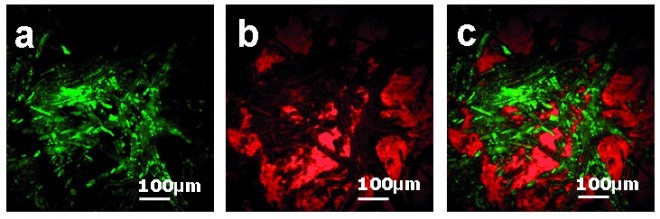
In der pharmazeutischen Forschung wurde CARS vor Kurzem zum ersten Mal erfolgreich zur Visualisierung der Arzneistoffverteilung in Tabletten sowie zur Echtzeit-Visualisierung der Festkörpereigenschaften während der Freisetzung eingesetzt [16]. Abbildung 2 zeigt CARS-Bilder der Oberfläche einer Tablette, die aus dem Hilfsstoff Tripalmitin und dem Arzneistoff Theophyllin besteht. Die CARS-Signale sind dort sowohl separat als auch gemeinsam dargestellt.
Kombination mit Durchflusszelle
Durch eine Kombination des CARS-Versuchsaufbaus mit einer selbst entwickelten Durchflusszelle können CARS-Aufnahmen in situ während der Freisetzung realisiert werden. Die Durchflusszelle ermöglicht das Einspannen einer festen Arzneiform in eine aus Teflon bestehende Strömungszelle, welche auf einer Seite durch eine dünne Glasscheibe begrenzt wird. Mittels einer Pumpe kann die eingespannte Probe kontinuierlich mit dem Freisetzungsmedium umspült werden. UV- und Vis-spektrometrische Messungen der freigesetzten Arzneistoffkonzentration im Medium sind simultan möglich. Die Probe wird während der Messung konstant mit Laserstrahlung bestimmter frei wählbarer Wellenlänge bestrahlt, welche substanzabhängig CARS-Signale hervorruft, die aufgezeichnet werden und mit den mikroskopischen Aufnahmen direkt in sehr hoher Auflösung korreliert werden können. Es ist also mit dem beschriebenen Versuchsaufbau möglich, eine zeit- und raumaufgelöste Visualisierung der Verteilung sowie der Festkörpereigenschaften von Hilfs- und Arzneistoffen in der Arzneiform während der Freisetzung in Echtzeit zu erreichen. CARS kombiniert eine mit anderen Methoden nicht erreichbare hohe Auflösung mit hoher Messgeschwindigkeit. Das dabei gewonnene tiefere Verständnis für die in der Arzneiform vorgehenden Freisetzungsmechanismen kann zur Formulierung von Arzneiformen mit maßgeschneiderten Freisetzungsprofilen genutzt werden.
In der durchgeführten Studie [16] ließ sich die Freisetzung von Theophyllin-Anhydrat aus einer Tripalmitin-Matrix in Echtzeit visualisieren. Außerdem konnte die Rekristallisation des schlechter löslichen Theophyllin-Monohydrat auf der Tablettenoberfläche visualisiert werden (Abb. 3). Allein anhand der UV-spektroskopisch ermittelten Freisetzungskurven wäre hier im Vergleich nur eine verzögerte Freisetzung durch die um die Hälfte reduzierte Löslichkeit der Monohydrat-Form im Vergleich zur besser löslichen Anhydrat-Form des Theophyllins aufgefallen. Die zugrunde liegende Rekristallisation der schlechter löslichen Monohydrat-Form hätte nicht visualisiert werden können.
Fazit
- Die Kombination von Lichtmikroskopie und CARS zur Visualisierung von Festkörpereigenschaften während der Freisetzung von Arzneistoffen aus Arzneiformen ermöglicht einen einzigartigen neuen Einblick in die zugrunde liegenden Freisetzungsprozesse.
- Damit ist es möglich, potenzielle Transformationen oder Interaktionen der Arzneiformbestandteile in einem frühen Stadium der Arzneimittelentwicklung zu erkennen und Lösungsansätze zu finden, um unerwünschte Veränderungen zu verhindern.
- Der in der Arzneimittelentwicklung erwünschte Quality-by-Design-Ansatz wird dadurch unterstützt, und es wird ein Beitrag zur gesteigerten Arzneimittelsicherheit geleistet.
- Die Methode ist sehr schnell und nicht invasiv – eine Kombination, die von bekannten Imaging-Techniken bisher nicht geleistet wird. Zudem ist die räumliche Auflösung sehr hoch.
- Die Kombination von CARS mit einer Durchflusszelle zeigt ein vielversprechendes Potenzial für eine breite Anwendung in der pharmazeutischen Entwicklung sowie in der Qualitätssicherung von Arzneimitteln.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.