
- DAZ.online
- DAZ / AZ
- DAZ 19/2010
- Hyperforin-haltige ...
Pharmakologie
Hyperforin-haltige Dermatika bei Neurodermitis
Die Ursachen der atopischen Dermatitis sind bis heute nicht vollständig bekannt. Man geht davon aus, dass der klinische Phänotyp der Erkrankung ein komplexes Zusammenspiel zwischen genetischer Disposition (Atopie), Umweltfaktoren, einer gestörten Hautbarriere, immunologischen und neurogenen Störungen ist. In den letzten Jahren hat vor allem die Outside-inside-Hypothese an Bedeutung gewonnen, der zufolge zuerst eine Störung der Hautbarriere vorliegt, sodass Allergene oder Mikroorganismen in die Haut eindringen können [8, 21, 6]. Hautinfektionen mit z. B. Staphylococcus aureus oder Herpesviren sind häufige Sekundärkomplikationen, die die Therapie erheblich erschweren.
Durch die gestörte Barrierefunktion kommt es zusätzlich zu einem erhöhten transepidermalen Wasserverlust (TEWL) und damit zu dem Kernsymptom "trockene Haut", das einen starken Juckreiz auslöst. Da die Patienten, besonders auch Kinder, auf den Juckreiz häufig mit Kratzen reagieren, kann es zu weiteren Hautirritationen kommen, die wiederum den Juckreiz verstärken und sekundäre Entzündungen und Infektionen begünstigen, sodass dieser Teufelskreis zu einem erheblichen Leidensdruck führt.
Störung der Keratinozyten-Differenzierung
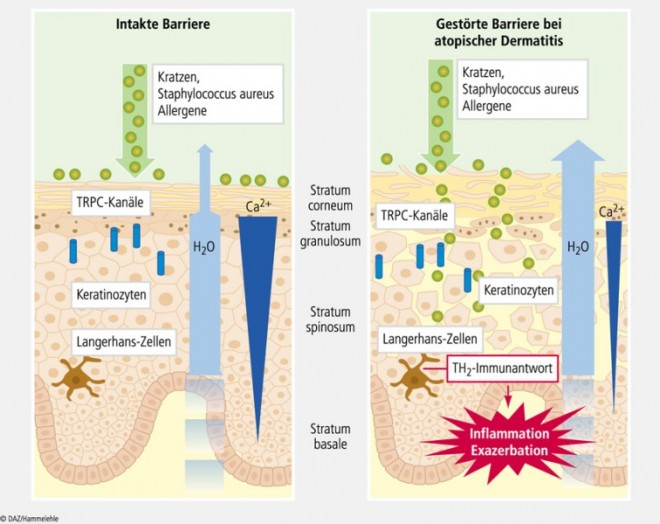
Die Epidermis, die äußerste Hautschicht, besteht aus vier Schichten, dem Stratum basale, dem Stratum spinosum, dem Stratum granulosum und dem Stratum corneum (Abb. 1). Keratinozyten machen 90% ihrer Zellpopulation aus. Neben ihnen findet man im Stratum basale Merkel-Zellen, die als Sinneszellen für die Wahrnehmung von Berührungsreizen verantwortlich sind, und im Stratum granulosum Langerhans-Zellen, die zum lymphatischen Abwehrsystem gehören.
Die Keratinozyten wandern nach der Zellteilung im Stratum basale langsam nach außen. Hierbei durchlaufen sie den streng regulierten Prozess der terminalen Differenzierung, um dann als apoptotische Korneozyten unter Ausbildung eines dichten Keratin-Lipid Zements ("cornified envelope") die luft- und wasserundurchlässige Hornschicht (Stratum corneum) zu bilden.
Bei Atopikern ist die Barrierefunktion der Epidermis gestört. Dies geht auf die der Erkrankung zugrunde liegende Störung der terminalen Differenzierung und Proliferation der Keratinozyten zurück [9, 17]. Die Ursache für diese Dysfunktion ist nicht vollständig bekannt. Sowohl in nicht-läsionaler Haut als auch in läsionaler Haut wurde eine verringerte Syntheserate der für die Differenzierung der Keratinozyten wichtigen Keratine 1 und 10 sowie eine erhöhte Syntheserate der Proliferations-assoziierten Keratine 6 und 16 und des Inflammations-assoziierten Keratins 17 nachgewiesen. Zudem ist die Synthese der Strukturproteine des Stratum granulosum – Involucrin, Loricrin und Filaggrin – verändert [7, 21]. Es wird weniger Filaggrin synthetisiert, und bei 20% der Patienten liegt dieses in einer "loss of function"-Mutation vor [21]. In einer kürzlich erschienenen Publikation konnte nachgewiesen werden, dass die aus T-Helferzellen freigesetzten Interleukine IL-4 und IL-13 die Ca2+ -induzierte Differenzierung und die Filaggrin-Synthese hemmen [11], was wiederum die gestörte Barrierefunktion verstärken kann.
Ca2+ -Gradient steuert Zelldifferenzierung
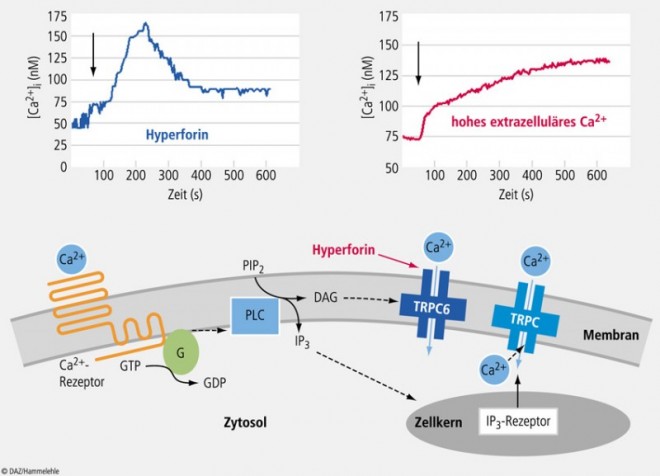
Eine wichtige Rolle bei der Regulation der Hautfunktionen spielt der Calciumgradient in der Epidermis, d. h. dass die extrazelluläre Konzentration freier Calcium-Ionen vom Stratum basale zum Stratum corneum ansteigt (Abb. 1) [9, 17]. Die extrazellulären Calcium-Ionen aktivieren den G-Protein-gekoppelten Calciumsensitiven Rezeptor und eine daran gekoppelten Phospholipase C, worauf intrazellulär Diacylglycerol (DAG) und Inositoltriphosphat (IP3) gebildet werden [5]. DAG verbleibt in der Membran und aktiviert unselektive TRPC-Kationenkanäle, durch die Ca2+ in die Zelle strömt, sodass die intrazelluläre Ca2+ -Konzentration ansteigt (Abb. 2) [10].
TRPC-Kanäle gehören zur großen Familie der TRP-Kanäle (Transient Receptor Potential), die sich in sieben Subklassen gliedert: TRPC (Canonical), TRPV (Vanilloid), TRPM (Melastatin), TRPN (Nomp), TRPA (Ankyrin), TRPP (Polycystein) und TRPML (Mucolipin) [5]. Unter den TRPC-Kanälen der Keratinozyten nimmt nach unseren eigenen Untersuchungen der TRPC6-Kanal eine ganz besondere Rolle ein [18].
Erhöhte intrazelluläre Calciumkonzentrationen in der unteren Epidermis stimulieren das Wachstum (Proliferation) der Keratinozyten, während sie in der oberen Epidermis die Differenzierung und Vernetzung der Keratinozyten und letztlich ihre Umwandlung in Korneozyten fördern. Der diesbezüglich sehr wichtige Calciumgradient scheint bei einigen Hauterkrankungen wie der atopischen Dermatitis oder der Psoriasis gestört oder komplett verloren gegangen zu sein [16, 20].
Hyperforin aktiviert TRPC6-Kanal
Obwohl die TRPC-Kanäle eine bedeutende Rolle in der Regulation der Keratinozyten-Differenzierung spielen, waren bis vor Kurzem keine spezifischen Aktivatoren von TRPC- und besonders von TRPC6-Kanälen bekannt. Unsere Arbeitsgruppe konnte in den letzten fünf Jahren zeigen, dass Hyperforin, der wichtigste antidepressive Inhaltsstoff des Johanniskrauts (Hypericum perforatum L.) [19], einen spezifischen Aktivator von TRPC6-Kanälen darstellt und über diesen Mechanismus nicht nur die neuronale Aufnahme von Neurotransmitter im Gehirn hemmen kann, sondern auch direkte neurotrophe Effekte wie eine Stimulation des Neuritenwachstums zeigt [26, 12, 13].
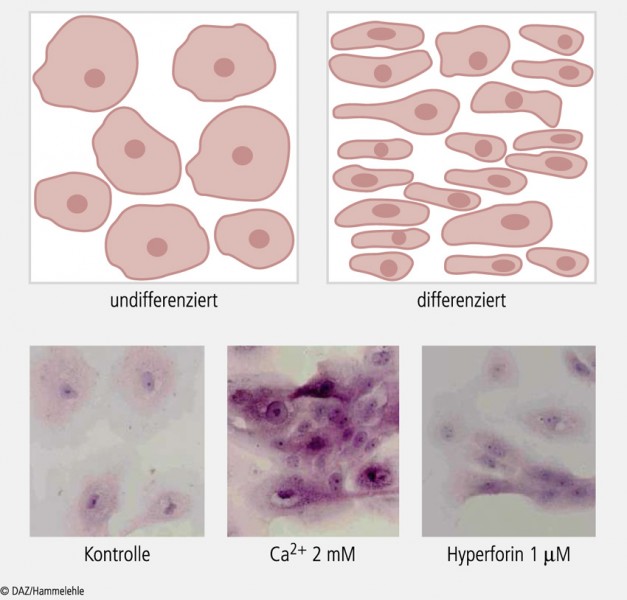
Es lag daher nahe zu prüfen, ob sich mit Hyperforin auch die Differenzierung von Keratinozyten fördern lässt, was wir in ausführlichen Untersuchungen an isolierten menschlichen Hautkeratinozyten, aber auch an einer humanen Keratinozyten-Zelllinie eindeutig belegen konnten [18]. Die Aktivierung des TRPC6-Kanals durch Hyperforin zeigte dabei den gleichen Effekt bezüglich Senkung der Proliferation und Aktivierung der Differenzierung wie eine Erhöhung der extrazellulären Calciumkonzentration (Abb. 2).
Durch beide Stimuli kam es zu einer gleich ausgeprägten Erhöhung der intrazellulären Ca2+ -Konzentration (Abb. 3). Hohe intrazelluläre Ca2+ -Spiegel sind essenziell, um die Differenzierung zu steuern und die Proliferation zu hemmen (s. Abb.3 links).
Es stellte sich jetzt die Frage, ob Hyperforin bei pathologischen Störungen der Keratinozytenfunktion, wie sie bei verschiedenen entzündlichen Hauterkrankungen vorliegen, genauso gut wirksam ist. Diese Frage konnten wir nach Experimenten an Keratinozyten von Psoriasis-Patienten positiv beantworten. Es ist schon lange bekannt, dass auch bei der Psoriasis ein Zusammenspiel von immunologischen Faktoren und Störungen des Differenzierungsprozesses den klinischen Phänotyp mit schuppiger, entzündlicher Haut ergibt. Von Psoriasis-Patienten isolierte Keratinozyten zeigten in unseren Untersuchungen eine deutliche Störung der Calcium-abhängigen Regulation von Proliferation und Differenzierung, wahrscheinlich aufgrund einer reduzierten Expression von TRPC-Kanälen (unveröffentlichte Ergebnisse unserer Arbeitsgruppe). Die Inkubation dieser Zellen mit Hyperforin führte zu einer deutlichen Verbesserung dieses Störungsmusters. Damit kann die Frage, ob mit Hyperforin ein gestörtes Differenzierungsmuster bei Hauterkrankungen zumindest partiell normalisiert werden kann, klar bejaht werden.
Äußerliche Anwendung von Johanniskraut bei Hauterkrankungen
Johanniskraut wird seit Jahrhunderten zur äußerlichen Behandlung von Wunden, Verbrennungen und Hautläsionen eingesetzt [14], hauptsächlich in Form des rötlichen Johanniskrautöls (heute meist auf Olivenöl-Basis), das durch die Extraktion von frischem Johanniskraut durch das Öl hergestellt wird. Die Vorschrift zur Herstellung wurde in das Ergänzungsbuch zum DAB 6 aufgenommen.
Neben einigen Hypericin-Abbauprodukten, die für die rötliche Farbe verantwortlich sind, wird durch das Öl im Wesentlichen Hyperforin aus dem Johanniskraut extrahiert, erreicht dabei allerdings nur relativ geringe Konzentrationen [15]. Neuerdings stehen mit überkritischem Kohlendioxid gewonnene hyperforinreiche Johanniskrautextrakte zur Verfügung, die kein photosensibilisierendes Hypericin enthalten, was bei der äußerlichen Anwendung von Vorteil ist.
Der Nutzen der externen Anwendung von Johanniskrautextrakten wird mit der antimikrobiellen und entzündungshemmenden Wirkung von Hyperforin in Verbindung gebracht [4, 1]. So konnte gezeigt werden, dass reines Hyperforin das Wachstum von multiresistenten Staphylococcus aureus -Stämmen in vitro hemmt [23] und ein dualer Hemmstoff der Lipoxygenase und der Cyclooxygenase ist [1]. In vivo konnte die antibakterielle Wirkung eines hyperforinreichen Johanniskrautextraktes in einer klinischen Studie an Patienten mit Neurodermitis belegt werden [22]. Eine weitere Studie zeigte, dass Hyperforin in einer Kokultur von epidermalen Zellen mit allogenen T-Lymphozyten die T-Zell-Proliferation signifikant hemmt [23]. Dabei inhibierte Hyperforin die allostimulatorische Kapazität der epidermalen Zellen, d. h. deren Einfluss auf Immunzellen.
Die klinische Wirksamkeit eines hyperforinreichen Johanniskrautextraktes bei Neurodermitis konnte in einer randomisierten placebokontrollierten Doppelblindstudie an Patienten mit atopischer Dermatitis bestätigt werden. Es zeigte sich eine signifikante Überlegenheit der Hyperforin-haltigen Creme (1,5% Hyperforin) gegenüber dem wirkstofffreien Vehikel im Hinblick auf die klinischen Symptome der Neurodermitis. Da gleichzeitig die Besiedlung der Haut mit Staphylokokken abnahm, hat wahrscheinlich auch die antibakterielle Wirksamkeit zu dem Ergebnis beigetragen.
Unsere oben beschriebenen Forschungsergebnisse zu Hyperforin legen nahe, dass die Förderung der Keratinozytendifferenzierung über die Aktivierung des TRPC6-Kanals ein weiterer wichtiger Wirkmechanismus für die klinische Wirksamkeit einer Hyperforin-haltigen Creme bei der atopischen Dermatitis sein könnte. Hyperforin hätte sich damit als ein faszinierendes Molekül erwiesen, das über die Aktivierung des TRPC6-Kanals nicht nur sehr gute antidepressive Eigenschaften vermitteln kann [18], sondern auch die gestörte Keratinozyten-Funktion verbessert. Dies kann neben den antimikrobiellen und entzündungshemmenden Effekten die klinische Wirksamkeit bei der atopischen Dermatitis erklären.
Auch Juckreiz hat mit TRP-Kanälen zu tun
Eines der belastenden Kernsymptome der atopischen Dermatitis, das sich im Laufe der Erkrankung durch die weitere Schädigung der Hautbarriere verschlimmert, ist der Juckreiz. Es gibt Hinweise, dass einige TRP-Kanäle an der Entstehung von Juckreiz beteiligt sind, nämlich TRPV1, TRPV3, TRPV4, TRPM8 und TRPA1 [25, 3], und dass sie möglicherweise durch den mechanischen Reiz des Kratzens aktiviert werden. TRPV1, -V3 und -V4 können auch durch Hitze aktiviert werden, TRPM8 hingegen durch Kälte. Auch TRPC1 und TRPC6 scheinen an der Entstehung von Juckreiz beteiligt zu sein [2].
Da verschiedene andere TRP-Kanäle ähnlich wie TRPC6 über Diacylglycerol (DAG) aktiviert werden und sich die Aktivierungsstelle von Hyperforin am TRPC6-Kanal wahrscheinlich mit derjenigen von DAG deckt (s. o.), ist auch eine Aktivierung anderer TRP-Kanäle, z. B. vom V- oder M-Typ, durch Hyperforin denkbar – ein Ansatz, an dem wir zurzeit arbeiten.
Literatur [1] Albert D, et al. Hyperforin Is a Dual Inhibitor of Cyclooxygenase-1 and 5-Lipoxygenase. Biochem Pharmacol 2002;64:1767 – 1775. [2] Alessandri-Haber N, et al. TRPC1 and TRPC6 Channels Cooperate With TRPV4 to Mediate Mechanical Hyperalgesia and Nociceptor Sensitization. J Neurosci 2009;29:6217 – 6228. [3] Biro T, et al. TRP Channels As Novel Players in the Pathogenesis and Therapy of Itch. Biochim Biophys Acta 2007;1772:1004 – 1021. [4] Bombardelli E, Morazzoni P. Hypericum perforatum. Fitoterapia 1995;66:43 – 68. [5] Clapham DE. TRP Channels As Cellular Sensors. Nature 2003;426:517 – 524. [6] Cork MJ, Danby S. Skin Barrier Breakdown: a Renaissance in Emollient Therapy. Br J Nurs 2009;18:872 – 877. [7] Cork MJ, et al. Epidermal Barrier Dysfunction in Atopic Dermatitis. J Invest Dermatol 2009;129:1892 – 1908. [8] De Benedetto A, et al. Atopic Dermatitis: a Disease Caused by Innate Immune Defects? J Invest Dermatol 2009:129:14 – 30. [9] Forslind B. Quantitative X-Ray Microanalysis of Skin. Particle Probe Evaluation of the Skin Barrier Function. Acta Derm Venereol Suppl (Stockholm) 1987;134:1 – 8. [10] Hofmann T, et al. Direct Activation of Human TRPC6 and TRPC3 Channels by Diacylglycerol. Nature 1999;397:259 – 263. [11] Howell MD, et al. Th2 Cytokines Act on S100/A11 to Downregulate Keratinocyte Differentiation. J Invest Dermatol 2008;128:2248 – 2258. [12] Leuner K., et al. Simple 2,4-diacylphloroglucinols as TRPC6 activators – identification of a novel pharmacophore. Mol Pharmacol, in press. [13] Leuner K, et al. Hyperforin a Key Constituent of St. John‘s Wort Specifically Activates TRPC6 Channels. FASEB J 2007;21:4101 – 4111. [14] Maisenbacher P, Kovar KA. Analysis and Stability of Hyperici Oleum. Planta Med 1992:58:351 – 354. [15] Maisenbacher P, Kovar KA. Analysis and Stability of Hyperici Oleum. Planta Med 1992;58:351 – 354. [16] Menon GK, Elias PM. Ultrastructural Localization of Calcium in Psoriatic and Normal Human Epidermis. Arch Dermatol 1991;127:57 – 63. [17] Menon GK, Grayson S, Elias PM. Ionic Calcium Reservoirs in Mammalian Epidermis: Ultrastructural Localization by Ion-Capture Cytochemistry. J Invest Dermatol 1985;84:508 – 512. [18] Müller M, et al. Specific TRPC6 Channel Activation, a Novel Approach to Stimulate Keratinocyte Differentiation. J Biol Chem 2008;283:33942 – 54. [19] Müller WE. Current St John‘s Wort Research From Mode of Action to Clinical Efficacy. Pharmacol Res 2003;47:101 – 109. [20] Pallon J, et al. Pixe Analysis of Pathological Skin With Special Reference to Psoriasis and Atopic Dry Skin. Cell Mol Biol (Noisy-le-Grand) 1996;42:111 – 118. [21] Proksch E, et al. Role of the Epidermal Barrier in Atopic Dermatitis. J Dtsch Dermatol Ges 2009;7:899 – 910. [22] Schempp CA, et al. Topical Treatment of Atopic Dermatitis With St. John‘s Wort Cream – a Randomized, Placebo-Controlled, Double Blind Half-Side Comparison. Phytomedicine 2003;10 Suppl 4:31 – 37. [23] Schempp CM, et al. Antibacterial Activity of Hyperforin From St John‘s Wort, Against Multiresistant Staphylococcus aureus and Gram-Positive Bacteria. Lancet 1999;353:2129. [24] Schempp CM, et al. Topical Application of St John‘s Wort (Hypericum perforatum L.) and of Its Metabolite Hyperforin Inhibits the Allostimulatory Capacity of Epidermal Cells. Br J Dermatol 2000;142:979 – 984. [25] Steinhoff M, Biro T. A TR(I)P to Pruritus Research: Role of TRPV3 in Inflammation and Itch. J Invest Dermatol 2009;129:531 – 535. [26] Treiber K, Singer A, Henke B, Muller WE. Hyperforin Activates Nonselective Cation Channels (NSCCs). Br J Pharmacol 2005;145:75 – 83. [27] Williams HC. Clinical Practice. Atopic Dermatitis. N Engl J Med 2005;352:2314 – 2324.
Korrespondenzautoren
Prof. Dr. Walter E. Müller und Dr. Kristina Leuner,
Pharmakologisches Institut für Naturwissenschaftler
Max-von-Laue-Str. 9,
60438 Frankfurt
Zusammenfassung und AusblickDie externe Anwendung von Johanniskraut bei der atopischen Dermatitis, die mit einer Differenzierungsstörung der Keratinozyten einhergeht, hat eine lange Geschichte, aber keine oder nur sehr wenige evidenzbasierte wissenschaftliche Daten. Im Gegensatz zur antidepressiven Wirkung, wo man früher eher Hypericin als den wirksamen Bestandteil angesehen hatte, hat man für die externe Anwendung immer schon das Hyperforin als wichtigsten Inhaltsstoff definiert, weil es entzündungshemmend und antibakteriell wirkt. Ausgehend von unseren neuen Erkenntnissen, dass Hyperforin über die Aktivierung des Ionenkanals TRPC6 der für die antidepressive Wirksamkeit wichtigste Inhaltsstoff von Johanniskraut ist, konnten wir in weiterführenden Untersuchungen zeigen, dass Hyperforin über den gleichen Mechanismus auch Störungen der Keratinozyten-Reifung wie bei Neurodermitis verbessern kann. Unsere Daten können daher die externe Anwendung von Hyperforin-haltigen Präparaten auf eine ganz neue Basis stellen und damit einen Beitrag leisten, die Therapie dieser sehr häufigen Erkrankungen zu optimieren. Diese experimentellen Befunde müssen jedoch mit weiteren klinischen Studien untermauert werden. |




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.