
- DAZ.online
- DAZ / AZ
- DAZ 14/2003
- Artischocken-Präparate
Phytotherapie
Artischocken-Präparate
Die Artischocke, Cynara scolymus L. (Asteraceae), ist ein im gesamten Mittelmeergebiet verbreitetes, ausdauerndes Kraut mit distelartigem Habitus. Sie erreicht eine Höhe von bis zu 2 m und bildet pro Blütenstiel ein bis zwei Blütenköpfe aus; der Blütenboden und die fleischigen Hüllblätter werden in gekochter Form als Gemüse geschätzt. Die Kronblätter der Einzelblüten sind von lila-bläulicher bis weißer Färbung, die fiederschnittigen Laubblätter teilweise bedornt. Im ersten Jahr bildet die Pflanze zumeist nur eine Blattrosette aus, deren Blätter arzneilich genutzt werden. Hauptanbaugebiete für die Artischocke sind der gesamte Balkanraum, Frankreich, Spanien und die USA [1 – 3].
Verwendung
Die volksmedizinische Verwendung der Artischocke ist im deutschsprachigen Raum seit dem 16. Jahrhundert dokumentiert, so empfiehlt bereits Leonhart Fuchs in seinem "New Kreüterbuch" von 1543 Artischockenblätter als Mittel bei Leber- und Nierenleiden [4]. Im 19. Jahrhundert wurden Extrakte der Pflanze vor allem gegen Gelenkrheumatismus, Gelbsucht und Leberinsuffizienz eingesetzt. Heute wird die Droge meist in Form des Trockenextraktes als Leberschutzmittel, zur Arteriosklerose-Prävention, als Amarum und als Choleretikum bei Verdauungsbeschwerden eingesetzt [5, 6].
Inhaltsstoffe und biologische Aktivitäten
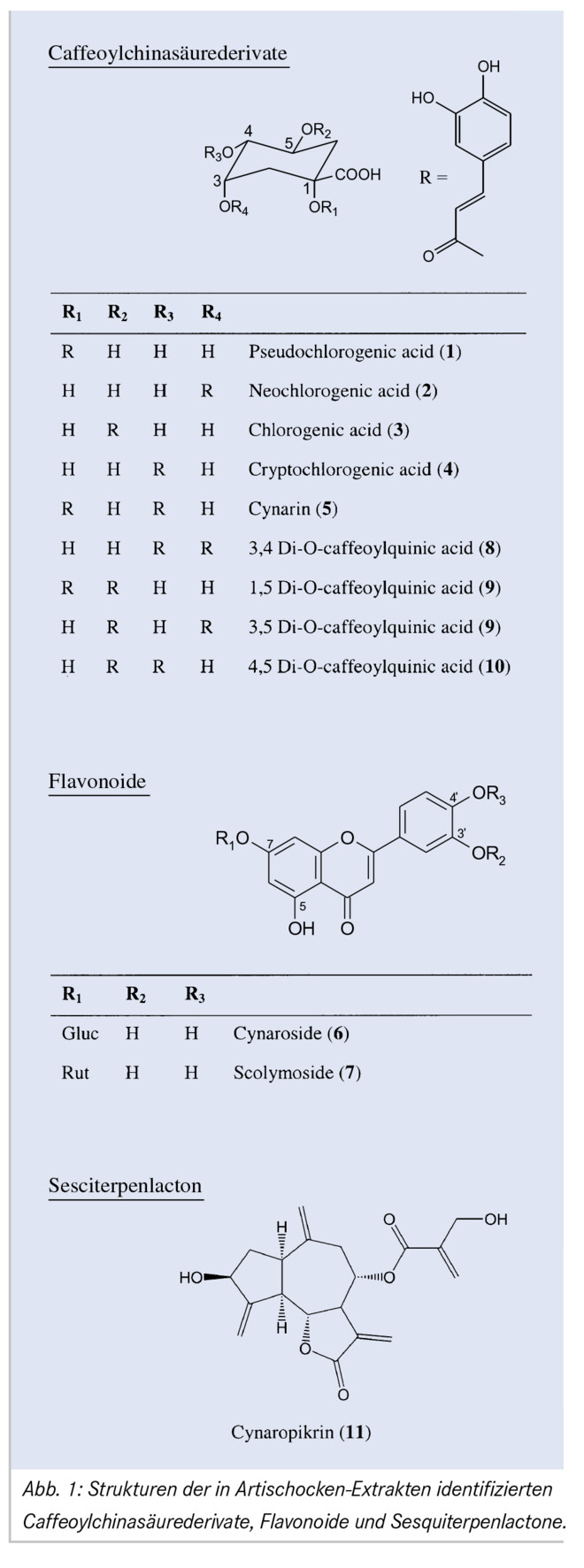
Für die pharmakologischen Aktivitäten der Artischocke werden Caffeoylchinasäurederivate, Flavonoide und Sesquiterpenlactone verantwortlich gemacht (Abb. 1). Erstere werden in Mono- (Substanzen 1 – 4) bzw. Dicaffeoylchinasäuren (Substanzen 5, 8 – 10) unterteilt; sie weisen eine choleretische (den Gallenfluss anregende) und teilweise cholesterinsenkende Wirkung (z. B. Cynarin) auf. Dieser positive Effekt auf den Cholesterinspiegel beruht nicht nur auf einer choleretisch verstärkten Elimination, sondern auch auf einer Hemmung der De-novo-Synthese von Cholesterin durch Inhibition der HMG-CoA-Reduktase [7, 8].
Die in den Blättern bislang identifizierten Flavonoide sind allesamt Luteolinglykoside (z. B. 6, 7); sie führen im Tierversuch zu einer gesteigerten Gallensäureproduktion und zeigen antioxidative Aktivitäten (Leberschutzwirkung) [9, 10]. Das Sesquiterpenlacton Cynaropikrin (11) ist das bittere Prinzip in der Artischocke (Bitterwert 400 000) und erklärt die Verwendung der Pflanze als Amarum [1].
Vergleich der Präparate
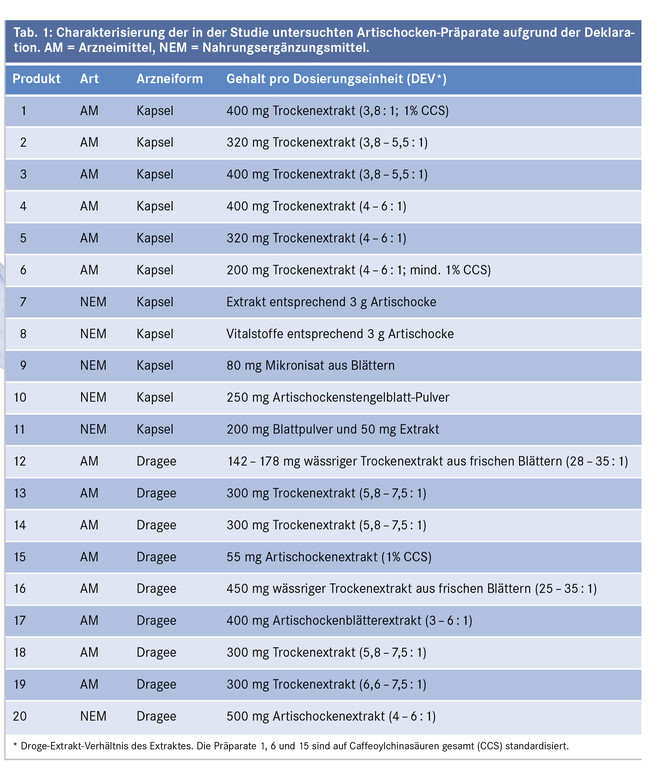
Cynara-Produkte werden in Deutschland und Österreich entweder als Arzneimittel oder Nahrungsergänzungsmittel in den Handel gebracht. Meist handelt es sich um Kapseln oder Dragees, die aus standardisierten Trockenextrakten (1% Caffeoylchinasäuren berechnet als Cynarin oder Chlorogensäure) hergestellt werden. Andere Produkte enthalten das Blatt-Pulver.
Ziel der durchgeführten Untersuchungen war es, anhand einer neu entwickelten, effizienten und ökonomischen HPLC-Methode einen Überblick über den Wirkstoffgehalt verschiedener Artischockenpräparate zu gewinnen bzw. auch die Chargenkonformität einzelner Produkte zu untersuchen.
Analytik
In der Literatur sind bereits mehrere Methoden zur Analytik von C. scolymus beschrieben, keine davon erlaubt allerdings die gleichzeitige Bestimmung aller Stoffgruppen von Interesse. Angaben zur Validierung der publizierten Methoden, eine Grundvoraussetzung für die industrielle Qualitätskontrolle und Qualitätssicherung, fehlen oder sind nicht ausreichend [11 – 16].
Die von uns entwickelte HPLC-Methode sollte nicht nur diesen Anforderungen gerecht werden, sondern auch möglichst ökonomisch sein (d. h. bestmögliche Trennung in kurzer Zeit, bei gleichzeitig geringem Lösungsmittel-Verbrauch). Diese Vorgabe wurde durch die Verwendung einer "narrow bore" Säule, einer Trennsäule mit einem geringen Innendurchmesser von 2 mm, erreicht (Abb. 2). Die HPLC-Flussrate konnte dadurch von den üblichen 1,0 ml/min auf 0,2 ml/min reduziert werden, was zu einer erheblichen Reduktion des Lösungsmittelverbrauches führte.
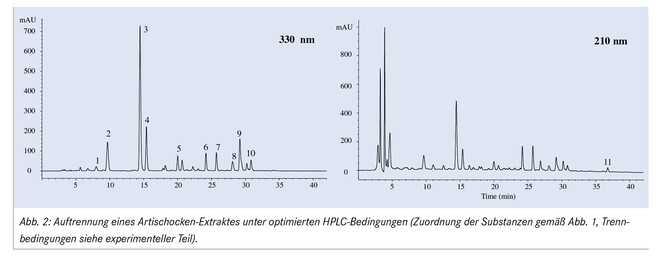
Eine sorgfältige Optimierung aller relevanten Trennparameter (mobile Phase, Säulenmaterial, Temperatur) führte auch zu einer deutlichen Verbesserung der chromatographischen Trennung. Dabei zeigte sich eine starke Abhängigkeit zwischen pH-Wert der mobilen Phase und der erzielten Peakauflösung. Erst bei pH-Werten von unterhalb 2,9 war eine Grundlinientrennung aller Substanzen innerhalb von 40 min möglich, einzig zwei Dicaffeoylchinasäuren konnten nicht getrennt werden (Peak 9).
Bei einer Wellenlänge von 330 nm konnten mit Ausnahme des Cynaroprikrins alle Substanzen im Chromatogramm eindeutig identifiziert werden. Die Zuordnung erfolgte durch einen Vergleich mit Referenzsubstanzen (UV-Spektrum, Retentionszeit, Zumischen von Reinsubstanz) bzw. mithilfe von online aufgenommenen MS-Spektren. Cynaropikrin, eine Verbindung mit schwachem Chromophor, wurde bei 210 nm detektiert und quantifiziert. Abschließend wurde die Methode gemäß der ICH-Richtlinien hinsichtlich Spezifität, Linearität, Wiederholpräzision, Richtigkeit und Robustheit validiert [16]. Einzelheiten zur Durchführung und die gewonnenen Resultate finden sich unter [17, 18].
Resultate
Inhaltsstoffmuster
Im Zuge der durchgeführten Studie wurden 20 Handelspräparate (Tab. 1) auf ihren Gehalt an Mono- und Dicaffeoylchinasäuren bzw. Flavonoiden und Cynaropikrin untersucht. Davon waren 14 als Arzneimittel zugelassen und enthielten als Wirkstoff ausschließlich den Trockenextrakt der Pflanze. Die restlichen sechs Präparate waren Nahrungsergänzungsmittel. Von den untersuchten Proben waren die Präparate 1 bis 11 als Kapseln formuliert, die übrigen neun als Dragees. Angaben über die Herkunft der untersuchten Proben können von den Autoren angefordert werden.
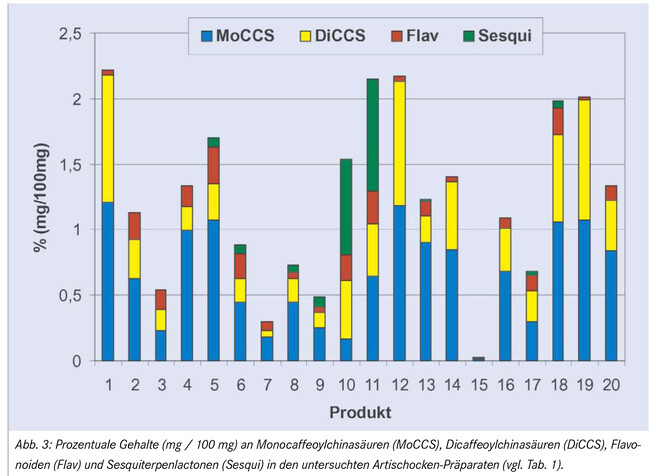
Die Substanzen wurden zwar individuell quantifiziert, die Ergebnisse aber wegen der Übersichtlichkeit nach Stoffgruppen zusammengefasst. Wie die Resultate zeigen (Abb. 3), waren in allen als Arzneimittel zugelassenen Produkten Monocaffeoylchinasäuren die dominierende Substanzklasse (0,01 bis 1,21%), gefolgt von Dicaffeoylchinasäuren (0,002 bis 0,97%) und Flavonoiden (0,01 bis 0,28%). Das Sesquiterpenlacton Cynaropikrin war in diesen Proben nicht oder nur in sehr geringen Mengen vorhanden (max. 0,07%). Anders bei den Nahrungsergänzungsmitteln, wo diese Verbindung eine große Schwankungsbreite zeigte (0,0 bis 0,85%) und bei den Produkten 10 und 11 (beide bestehend aus Blattpulver) sogar die Hauptkomponente darstellte.
Ansonsten erlaubten die Daten keine generelle Unterscheidung zwischen Arzneimitteln und Nahrungsergänzungsmitteln. Die Nahrungsergänzungsmittel wiesen im Schnitt zwar geringere Gehalte an Flavonoiden, Sesquiterpenlactonen, Mono- und Dicaffeoylchinasäuren auf, das Produkt mit dem geringsten Gesamtgehalt war jedoch ein Arzneimittel (Produkt 15).
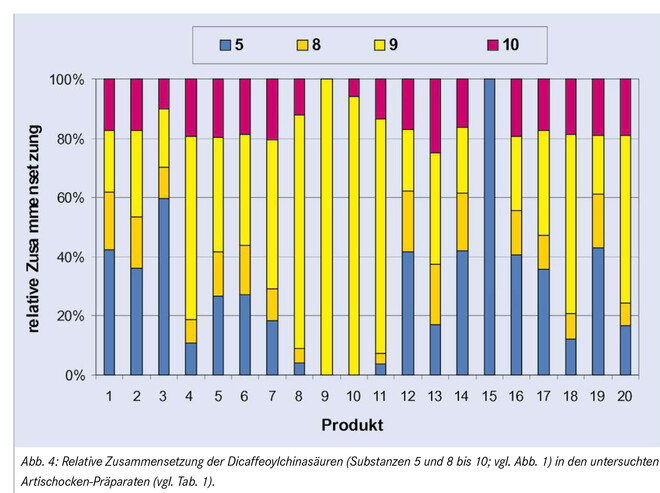
Auch die relative Zusammensetzung innerhalb der einzelnen Stoffklassen, wie in Abbildung 4 für die Gruppe der Dicaffeoylchinasäuren dargestellt, erlaubte a priori keine eindeutige Zuordnung eines Präparates als Arzneimittel oder Nahrungsergänzungsmittel. Cynarin (5) konnte nur in Präparaten festgestellt werden, die Cynara-Trockenextrakt enthalten (es fehlt vollständig in den nur Blattpulver enthaltenden Produkten 9 und 10). Dieses Ergebnis stimmt mit den Angaben der Literatur überein, denn Cynarin liegt in der Artischocke nicht genuin vor, sondern wird erst im Zuge des Extraktionsprozesses als Artefakt gebildet [2].
Tagesdosen
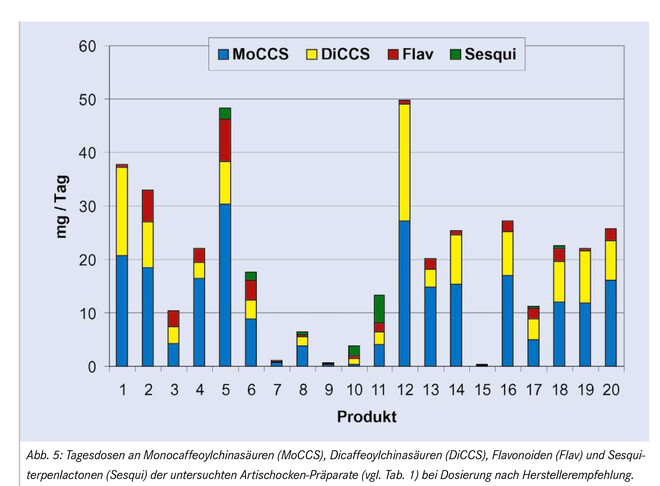
Vergleicht man die Tagesdosen an Mono-, Dicaffeoylchinasäuren, Flavonoiden und Sesquiterpenlactonen (bei Dosierung entsprechend der Empfehlung des jeweiligen Herstellers), so zeigt sich, dass die meisten Arzneimittelprodukte eine tägliche Aufnahme zwischen 15 und 30 mg an den oben erwähnten Cynara-Inhaltsstoffen (Gesamtgehalt) gewährleisten (Abb. 5). Diese Werte sind bei den Nahrungsergänzungsmitteln deutlich niedriger und liegen bei den Präparaten 7 bis 11 zwischen 0,74 und 13,36 mg. Nur bei einem einzigen Nahrungsergänzungsmittel-Präparat, Produkt 20, ist die Tagesdosis mit 25,65 mg im Bereich jener der Arzneimittel. Die höchsten Gesamtwerte zeigten die Produkte 5 und 12 (beides Arzneimittel) mit einer Tagesdosis von nahezu 50 mg.
Die Kommission E fordert in ihrer Monographie einen Mindestrichtwert von 12,0 mg Caffeoylchinasäuren pro Tag [19]. Mit Ausnahme der Produkte 5, 15 und 17 erfüllten alle als Arzneimittel zugelassenen Cynara-Präparate diese Forderung, von den Nahrungsergänzungsmitteln jedoch nur das Produkt 20.
Chargenkonformität
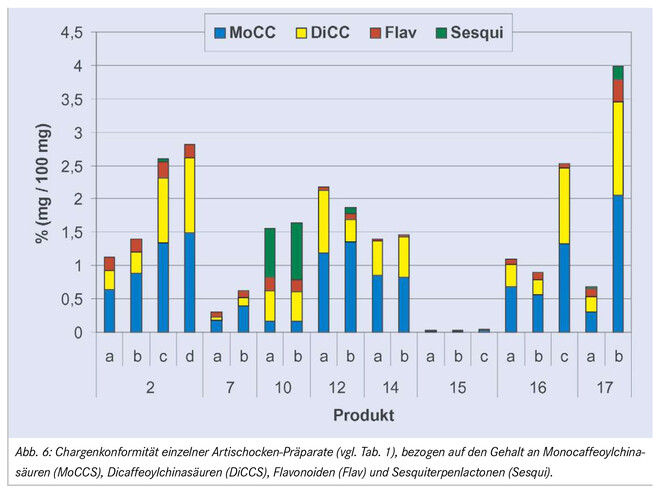
Abschließend wurde die Chargenkonformität einzelner Produkte untersucht (Abb. 6). Zwar blieb das Mengenverhältnis von Mono- und Dicaffeoylchinasäuren, Flavonoiden und Sesquiterpenlactonen bei den einzelnen Chargen meist nahezu unverändert, der Gesamtgehalt schwankte jedoch beträchtlich. So zeigten die vier untersuchten Chargen des Produktes 2 einen Gesamtgehalt im Bereich von 1,13 bis 2,81%; extreme Abweichungen waren auch bei zwei Chargen des Produktes 17 (0,68 bis 3,97%, d. h. ein nahezu 6facher Unterschied) festzustellen. Einen relativ gleichförmigen Gehalt zeigten hingegen die untersuchten Proben der Produkte 10 und 14 (1,54 bis 1,65% bzw. 1,40 bis 1,45%).
Zusammenfassung
Die neu entwickelte HPLC-Methode erwies sich als optimales Analysenverfahren zur Bestimmung der Inhaltsstoffe von Cynara scolymus. Sie erlaubt die relativ rasche und ökonomische Bestimmung von elf wertbestimmenden Substanzen in Artischocken-Extrakten und entspricht allen Erfordernissen eines validierten Analysenverfahrens.
Die durchgeführte Marktstudie – es wurden 20 Produkte untersucht – zeigte große qualitative und quantitative Schwankungen zwischen den einzelnen Produkten auf:
- Cynaropikrin, der Bitterstoff der Artischocke, war in größeren Mengen nur in aus Blattpulver bestehenden Präparaten nachzuweisen. Der relativ apolare Stoff dürfte im Zuge der Extraktherstellung bei den meisten Herstellungsverfahren verloren gehen.
- Bezüglich des Gehaltes an phenolischen Verbindungen waren Monocaffeoylchinasäuren dominierend (bis zu 1,2% in den Produkten), gefolgt von Dicaffeoylchinasäuren und Flavonoiden. Ein signifikanter Unterschied zwischen als Arzneimitteln und Nahrungsergänzungsmitteln zugelassenen Produkten war, wenn man die absolute Zusammensetzung betrachtet, nur schwer zu erkennen. Allerdings werden die Nahrungsergänzungsmittel generell unterdosiert eingesetzt.
- So erreichte nur eins von sechs Nahrungsergänzungsmitteln die von der Kommission E geforderte Tagesdosis von 12,0 mg Caffeoylchinasäuren.
- Von den untersuchten 14 Arzneimitteln lagen hingegen elf Präparate oberhalb dieses Schwellenwertes.
Betrachtet man die Chargenkonformität einiger ausgewählter Produkte, so waren die Ergebnisse sehr unterschiedlich. Gehaltsschwankungen um das 6fache sollten aber auf jeden Fall die Bedeutung und Notwendigkeit einer permanenten Qualitätskontrolle bei der Herstellung der Produkte unterstreichen, denn nur so können Wirksamkeit und Sicherheit für den Konsumenten gewährleistet werden.
Experimenteller Teil
Untersuchungsmaterial Sämtliche in dieser Studie untersuchten Handelspräparate wurden zwischen 1999 und 2000 in Apotheken oder Reformhäusern in Deutschland und Österreich gekauft. Pflanzenmaterial zur Isolierung von Vergleichssubstanzen (C. scolymus Blattdroge) wurde von Fa. Bionorica AG (Neumarkt) zur Verfügung gestellt.
Isolierung einzelner Inhaltsstoffe Chlorogensäure und Luteolin (dieses wurde zur Quantifizierung der nur in geringen Mengen isolierten Flavonoide 6 und 7 verwendet) stammten von Roth, Karlsruhe; Substanzen 2 und 4 wurden gemäß einer in der Literatur beschriebenen Synthese aus Chlorogensäure hergestellt [20].
Alle anderen Reinsubstanzen wurden mittels chromatographischer Methoden aus der Blattdroge isoliert. Ausgehend vom Methanolextrakt erfolgte eine Auftrennung mittels Gelchromatographie (Sephadex LH-20 mit Methanol als Eluent), gefolgt von Lobar Niederdruck-Chromatographie auf RP-18-Material. Dabei wurden mit 0,03% Trifluoressigsäure (TFA) versetzte Methanol-Wasser-Mischungen als mobile Phase eingesetzt. Cynaropikrin (11) wurde aus dem Dichlormethanextrakt mittels mehrmaliger Säulenchromatographie auf Kieselgel, gefolgt von Sephadex LH-20 und Lobar, isoliert (genauere Angaben siehe unter [18]). Die Reinheit und Identität der so isolierten Verbindungen wurde mittels DC, HPLC-MS und NMR überprüft.
Probelösung Jeweils 70,0 bis 90,0 mg des Handelsproduktes (Dragee oder Kapsel) wurden in 2,0 ml einer Methanol-Wasser-Mischung (85/15) aufgenommen und 5 min im Ultraschallbad extrahiert. Von den untersuchten Dragees wurde zuvor die Umhüllung manuell entfernt und nur der gepulverte Drageekern zur weiteren Bestimmung verwendet. Die Probelösung wurde anschließend durch ein 0,45-µm-Celluloseacetat-Membranfilter (Sartorius, Göttingen) filtriert und dann injiziert.
Bestimmung des Wassergehaltes Der Wassergehalt aller untersuchten Proben, bestimmt mittels Karl-Fischer-Titration, lag durchschnittlich bei 5,5% (Kapseln) bzw. 6,4% (Dragees). Die zur Quantifizierung eingesetzten Probemengen wurden um den für das jeweilige Produkt ermittelten Wassergehalt korrigiert.
Chromatographische Bedingungen HPLC-Gerät: HP 1100 Liquid Chromatograph (Agilent, Waldbronn) mit Photodiodenarray-Detektor, Autosampler und Säulenofen; Säule: Luna C18 (250 x 2 mm, 5 µm Partikelgröße) von Phenomenex (Torrance, CA, USA); Eluent: 0,03% TFA in Wasser (A), Acetonitril (B); Gradient: von 90A/10B in 35 min auf 64A/36B und dann in weiteren 10 min auf 20A/80B; Flussrate: 0,2 ml/min; injiziertes Probenvolumen: 2 µl; Detektion: 210 und 330 nm; Säulentemperatur: 25 °C; Methodenvalidierung: Gemäß den ICH-Richtlinien für Pharmazeutika zum menschlichen Gebrauch wurde die entwickelte HPLC-Methode auf ihre Spezifität, Linearität, Wiederholpräzision, Richtigkeit und Robustheit überprüft. Die erhaltenen Werte lagen alle innerhalb der geforderten Grenzen; Details zur Methodenvalidierung finden sich unter [17, 18].
Literatur
[1] R. Hänsel, K. Keller, H. Rimpler und G. Schneider (Hrsg.):
Hagers Handbuch der pharmazeutischen Praxis, 5. Aufl.,
Bd. 4. Springer-Verlag, Berlin/Heidelberg 1992.
[2] N. Brand: Z. Phytother. 11, 169 (1990).
[3] D. Wagenbreth: Dtsch. Apoth. Ztg. 136, 3818 (1996).
[4] B. Baumann, H. Baumann und S. Baumann-Schleihauf:
Die Kräuterbuch-Handschrift des Leonhart Fuchs. Ulmer
Verlag, Stuttgart 2001.
[5] H. Wagner: Arzneidrogen und ihre Inhaltsstoffe. Wissenschaftliche
Verlagsgesellschaft, Stuttgart 1999.
[6] E. Teuscher: Biogene Arzneimittel. Wissenschaftliche Verlagsgesellschaft,
Stuttgart 1997.
[7] R. Gebhardt: medwelt 46, 348 (1995).
[8] R. Gebhardt: J. Pharmacol. Exp. Ther. 286, 1122 (1998).
[9] P. Matuschowski: Beitrag zur Pharmakologie und Wirkstoff-
Findung von Cynara scolymus L., Dissertation, Universität
Münster 1998.
[10] R. Gebhardt und Mitarbeiter: Cell. Biol. Toxicol. 13, 57
(1997).
[11] T. Adzet und M. Puigmacia: J. Chromatogr. 348, 447
(1985).
[12] N. Brand und H. Weschta: Z. Phytother. 12, 15 (1991).
[13] H. Schilcher und H. Hagels: Dtsch. Apoth. Ztg. 139, 2725
(1999).
[14] A. Krawczyk: Herba Polonica 47, 130 (2001).
[15] P.Sˇ evc`iková, Z. Glatz und J. Slanina: Electrophoresis 23,
249 (2002).
[16] ICH Harmonized Tripartite Guideline „Validation of Analytical
Procedures: Methodology“. CPMP/ICH/181/95.
[17] M. Häusler, M. Ganzera, G. Abel, M. Popp und H. Stuppner:
Chromatographia 56, 407 (2002).
[18] M. Häusler: Phytochemische, analytische und pharmakologische
Untersuchungen zu Cynara scolymus L., Dissertation,
Universität Innsbruck 2001.
[19] BAnz. Nr. 122 vom 6.7.1988.
[20] K. R. Hanson: Biochemistry 12, 2719 (1965).
Anschriften der Verfasser:
Dr. Monika Häusler, Univ.-Ass. Dr. Markus Ganzera und Univ.-
Prof. Dr. Hermann Stuppner, Institut für Pharmazie – Abteilung
Pharmakognosie, Leopold-Franzens-Universität Innsbruck,
Innrain 52, A-6020 Innsbruck
Dr. Gudrun Abel und Prof. Dr. Michael Popp, Bionorica AG,
Kerschensteinerstr. 11 – 15, 92318 Neumarkt
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.