
- DAZ.online
- News
- Pharmazie
- EMA empfiehlt an Omikron ...
Vielfalt als Schlüsselelement der Impfstrategie
EMA empfiehlt an Omikron BA.1 angepasste Corona-Impfstoffe zur Zulassung
Stuttgart - 01.09.2022, 17:50 Uhr
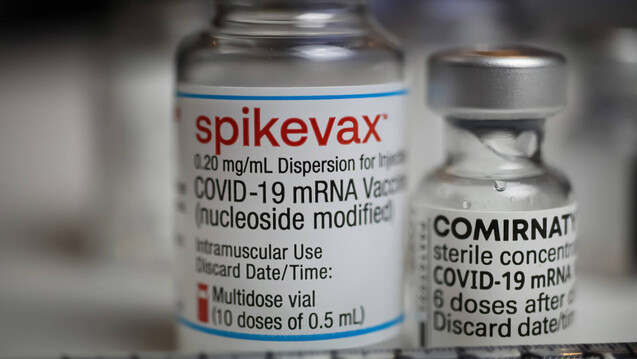
Tatsächlich handelt es sich bei der Zulassungsempfehlung der EMA um keine neue, sondern eine Ergänzung der bereits bestehenden bedingten Comirnaty- und Spikevax-Zulassungen. (s / Foto: Ralf / AdobeStock)
Laut FDA sollen COVID-19-Impfungen seit vergangenem Mittwoch nur noch mit den in den USA neu zugelassenen bivalenten Impfstoffen gegen den SARS-CoV-2-Wildtyp und Omikron BA.4/BA.5 aufgefrischt werden. Jetzt hat auch die EMA bivalente Impfstoffe zur Zulassung empfohlen, die sich jedoch gegen den Wildtyp und BA.1 richten. Die EMA setzt dabei auf Vielfalt und stellt in Aussicht, dass auch bald bivalente Impfstoffe gegen BA.4 und BA.5 zugelassen werden könnten.
Vergangene Woche erregten die Anträge für Notfallzulassungen bei der US-amerikanischen Arzneimittelbehörde FDA für angepasste COVID-19-Impfstoffe viel Aufmerksamkeit. Am Mittwoch hat die FDA dann tatsächlich schon die Notfallzulassung erteilt. Für Deutschland ist das relevant, weil die in den USA zugelassenen bivalenten Impfstoffe sich sowohl gegen den Wildtyp als auch gegen Omikron BA.4/BA.5 richten (die Spike-Proteine von BA.4 und BA.5 sind identisch). Denn schon vergangene Woche war bekannt geworden, dass die EMA am heutigen Donnerstag zwar auch über die Zulassung von bivalenten Corona-Impfstoffen entscheiden würde, allerdings gegen Omikron BA.1 und den Wildtyp gerichtete. Jetzt hat die EMA diese zur Zulassung empfohlen, wie sie selbst mitteilt.
„Comirnaty Original / Omicron BA.1“ und „Spikevax Bivalent Original/Omicron BA.1“ seien für die Impfung von Personen ab zwölf Jahren vorgesehen – wenn bereits mindestens eine Erstimpfung gegen COVID-19 erfolgt ist. Es sollte dabei mindestens ein Abstand von drei Monaten zur vorausgegangenen Impfung eingehalten werden. So soll der Schutz gegen verschiedene Corona-Varianten erweitert werden. Die beobachteten Nebenwirkungen seien mit den Originalimpfstoffen vergleichbar und damit mild und von kurzer Dauer.
Wie ein Sprecher der EU-Kommission der Deutschen Presse-Agentur (dpa) am Donnerstagmittag sagte, werde die Brüsseler Behörde die Entscheidung der EMA sehr schnell annehmen und somit die endgültige Zulassung erteilen. Ob dies noch am selben Tag geschehe, sei aber offen.
Mehr zum Thema

EMA lässt noch vieles offen
Zwei Rolling Reviews für angepasste Corona-Impfstoffe gestartet

EMA und FDA bei COVID-19-Impfstoffen uneinig?
USA: Auch Moderna konzentriert sich auf an BA.4/BA.5 angepassten Corona-Impfstoff

STIKO zu vierter Impfung, Nuvaxovid und PrEP mit Evusheld
Menschen ab 60 sollen nicht auf angepassten COVID-19-Impfstoff warten
Wie die EMA weiter erklärt, verfolgt die EU die Strategie, über eine breite Palette angepasster Impfstoffe gegen verschiedene Corona-Varianten zu verfügen. Die EU-Mitgliedstaaten sollen so bei der Entwicklung ihrer Impfstrategien über eine Vielzahl an Optionen verfügen. Dies sei das Schlüsselelement in der Bekämpfung der Pandemie, weil nicht vorhersehbar sei, wie sich das Virus in Zukunft entwickeln wird und welche Varianten im Winter zirkulieren werden. Dabei verweist die EMA auch auf andere mögliche Varianten und an BA.4/BA.5 angepasste Impfstoffe. Diese prüfe sie bereits oder werde sie in Zukunft prüfen. Die klinischen Daten zur Zulassung von Original/BA.1-Impfstoffen sollen bei zukünftigen Zulassungen unterstützen.
Monovalente Impfstoffe haben nicht ausgedient
In diesem Sinne betont die EMA auch, dass die ursprünglichen Impfstoffe gegen COVID-19 (Comirnaty und Spikevax) nicht ausgedient haben. Diese seien nach wie vor wirksam zur Verhinderung schwerer Verläufe, von Krankenhausaufenthalten und Todesfällen. Insbesondere bei Erstimpfungen sollen sie in der EU weiterhin zum Einsatz kommen. Doch wer wann welchen Impfstoff erhalten soll, erklärt die EMA, müssen die nationalen Behörden entscheiden.
Die Zulassung des BA.1-Impfstoffs ist ein Quantensprung im Kampf gegen die Pandemie. Jetzt können Impfstoffe eingesetzt werden, die gegen alle bisher bekannten Virusvarianten sehr gut wirken. Ab der nächsten Woche können die Impfungen mit den neuen Impfstoffen beginnen. Jetzt ist der optimale Zeitpunkt, Impflücken für den Herbst zu schließen.“
Bundesgesundheitsminister Karl Lauterbach (SPD)
Ihre Zulassungsempfehlung für den Biontech-Impfstoff stützt die EMA auf zwei Studien. Darin sollen in einer mehr als 1.800 Menschen ab einem Alter von 55 Jahren teilgenommen haben, von denen jedoch nur 300 „Comirnaty Original / Omicron BA.1“ in der endgültigen Zusammensetzung erhalten haben sollen. Bei Moderna stützt sich die EMA auf eine Studie mit mehr als 800 Erwachsenen ab 18 Jahren.
Tatsächlich handelt es sich bei der Zulassungsempfehlung der EMA um keine neue, sondern eine Ergänzung der bereits bestehenden bedingten Comirnaty- und Spikevax-Zulassungen. Diese werden künftig also die Verwendung angepasster Impfstoffe beinhalten.
Warum lässt die EMA nicht gleich BA.4/BA.5-Impfstoffe zu?
In Deutschland hat die seit Mitte Juni dominierende Omikron-Sublinie BA.5 andere Varianten fast vollständig verdrängt. Impfstoffe gegen BA.5 erscheinen deshalb nützlicher als gegen BA.1. Doch dass man in den USA angepasste Impfstoffe gegen BA.5 und BA.4 zugelassen hat, liegt daran, dass die Einreichung der Zulassungsanträge dort der Leitlinie der FDA für Impfstoffentwickler folgt. Demnach sollen nicht nur klinische Daten des an die Omikron-Variante BA.1 angepassten bivalenten Impfstoffs in Zulassungsanträge einbezogen werden, sondern auch präklinische Daten und Daten zu Herstellung des an die Omikron-Varianten BA.4/BA.5 angepassten bivalenten Impfstoffs. So soll die fortschreitende Weiterentwicklung von SARS-CoV-2 adressiert werden.
„Eine klinische Studie zur Untersuchung der Sicherheit, Verträglichkeit und Immunogenität des bivalenten, an die Omikron-Varianten BA.4/BA.5 angepassten Impfstoffs bei Personen ab zwölf Jahren soll noch in diesem Monat beginnen“, erklärte Biontech im August dazu. Klinische Daten zu BA.4 und BA.5 fehlen also noch. In einer umfassenden Übersicht über COVID-19-Impfstoffe in der Entwicklung erklärt das „Ärzteblatt“, dass die EMA hingegen bei der Linie bleiben wolle, neue Impfstoffe erst zuzulassen, wenn klinische Daten zu ihrer Wirksamkeit vorliegen.
USA: Auffrischung nur noch mit bivalenten Impfstoffen
Auch in den USA handelt es sich um keine neu erteilten Notfallzulassungen, sondern Anpassungen der bereits bestehenden Zulassungen. Doch es gibt einen weiteren Aspekt, der die Empfehlungen in den USA von denen in Europa unterscheidet: Die monovalenten mRNA-Impfstoffe sollen ausdrücklich nicht mehr für Auffrischungsdosen für Personen ab zwölf Jahren angewendet werden. Der neue bivalente Impfstoff soll in den USA mindestens im Abstand von zwei Monaten verabreicht werden. „Die FDA hat umfangreiche Erfahrungen mit Stammänderungen bei jährlichen Grippeimpfstoffen. Wir sind zuversichtlich, was die Beweise angeht, die diese Zulassungen stützen“, sagte Peter Marks, Direktor des FDA-Zentrums für „Biologics Evaluation and Research“.
Die Ständige Impfkommission (STIKO) in Deutschland hatte erst kürzlich betont, dass Menschen ab 60 Jahren für eine vierte Immunisierung gegen COVID-19 nicht auf angepassten COVID-19-Impfstoff warten sollen. Sobald variantenangepasste Impfstoffe zugelassen und verfügbar sind, werde die STIKO jedoch die Evidenz zur Wirksamkeit und Sicherheit prüfen und eine Empfehlung zum weiteren Vorgehen aussprechen.
























1 Kommentar
Neue Impfstoffe
von Christoph Pasch am 05.09.2022 um 9:56 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.