
- DAZ.online
- News
- Pharmazie
- Erster Migräne-Antikö...
Erenumab in Aimovig
Erster Migräne-Antikörper im deutschen Markt
Stuttgart - 05.11.2018, 14:15 Uhr

Seit 1. November 2018 ist der erste prophylaktische Antikörper gegen Migräne auf dem deutschen Markt: Erenumab in Aimovig. (m / Foto: 9nong / stock.adobe.com)
Für wen eignet sich Erenumab?
Erenumab ist indiziert „zur Migräne-Prophylaxe bei Erwachsenen mit mindestens vier Migränetagen pro Monat“, erklärt die Fachinformation zu Aimovig®. Den humanen Antikörper stellt Novartis den Migränikern als Fertigspritze und als Fertigpen zur Verfügung. Sowohl Fertigspritze als auch Pen enthalten jeweils die gleiche Dosierung, 70 mg Erenumab. Die Patienten erhalten eine Injektion alle vier Wochen mit 70 mg, manche Patienten können jedoch auch von der doppelten Dosierung mit 140 mg Erenumab profitieren. Für diese Patientenklientel hat Novartis allerdings keine höher dosierten Applikationen im Markt, die Patienten erhalten dann jeweils zwei Injektionen.
Die Injektionen erfolgen subkutan und können – nach erfolgter Schulung – auch von den Patienten selbst durchgeführt werden. Die Überprüfung des therapeutischen Erfolges sollte nach drei Monaten erfolgen, und bei Ausbleiben einer Besserung, die Behandlung mit Erenumab überdacht werden.
Mehr zum Thema
Zur Prophylaxe
Migräne-Antikörper Erenumab in der EU zugelassen

Migräne-Prophylaxe
FDA erteilt Migräne-Antikörper Erenumab die Zulassung
Eptinezumab, Fremanezumab und Galcanezumab
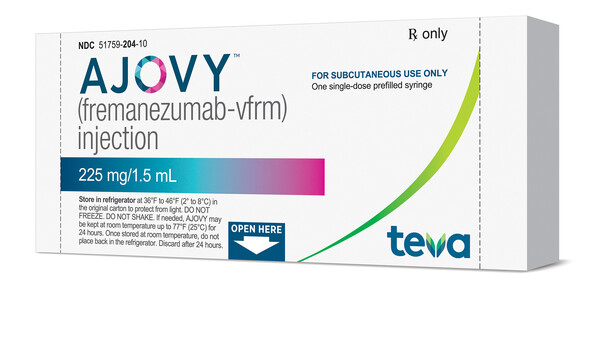
Die Konkurrenz der CGRP-Antikörper schläft nicht, sie sitzt in den Startlöchern oder ist bereits zugelassen. In den Vereinigten Staaten folgten der Zulassung von Erenumab in Aimovig® bereits Fremanezumab (AjovyTM) am 14. September 2018, und nur zwei Wochen später, am 27. September, erteilte die FDA auch Galcanezumab im EmgalitiyTM die Zulassung.
Eptinezumab von Alder Biopharmaceuticals ist der vierte CGRP-Antikörper, allerdings ist dieser bislang weder in den USA noch in Europa zur Zulassung eingereicht. Erst im Januar dieses Jahres konnten sich Alder Biopharmaceutical und Teva bei ihren patentrechtlichen Streitigkeiten einigen.





























1 Kommentar
Migräne
von Beate Lorenz am 29.07.2019 um 17:17 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.