
- DAZ.online
- News
- Pharmazie
- Migräne-Antikörper ...
Trotz Mängeln beim Hersteller
Migräne-Antikörper Fremanezumab erhält nun doch US-Zulassung
Stuttgart - 18.09.2018, 11:30 Uhr
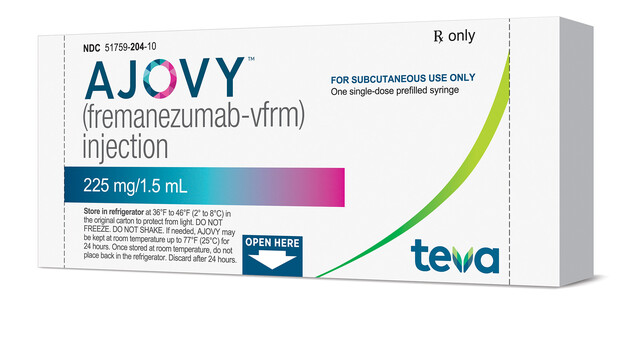
Nach Erenumab wurde in den USA ein weiterer Antikörper zur Migräne-Prophylaxe zugelassen: Fremanezumab unter dem Markennamen Ajovy™. ( r / Foto: Business Wire)
Am vergangenen Freitag gab Teva Pharmaceutical Industries Ltd. bekannt, dass die US-amerikanische Arzneimittelbehörde FDA einen neuen Migräne-Antikörper unter dem Markennamen Ajovy™ zur Prävention von Migräne bei Erwachsenen zugelassen hat. Eine Woche zuvor hatten Börsenbeobachter noch eine erfolgreiche Zulassung angezweifelt. Grund dafür waren Mängel beim koreanischen Wirkstoffhersteller Celltrion.
Laut der Nachrichtenagentur Reuters hatte Teva in den USA schon im Juni 2018 auf die Zulassung ihres Migräne-Antikörpers Ajovy™ durch die US-amerikanische Arzneimittelbehörde FDA gehofft. Die US-Behörde äußerte aber Bedenken im Zusammenhang mit der Produktion des Wirkstoffs in Südkorea. Nun gab Teva in einer Pressemitteilung vom vergangenen Freitag die erfolgreiche US-Zulassung von Fremanezumab bekannt.
Der humanisierte monoklonale Antikörper Fremanezumab-vfrm bindet an CGRP (calcitonin gene-related peptide) und kann vierteljährlich oder monatlich verabreicht werden. CGRP spielt im pathophysiologischen Geschehen der Migräne eine maßgebliche Rolle. Die CGRP-These wird dadurch erhärtet, dass Injektionen des Neuropeptids bei Migränikern Anfälle auslösen können. Ajovy™ ist laut Teva die erste und einzige anti-CGRP-Therapie zur Migräne-Prävention, die vierteljährlich (675 mg) oder monatlich (225 mg) injiziert werden kann. Ebenfalls gegen CGRP gerichtet und in der EU bereits zur Migräneprophylaxe zugelassen ist der Antikörper Erenumab (Aimovig®) von Novartis. Er wird monatlich injiziert.
Mehr zum Thema

Antikörper zur Migräne-Prophylaxe
Fremanezumab bessert chronische Migräne
Zur Prophylaxe
Migräne-Antikörper Erenumab in der EU zugelassen

Migräne-Prophylaxe
FDA erteilt Migräne-Antikörper Erenumab die Zulassung
Teva-Manager zeigten sich eine Woche vor der erfolgreichen FDA-Zulassung zuversichtlich, dass diese auch gelingen würde. Laut dem Nachrichtenportal FiercePharma bestand aber auch durchaus Anlass zur Sorge. Denn es gab wohl Zweifel, dass es tatsächlich zur Zulassung kommen würde. Grund dafür waren Mängel beim Wirkstoffhersteller Celltrion in Südkorea.





























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.