
- DAZ.online
- News
- Pharmazie
- Tildrakizumab bei ...
Zulassung beantragt
Tildrakizumab bei Psoriasis
Barcelona / Stuttgart - 30.03.2017, 17:00 Uhr
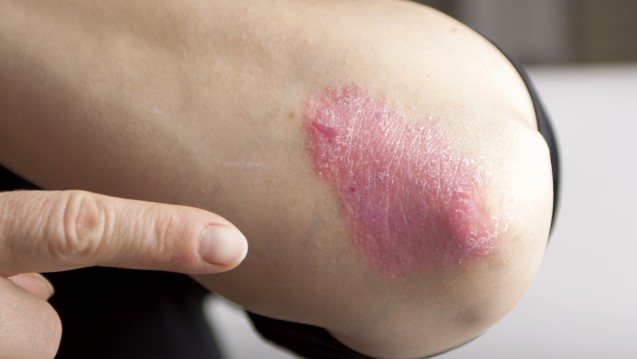
Psoriasis: Klassisch an den Ellbogen finden sich rote, mit weißen Schuppen bedeckte Plaques. (Foto: hriana / Fotolia)
Die Therapieoptionen bei Schuppenflechte steigen – mit ihnen die Unaussprechlichkeit der Wirkstoffe. Seit März gibt es den IL-17A-Antikörper Ixekizumab – Taltz – zur Behandlung der mittelschweren bis schweren Plaque Psoriasis. Nun steht für die gleiche Indikation ein weiterer Antikörper in den Startlöchern: Almirall hat für seinen IL-23-Antikörper Tildrakizumab die Zulassung bei der EMA beantragt.
Tildrakizumab heißt der neue Antikörper, der Patienten mit moderater und schwerer Plaque Psoriasis zukünftig helfen könnte. Nach Abschluss der reSURFACE 1 und 2-Studien mit über 1800 Patienten, hat Almirall ausreichend Daten zur Wirksamkeit und Unbedenklichkeit des Il-23-Antikörpers – und reichte diese nun bei der Europäischen Arzneimittelagentur EMA zur Zulassung ein.
Der humanisierte Antikörper Tildrakizumab richtet sich selektiv gegen die Untereinheit IL-23p19. Interleukin 23 spielt eine bedeutende Rolle im Entzündungsgeschehen der Schuppenflechte.
Nach Ustekinumab, Sekukinumab, Ixekizumab … bald Tildrakizumab?
Tildrakizumab ist nicht der erste Antikörper, der therapeutischen Eingang bei Schuppenflechte finden würde. Allerdings der erste, der sich selektiv gegen das Zytokin IL-23 richtet. Ustekinumab – Stelara® – neutralisiert neben Il-23 auch das Zytokin IL-12. Bereits 2009 brachte Janssen Cilag den Antikörper auf den Markt. Novartis zog 2012 mit Sekukinumab nach. Cosentyx® richtet sich selektiv gegen Il-17A.
Seit 1. März 2017 mischt auch der Bad Homburger Pharmakonzern Lilly mit bei der Antikörper-basierten Therapie der mittelschweren bis schweren Plaque-Psoriasis – und erweiterte mit Ixekizumab – Handelsname Taltz – das Portfolio für Schuppenflechte-Patienten. Wie bereits bei Sekukinumab richtet sich Ixekizumab gegen die Zielstruktur IL-17A.
Biosimilars bei Plaque-Psoriasis
Die ersten Schritte einer Antikörper-Therapie bei Plaque-Psoriasis machten TNFα-Inhibitoren. 2005 gab die EMA grünes Licht für den chimären Antikörper Infliximab in Remicade®. Die Biosimilars Inflectra und Remsima stellen seit 2015 Behandlungsalternativen bei einer Therapie mit Infliximab dar.
2008 folgte Adalimumab (Humira®). Und auch Humira® droht bereits Konkurrenz: Der Humararzneimittelausschuss der EMA kam im Januar 2017 zu einem positiven Votum und hat die Zulassung der beiden Adalimumab-Biosimilars Amgevita und Solymbic – beide aus dem Hause Amgen – empfohlen.
Kein Antikörper, aber ein Biological und TNFα-Hemmer, ist Etanercept. Das Fusionsprotein, sozusagen ein löslicher Rezeptor, in Pfizers Originalpräparat Enbrel® wird seit 2016 mit Benapeli® nachgeahmt.


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.