
- DAZ.online
- News
- Politik
- Kassen müssen Orphan ...
BPI gegen Kassenkritik
Kassen müssen Orphan Drugs nicht fürchten
Berlin - 12.02.2016, 15:30 Uhr

Orphan Drugs sind eine Besonderheit - aber brauchen sie auch eine Sonderbehandlung? (Foto: Sondem/Fotolia)
Orphan Drugs haben es etwas leichter im AMNOG-Verfahren: Bei ihnen gilt der Zusatznutzen bereits durch die Zulassung als belegt. Krankenkassen sehen den Sonderstatus dieser Arzneimittel zunehmend kritisch. Sie werfen den Herstellern vorsätzliche „Orphanisierung“ vor – doch die Industrie hält dagegen.
Sabine Biermann zählt zu den Patientinnen, deren Leben sich durch ein Orphan Drug massiv verändert hat. 15 Jahre vergingen, ehe Ärzte erkannten, unter welcher Erkrankung sie litt: Morbus Gaucher, eine vererbbare Fettspeicherkrankheit, von der in Deutschland rund 300 Menschen betroffen sind. Unter anderem Schmerzen und ein ausgeprägtes Fatigue-Syndrom beeinträchtigten Biermanns Leben in dieser Zeit stark. Sie habe sich gefühlt, wie ein „Akku, der nicht mehr aufgeladen werden kann“. Doch als sie 2005 eine gesicherte Diagnose bekam, stand ihr ein Arzneimittel zur Verfügung, das ihrem Leben eine „99-prozentige Verbesserung“ gebracht hat. Schon nach den ersten drei Infusionen habe sie eine phänomenale Veränderung erlebt. Mithilfe des Arzneimittels kann die Arzthelferin nun wieder arbeiten, das Familienleben genießen und Sport treiben. Abgesehen davon, dass sie alle zwei Wochen eine Infusion einplanen muss, läuft ihr Leben ohne Einschränkungen.
Erfolge schon für die Kleinsten
Auch Professor Annette Grüters-Kieslich, die am Centrum für seltene Erkrankungen an der Berliner Charité aktiv ist, ist eine große Fürsprecherin der Orphan Drugs. An die 8000 seltene Erkrankungen kenne man derzeit. Angesicht der sich stetig verbessernden Diagnostik werde man immer mehr entschlüsseln können – und auch Arzneimittel finden, die gegen sie helfen. Ihr Schlüsselerlebnis hatte sie als Ärztin, als sie an der Entwicklung des Bluttests für Neugeborene beteiligt war, mit dem eine angeborene Schilddrüsenunterfunktion zu erkennen ist. Unbehandelt führt die Hypothyreose zum Kretinismus. Doch es war möglich für diese Unterfunktion – die bei einem von etwas mehr als 3000 Säuglingen vorkommt – ein Arzneimittel zu finden, so dass sie heute leicht behandelbar ist. Und Grüters-Kieslich kann noch einige Beispiele mehr für Arzneimittel gegen seltene Erkrankungen aufführen, die für die oft noch jungen Patienten ein Segen sind. 80 Prozent der seltenen Erkrankungen seien schon im Kindesalter symptomatisch, so die Ärztin. Damit sie besser erkannt und behandelt werden können, plädiert sie für eine gemeinsame Strategie der Mediziner und der Industrie.
Der Fall Biermann und die Erfahrungen der Charité-Ärztin zeigen, wie wichtig Orphan Drugs sein können. Doch seit einiger Zeit regt sich Kritik am besonderen Status der Orphan Drugs. Der Bundesverband der Pharmazeutischen Industrie (BPI) sieht sich daher immer wieder zur „Richtigstellung“ veranlasst. Am Donnerstag trat Hauptgeschäftsführer Norbert Gerbsch gemeinsam mit Biermann und Grüter-Kieslich vor die Presse.
Kassen beklagen zu wenig Patientensicherheit und Pharma-Tricks
Anlass gab nicht zuletzt die jüngste Forderung des GKV-Spitzenverbands, der Gemeinsame Bundesausschuss solle in begründeten Einzelfällen auch bei Orphan Drugs das Nutzen- und Schadenspotenzial vollständig prüfen dürfen. Denn der Zusatznutzen der Orphan Drugs lasse allzu oft zu wünschen übrig. Die Anforderungen im Zulassungsverfahren seien schon zu niedrig – es zeige sich oft erst bei der Anwendung, wenn das Arzneimittel schwere Nebenwirkungen mit sich bringe.
Auch die G-BA-Statistik spreche eine deutliche Sprache: Für
knapp die Hälfte der Patientengruppen (47 Prozent) sei bei Arzneimitteln
gegen seltene Krankheiten ein „nicht quantifizierbarer“ Zusatznutzen festgestellt worden.
Das bedeutet in der Lesart des GKV-Spitzenverbandes: Die wissenschaftliche
Datenbasis ist nicht ausreichend, um das Ausmaß des Zusatznutzens zu
beurteilen.
Immer wieder wird den Unternehmen auch vorgehalten, eine Slicing-Methode zu verfolgen: Erst bekommen sie eine Orphan-Drug Zulassung für eine Indikation, dann folgen nach und nach weitere – ebenfalls seltene – Anwendungsgebiete. Es gibt tatsächlich Arzneimittel, bei denen dies so war – sie sind jedoch die Ausnahme. Das Leukämie-Arzneimittel Glivec (Imatinib), das mittlerweile gegen eine Vielzahl weiterer maligner Erkrankungen zum Einsatz kommt, wird von Kritikern stets als Paradebeispiel angeführt. Doch das hat mittlerweile gar keinen Orphan Drug Status mehr – der Hersteller Novartis hat selbst auf diesen verzichtet.
Besondere Regelungen für Orphan Drugs
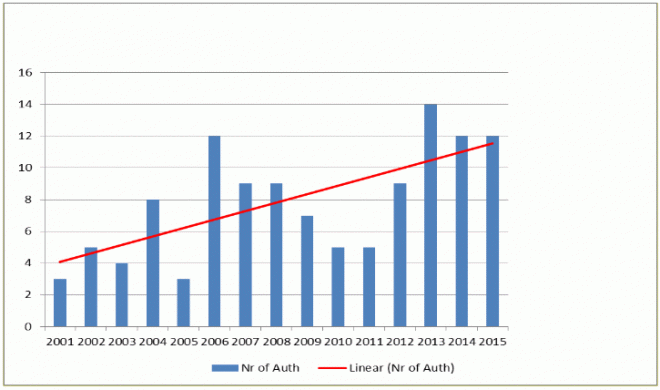
Dabei hatte alles so gut angefangen: Arzneimittel gegen seltene Erkrankungen, die „Waisenkinder" der Medizin, waren lange Zeit selbst eine Seltenheit. Kein Unternehmen riss sich darum, viel Geld in Forschung und Entwicklung zu stecken und mühsam Probanden für klinische Studien zu rekrutieren, wenn am Ende nur ein paar Hundert Patienten für das Präparat in Frage kommen. Das hatte man in Europa erkannt und im Jahr 2000 eine Verordnung zu Orphan Drugs in Kraft gesetzt. Seitdem – also in den letzten 15 Jahren – haben 117 Arzneimittel diese besondere Zulassung erhalten.
Die Verordnung macht die Entwicklung dieser Arzneimittel damit schmackhaft, dass Gebühren reduziert, Hilfestellungen im Zulassungsverfahren und eine zehnjährige Marktexklusivität geboten werden. Letzteres heißt: Zehn Jahre lang wird keine Zulassung für ein ähnliches Medikament mit dem gleichen Anwendungsgebiet erteilt.
Auch in der frühen Nutzenbewertung, die jedes neue Arzneimittel seit 2011 durchlaufen muss, haben Orphan Drugs einen Sonderstatus: Zwar müssen die Hersteller auch für sie ein umfangreiches Dossier vorlegen – ein prinzipieller Zusatznutzen kann den Präparaten aber nicht abgesprochen werden. Der Gemeinsame Bundesausschuss entscheidet nicht, ob es diesen gibt oder nicht – er gilt qua Gesetz als mit der Zulassung belegt. Der AMNOG-Beschluss befindet lediglich über das Ausmaß dieses unterstellten Zusatznutzens. Der ist dann die Grundlage für anschließende Verhandlungen über den Erstattungsbetrag.
Anders verhält es erst ab dem Moment, in dem das Arzneimittel einen GKV-Jahresumsatz von mehr als 50 Millionen Euro macht – dann muss sich auch ein Orphan Drug der kompletten AMNOG-Bewertung unterziehen. Bislang ist dies drei Präparaten widerfahren: Jakavi® (Ruxolitini), Imnovid® (Pomalidomid) und Imbruvica® (Ibrutinib).
BPI: Studien sind Herausforderung für Hersteller
Dass Krankenkassen mittlerweile lautstark um Patienten bangen und Herstellern taktisches Vorgehen vorwerfen, kann der stellvertretende BPI-Hauptgeschäftsführer Norbert Gerbsch nicht nachvollziehen. Sie sollten sich besser freuen über die neuen Therapiemöglichkeiten. Gerbsch rechtfertigt die besonderen europäischen und deutschen Regelungen für Orphan Drugs: „Der gesetzte Rahmen ist adäquat“. Die Industrie brauche verlässliche Rahmenbedingungen.
Er wies die Kritik zurück, die Zulassungsanforderungen für Orphan Drugs seien zu lasch. Man dürfe nicht übersehen, dass Orphan Drugs weiterhin eine Herausforderung für die Hersteller bleiben. Angesichts der geringen Patientenzahlen müssten die Studien multizentrisch und international laufen. Zudem: Die Anforderungen an eine Orphan-Drug-Zulassung seien klar und bestimmt. Die Kriterien würden von der Euorpäischen Arzneimittelagentur mehrfach geprüft: bei der Beantragung, bei der Zulassung und fünf Jahre später. Und: Auch Orphan Drugs würden in der EU nur dann zugelassen, wenn der Nutzen für den Patienten mögliche Risiken überwiege.
Auch den Slicing-Vorwurf lässt Gerbsch nicht gelten. Es könne sein, dass ein Arzneimittel, das gegen eine seltene Krebserkrankung zugelassen ist, sich später auch gegen andere Krebserkrankungen als wirksam erweist. Aber für jede neue Indikation müsse der Hersteller auch neue klinische Studien durchführen. Der Aufwand für den Beleg der Wirksamkeit ist für jede neue Indikation immer wieder der Gleiche – lediglich hinsichtlich der Frage, ob das Arzneimittel sicher in der Anwendung ist, könne auf die Vorerfahrungen zurückgegriffen werden, so der BPI.
Kosten können nicht unermesslich wachsen
Finanziell müssen die Kassen aus BPI-Sicht durch Orphan Drugs ebenfalls nichts fürchten. So mögen zwar hochpreisig sein – aber sie kämen stets nur für wenige Patienten in Frage, sodass ein unermessliches Wachsen der Kosten nicht zu erwarten sei. Zudem: Nach zehn Jahren Marktexklusivität könne Konkurrenz kommen. Auch Grüters-Kieslich ist überzeugt: „Es findet keine Orphanisierung im falschen Sinne statt, die das System an die Wand fährt“.



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.