
- DAZ.online
- DAZ / AZ
- DAZ 47/2022
- Mit Faricimab dual gegen ...
Arzneimittel und Therapie
Mit Faricimab dual gegen Makula-Erkrankungen
Neuer Antikörper lässt auf seltenere Injektionen hoffen
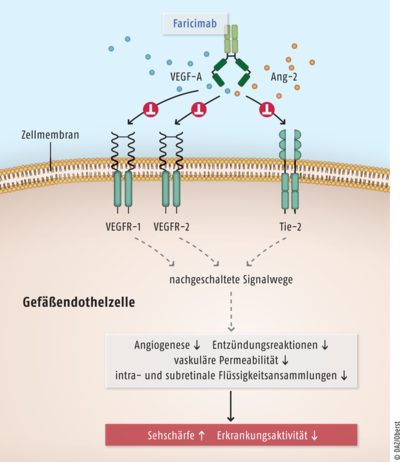
Faricimab ist ein humanisierter bispezifischer Immunglobulin-G1(IgG1)-Antikörper, der gleichzeitig zwei unterschiedliche Signalwege hemmt. Zum einen richtet er sich, wie beispielsweise auch Aflibercept (Eylea®) und Ranibizumab (z. B. Lucentis®), gegen den vaskulären endothelialen Wachstumsfaktor A (VEGF-A). Außerdem neutralisiert er den Wachstumsfaktor Angiopoietin-2 (Ang-2). VEGF-A und Ang-2 sind bei Patienten mit neovaskulärer altersabhängiger Makuladegeneration (nAMD) und diabetischem Makulaödem (DMÖ) in erhöhten Konzentrationen vorhanden. Sie stimulieren die pathologische Neovaskularisation in der Netzhaut und erhöhen synergistisch die Gefäßpermeabilität. Dadurch kommt es zu vaskulären Leckagen, Entzündungen und Flüssigkeitsansammlungen. Durch die duale Hemmung von VEGF- und Ang-2 reduziert Faricimab die Gefäßpermeabilität, hemmt Entzündungen und Gefäßneubildungen und stabilisiert die Blutgefäße. Dadurch kann das Fortschreiten der beiden Erkrankungen behindert und die Sehkraft beibehalten oder wieder verbessert werden (s. Abb.).
Abb.: Der bispezifische Antikörper Faricimab ist sowohl gegen den vaskulären endothelialen Wachstumsfaktor A (VEGF-A) als auch gegen Angiopoietin-2 (Ang-2) gerichtet. Die Substanz verhindert somit die Interaktion von VEGF-A mit dessen Rezeptoren VEGFR-1 bzw. VEGFR-2 und die Wechselwirkungen von Ang-2 mit dem zugehörigen Tyrosin-Proteinkinase-Rezeptor Tie-2. Als Folge werden bei Patienten mit neovaskulärer altersabhängiger Makuladegeneration oder diabetischem Makulaödem die pathologische Angiogenese, Entzündungsreaktionen, die vaskuläre Permeabilität und damit die intra- bzw. subretinalen Flüssigkeitsansammlungen vermindert. Auf diese Weise ist es möglich, eine Zunahme der Sehschärfe sowie eine Abnahme der Erkrankungsaktivität zu erreichen.
Wirksam wie Aflibercept
Zu Behandlungsbeginn werden die ersten vier Dosen Faricimab 6 mg alle vier Wochen intravitreal injiziert (Upload-Phase). Anschließend passt der Arzt die Therapie je nach Krankheitsaktivität individuell an. Bei Patienten mit neovaskulärer altersabhängiger Makuladegeneration kann Faricimab alle 16 Wochen appliziert werden, wenn keine Krankheitsaktivität vorliegt. Ansonsten ist eine Behandlung alle acht oder zwölf Wochen zu erwägen. Bei Patienten mit diabetischem Makulaödem geht man nach dem Treat-and-Extend-Schema vor. Dabei wird das Dosierungsintervall in Schritten von bis zu vier Wochen auf bis zu 16 Wochen verlängert und bei einer Verschlechterung entsprechend verkürzt. Diese Dosierungsschemata wurden auf Basis der Ergebnisse von vier Nichtunterlegenheits-Studien der Phase III entwickelt, von denen zwei mit nAMD-Patienten (n = 1329) und zwei mit DMÖ-Patienten (n = 1891) durchgeführt worden waren. In den beiden nAMD-Studien war die Gabe von Faricimab alle 16 Wochen mindestens genauso wirksam wie Aflibercept 2 mg, verabreicht alle acht Wochen. Nach einjähriger Behandlung verbesserte sich bei den nAMD-Patienten unter Faricimab die Anzahl der erkennbaren Buchstaben in einem standardisierten Sehtest um 5,8 und 6,6, unter Aflibercept um 5,1 und 6,6. In den beiden Studien mit DMÖ-Patienten war die Behandlung mit Faricimab der Behandlung mit Aflibercept ebenfalls nicht unterlegen. Beim diabetischen Makulaödem spielt die zentrale Netzhautdicke eine besondere Rolle für die Krankheitsaktivität. Sie ging in den DMÖ-Studien nach Behandlungsbeginn zurück, der Effekt hielt über den gesamten Untersuchungszeitraum von zwei Jahren an.
Grundsätzlich ist Faricimab für die Langzeitbehandlung bestimmt, es sei denn, visuelle oder anatomische Befunde deuten darauf hin, dass der Patient von der Therapie nicht mehr profitiert. Dann ist die Behandlung zu beenden. Als Protein wird der Antikörper wahrscheinlich in Lysosomen zu Peptiden und Aminosäuren abgebaut und analog zu endogenem Immunglobulin G über die Nieren ausgeschieden.
Zu Risiken und Nebenwirkungen
Injektionen in den Glaskörper des Auges bergen verschiedene Risiken, darunter ein hohes Infektionsrisiko. Deshalb müssen sie unter streng aseptischen Bedingungen erfolgen. Außerdem kann es innerhalb von einer Stunde nach intravitrealer Injektion zur vorübergehenden Erhöhung des Augeninnendrucks kommen. Deshalb ist bei Patienten mit ungenügend eingestelltem Glaukom besondere Vorsicht geboten. Neben einer Erhöhung des Augeninnendrucks (4%) waren häufige Nebenwirkungen unter Faricimab in den klinischen Untersuchungen Katarakt (11%), Bindehautblutungen (7%), Mouches volantes bzw. Glaskörpertrübungen (4%), Augenschmerzen (3%) und nur bei nAMD-Patienten auch Einrisse des retinalen Pigmentepithels (3%). Verschiedene schwerwiegende Nebenwirkungen wie Uveitis (0,5%), Vitritis (0,3%), Endophthalmitis (0,3%) und Netzhauteinriss (0,2%) traten gelegentlich auf, rhegmatogene Netzhautablösungen waren selten (< 0,1%). Fälle von retinaler Vaskulitis oder okklusiver retinaler Vaskulitis wurden nicht beobachtet.
Überwachung und mögliche neue Indikation
Vabysmo® ist ein Arzneimittel, das bei der Europäischen Arzneimittel-Agentur einer zusätzlichen Überwachung unterliegt. Die Fachinformation enthält neben dem Präparatenamen ein auf der Spitze stehendes schwarzes Dreieck. Patienten und Angehörige der Gesundheitsberufe sind angehalten, jeden Verdacht auf eine Nebenwirkung zu melden. Der Hersteller des Präparats sammelt für die Indikationen neovaskuläre altersabhängige Makuladegeneration und diabetisches Makulaödem in zwei unverblindeten Langzeit-Verlängerungsstudien über weitere zwei Jahre neue Sicherheitsdaten. Außerdem wird Faricimab derzeit in einer weiteren Indikation, dem Makulaödem aufgrund eines Zentralvenenverschlusses (ZVV) oder Venenastverschlusses (VAV) der Netzhaut, untersucht. Kürzlich erreichten zwei Phase-III-Studien mit mehr als 1280 Patienten ihren primären Endpunkt, der als Nichtunterlegenheit gegenüber Aflibercept definiert war [3].
Patienten und Angehörige könnten entlastet werden
Nach einer intravitrealen Injektion können vorübergehend Sehstörungen wie verschwommenes Sehen auftreten. Für die Wahrnehmung der Injektionstermine sind Patienten deshalb auf Begleitung angewiesen. Damit verbundene organisatorische Schwierigkeiten sowie die Tatsache, dass Komorbiditäten in dieser Altersgruppe häufig weitere Termine bei anderen Fachärzten notwendig machen, können die Adhärenz beeinträchtigen. Wünschenswert sind deshalb möglichst lange Intervalle zwischen den Behandlungen. „Faricimab hat das Potenzial, die Therapielast – basierend auf der individuellen Krankheitsaktivität der Patienten – ab dem zweiten Jahr auf bis zu drei Spritzen pro Jahr zu reduzieren, so dass Patienten und ihre Angehörigen deutlich entlastet werden“, erklärte Prof. Dr. med. Nicolas Feltgen, Universitätsmedizin Göttingen, auf einer von der Roche Pharma AG am 19. Oktober 2022 veranstalteten virtuellen Pressekonferenz anlässlich der Zulassung von Faricimab (Vabysmo®). |
Literatur
[1] Fachinformation Vabysmo® 120 mg/ml Injektionslösung, Stand September 2022
[2] Vabysmo: EPAR – Product Information, Stand 15. Oktober 2022, https://www.ema.europa.eu/en/medicines/human/EPAR/vabysmo, Abruf am 9.11.2022
[3] Positive Phase-III-Studien belegen verbessertes Sehvermögen durch Vabysmo® bei retinalem Venenverschluss. Medienmitteilung der Roche Pharma AG vom 14. November 2022
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.