
- DAZ.online
- DAZ / AZ
- DAZ 22/2022
- Optionen gegen ...
Arzneimittel und Therapie
Optionen gegen Clostridioides difficile
Rückblick, Status quo und Perspektiven im Umfeld der aktualisierten ESCMID-Leitlinien
Clostridioides difficile zählt zu den Sporen-bildenden gram-positiven anaeroben Bakterien. Der Erreger zeichnet sich durch die Bildung der Exotoxine Clostridiumtoxin A und B aus, die beide die Schleimhaut des Gastrointestinaltrakts nachhaltig schädigen können. Besteht im Rahmen einer Diarrhoe der Verdacht auf eine Clostridioides-difficile-Infektion als Ursache, so wird in der Stuhlprobe zunächst geprüft, ob eine Aktivität der Glutamat-Dehydrogenase (GDH-Aktivität) nachweisbar ist. Dieser Test ist hoch sensitiv, das heißt, ist er negativ, kann eine Clostridioides-difficile-Infektion als Ursache weitgehend ausgeschlossen werden. Im Falle eines positiven Nachweises erfolgt anschließend die ELISA-basierte Prüfung auf Clostridien-Toxin. Ist es epidemiologisch von Interesse, den Genotyp (z. B. Ribotyp 027) zu erfassen, erfolgt eine weitergehende molekularbiologische Untersuchung mittels PCR [3, 12].
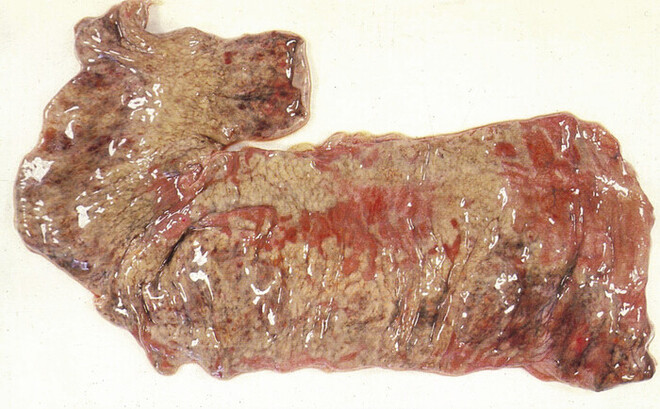
Abb. 1: Darmabschnitt mit ausgeprägter, pseudomembranöser Enterokolitis als Folge eines schweren Verlaufs einer Clostridioides-difficile-Infektion
Zu den wichtigsten, pharmakotherapeutisch bedingten Risikofaktoren für die Entstehung einer Clostridioides-difficile-Infektion zählen neben einer Vorbehandlung mit bestimmten Antibiotika auch länger andauernde Vortherapien mit Protonenpumpen-Inhibitoren. Die Übertragung der Clostridien-Sporen erfolgt fäkal-oral (Schmierinfektion). Die Auskeimung der Sporen im Dünn- und Dickdarm wird vor allem dann erleichtert, wenn gleichzeitig weniger inhibitorisch wirksame, sekundäre Gallensäuren vorliegen, wie es sehr häufig bei einer Dysbiose der Mikrobiota (Darmflora) der Fall ist [8, 12].
Liegt ein positiver Nachweis von Clostridien-Toxin im Stuhl vor und treten Symptome wie wässrige, übel riechende Durchfälle und abdominelle Schmerzen auf, wird zunächst eine gegen den Erreger zielgerichtet wirksame orale Therapie eingeleitet (Tab. 1).
Initialtherapie | 1. Rezidiv | 2. Rezidiv | |
|---|---|---|---|
Standardtherapie (Standard of Care, SoC) | Fidaxomicin p. o. zweimal täglich 200 mg Tag 1 bis 10 | Standardtherapie plus Bezlotoxumab | fäkale Mikrobiota-Transplantation |
Vancomycin p. o. viermal täglich 125 mg Tag 1 bis 10 | Fidaxomicin* zweimal täglich 200 mg Tag 1 bis 10 | Standardtherapie + Bezlotoxumab | |
hohes Rezidivrisiko* | Fidaxomicin p. o.* zweimal täglich 200 mg Tag 1 bis 10 | ||
Standardtherapie plus Bezlotoxumab | |||
wenn vorgeschlagene Optionen nicht verfügbar sind | Metronidazol p. o. dreimal täglich 500 mg Tag 1 bis 10 | Vancomycin p. o. Taper & Pulse: sukzessive, auf eine Gabe alle 72 Stunden sich „zuspitzende“ Therapie | |
schwere CDI | Vancomycin oder Fidaxomicin p. o. falls orale Anwendung nicht möglich: rektale oder duodenale Instillation eine zusätzliche Anwendung von Tigecyclin i. v. oder Metronidazol i. v. ist möglich | ||
schwere CDI mit Komplikationen und refraktäre schwere CDI | Vancomycin oder Fidaxomicin p. o. multidisziplinärer Ansatz mit chirurgischem Konzil bei refraktärer CDI: Tigecyclin i. v. bzw. fäkale Mikrobiota-Transplantation | ||
Während noch bis vor wenigen Jahren Metronidazol p. o. in verschiedenen Leitlinien als Mittel der ersten Wahl aufgeführt wurde, ist das Nitroimidazol-Derivat in den vor Kurzem veröffentlichten, überarbeiteten Leitlinien der European Society of Clinical Microbiology and Infectious Diseases (ESCMID) nicht mehr als Standardtherapeutikum bei CDI zu finden (Tab. 1). Abgelöst wurde es durch das oral anwendbare Vancomycin bzw. makrocyclische Lacton Fidaxomicin [27].
Besonders kritisch sind schwere Verläufe zu sehen, wenn die Clostridioides-difficile-assoziierten Diarrhoen (CDAD) Dehydrationen, akutes Nierenversagen und Elektrolytentgleisungen provozieren und sich eine fulminante Kolitis entwickelt, die im ungünstigsten Fall zu einer pseudomembranösen Enterokolitis (Abb. 1), zu einem toxischen Megakolon, einer Darmperforation und einer Sepsis führt. Fieber > 38,5 °C, Leukozytosen > 15.000/µl, Serumkreatinin > 1,5 mg/dl und Erhöhung der Lactat-Werte > 5 mM sind in diesem Zusammenhang kritische Prädiktoren für einen sich abzeichnenden, schweren Verlauf der Erkrankung. Besteht das Risiko für eine drohende Darmperforation, ist die sofortige Einbindung des Chirurgen zwingend erforderlich, wenn sich die Indikation für eine Kolektomie stellt [12, 17]. Etwa 30% der behandelten CDI-Patienten entwickeln trotz erfolgreicher Primärtherapie ein Rezidiv innerhalb von zwei bis acht Wochen nach Ende der Behandlung [5, 8]. Neben den bereits beschriebenen Risikofaktoren (s. Kasten „Risikofaktoren“) wurden auch die Stuhl-Kolonisation mit Vancomycin-resistenten Enterokokken und niedrige Hämoglobin-Werte als relevante Risikofaktoren identifiziert. Darüber hinaus sind hypervirulente Stämme bekannt (z. B. NAP1/BI/027), die nicht nur zu schweren Symptomen führen, sondern auch mit einer hohen Rezidivrate verbunden sind [25]. Auch Ribotypen wie 078 oder 017 sind in diesem Zusammenhang kritisch zu sehen.
Risikofaktoren
Risikofaktoren für die Entstehung einer Clostridioides-difficile-assoziierten Diarrhoe (CDAD):
- vorangegangene oder laufende Antibiotika-Therapien mit z. B. Clindamycin, Moxifloxacin, Ceftriaxon
- Lebensalter ≥ 65 Jahre
- Immunsuppression bzw. Defizienz der spezifischen Immunabwehr
- längerfristige medikamentöse Hemmung der Magensäuresekretion (z. B. durch Protonenpumpen-Inhibitoren, PPI)
- schwere Grunderkrankung (hohe Morbidität)
- längerer stationärer Aufenthalt
CDI-wirksame Therapeutika
In den letzten zehn Jahren wurden in einem Atemzug auf die Frage, welche Antibiotika setzen Sie bei Clostridioides-difficile-Infektionen ein, die Wirkstoffe Metronidazol, Vancomycin (und Teicoplanin) und Fidaxomicin genannt. Im Off-Label-Use tauchen gelegentlich auch die Wirkstoffe Fusidinsäure, Bacitracin, Nitazoxanid und Rifaximin auf. Einige Zentren setzen bei Rezidiven auch den monoklonalen Antikörper Bezlotoxumab (Zinplava®) ein. Im Folgenden sollen diese Wirkstoffe kurz näher charakterisiert werden. Zur Beurteilung der klinischen Wirksamkeit wird inzwischen durchgängig die Heilungsrate wie folgt definiert: Die Beseitigung der Diarrhoen (das heißt ≤ drei ungeformte Stühle [UBM] pro Tag an zwei aufeinanderfolgenden Tagen) und kein Bedarf für eine weitere Therapie nach Abschluss der Behandlung. Ein Rezidiv tritt definitionsgemäß dann auf, wenn die Zahl der ungeformten Stühle über drei pro Tag liegt, ein Toxin-Nachweis im Stuhl positiv ist und sich ein Bedarf für eine erneute Behandlung ergibt [6].
Glykopeptide
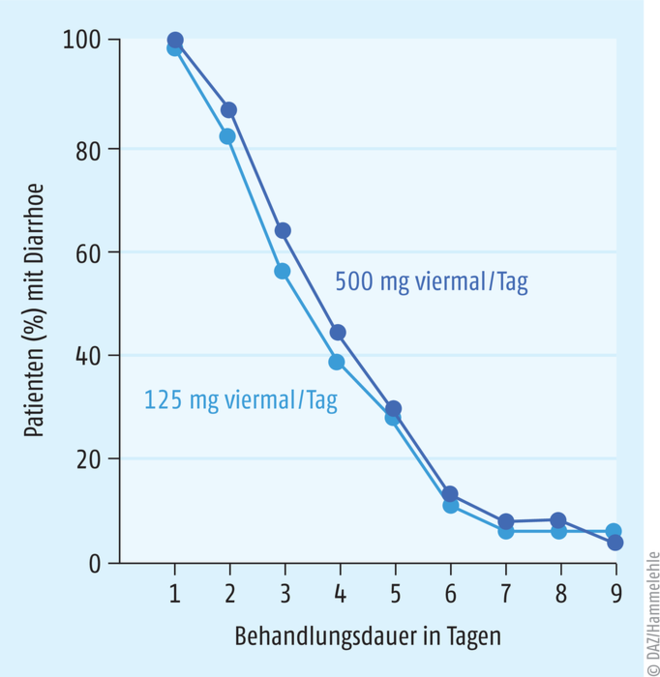
Das Glykopeptid Vancomycin war bis vor Kurzem das unangefochtene Standardtherapeutikum bei Clostridioides-difficile-Infektionen. Es wird in diesem Zusammenhang in einer Dosis von viermal täglich 125 mg p. o. eingesetzt, nachdem in einer Vergleichsstudie gezeigt werden konnte, dass zur Behandlung von Clostridioides-difficile-Infektionen eine Dosis von viermal 500 mg p. o. keine Vorteile bietet (Abb. 2) [14]. Alternativ kann auch das strukturverwandte Glykopeptid Teicoplanin in einer Dosis von zweimal täglich zweimal (100 bis) 200 mg p. o. eingesetzt werden [7]. Beide Wirkstoffe hemmen die Zellwand-Biosynthese der Bakterien, wirken sekundär bakterizid und werden praktisch nicht nennenswert nach oraler Gabe absorbiert. Die Standarddosis wird über zehn Tage verabreicht und entweder als Kapsel oder in flüssiger Form (z. B. im Fall einer Sonde) oral appliziert [11]. In der Literatur finden sich immer wieder auch Dosierungsempfehlungen von viermal täglich 500 mg p. o. – insbesondere im Rahmen einer allogenen Stammzelltransplantation – dabei geht es allerdings in der Regel nicht um eine Behandlung der Clostridioides-difficile-Infektion, sondern um das Ziel, einer kritischen Kolonisierung von Enterokokken im Darm entgegenzuwirken [5, 10]. In besonderen Fällen einer CDI-Behandlung, wenn eine orale Applikation nicht möglich ist, besteht auch die Option, das Glykopeptid Vancomycin rektal zu verabreichen (z. B. 500 mg Vancomycin als rektaler Einlauf in 100-ml-Volumen, alle sechs Stunden) [13]. Ein vom Standardverfahren abweichendes Therapieregime ist das Vancomycin Tapering-Regime (s. Tab. 1), bei dem z.B. zunächst über 10 bis 14 Tage die Standarddosis gegeben wird, worauf sukzessive die Dosierung über einen längeren Zeitraum „zugespitzt“ wird, das heißt, es werden in den folgenden sieben Tagen zweimal täglich 125 mg p. o. verabreicht. Darauf folgen sieben Tage mit einmal täglich 125 mg p. o., dann sieben Tage mit 125 mg Vancomycin p. o., alle 48 Stunden, und schließlich in den darauffolgenden sieben Tagen Vancomycin 125 mg p. o., alle 72 Stunden. Dieses Tapering-Regime ist vor allem den Fällen vorbehalten, wenn die Therapieoptionen der ersten Wahl beim ersten oder zweiten Rezidiv nicht verfügbar sein sollten (s. Tab. 1) [27]. Nachteilig ist und bleibt beim Vancomycin p. o. die Veränderung der Mikrobiota (Darmflora) unter der Therapie, in dem Stämme wie z. B. Enterococcus gallinarum bzw. E. casseliflavus, Pediococcus spp., Klebsiella spp. und Enterobacter spp. innerhalb weniger Tage zunehmend die Darmflora überwuchern [5, 10].
Abb. 2: Es konnte kein klinisch relevanter Unterschied zwischen Vancomycin viermal täglich 125 mg p. o. und viermal täglich 500 mg p. o. bezogen auf den Behandlungserfolg bei Clostridioides-difficile-Infektionen in der Vergleichsstudie von Fekety et al. beobachtet werden (modifiziert nach [14]).
Metronidazol
Das Nitroimidazol-Derivat Metronidazol war über viele Jahre Mittel der ersten Wahl zur Behandlung einer Clostridioides-difficile-Infektion, nachdem randomisierte Studien keinen signifikanten Unterschied in den Heilungs- und Rezidivraten zwischen Metronidazol p. o. und Vancomycin p. o. herausarbeiten konnten. Lange begünstigt wurde die Erstlinien-Therapie mit Metronidazol durch seine deutlich geringeren Tagestherapiekosten und das geringe Risiko für eine Kolonisation von Vancomycin-resistenten Enterokokken im Darm. Metronidazol ist ein Hemmstoff der Nukleinsäure-Synthese bei Anaerobiern und wirkt bakterizid. Im Gegensatz zu den Glykopeptiden wird es nach oraler Gabe recht gut aus dem Gastrointestinaltrakt absorbiert. Seine Halbwertszeit liegt bei ca. sieben Stunden. Seine Ausscheidung erfolgt vorwiegend renal, sowohl in unveränderter Form als auch als Metaboliten, wobei Hydroxy-Metronidazol ebenfalls antibakteriell wirksam gegen Clostridien ist. Die Ausscheidung über die Galle beträgt allerdings nur ca. 10%.
Dass Metronidazol inzwischen kaum mehr eine Rolle in der Behandlung von Clostridioides-difficile-Infektionen spielt, hat vor allem mit Ergebnissen von größeren Vergleichsstudien in den letzten 15 Jahren zu tun, die zeigten, dass Metronidazol im Vergleich zu Vancomycin p. o. zu signifikant geringeren Heilungsraten bei Patienten mit Clostridioides-difficile-Infektionen führt (84% vs. 97%, p = 0,006), wobei der Unterschied bei Patienten mit schwerer CDAD noch ausgeprägter war (76% vs. 97%). Weitergehende multizentrische Studien bestätigten diese Beobachtung [4, 24].
Die ESCMID hat in ihren aktualisierten Leitlinien deshalb Metronidazol nur noch einen Platz bei der CDI-Behandlung eingeräumt, wenn andere Erstlinien-Therapien nicht verfügbar sein sollten, mit einer Therapiedauer von 10 bis 14 Tagen [27]! Bei schweren Fällen einer Clostridioides-difficile-Infektion findet sich zwar noch der Hinweis, zusätzlich Metronidazol intravenös zu geben, allerdings ist man inzwischen von dieser Empfehlung weitgehend abgekommen, da man mit Tigecyclin i. v. einen Wirkstoff zur Hand hat, der deutliche pharmakokinetische Vorteile bei schweren CDI-Verläufen bietet [2].
Fidaxomicin
Fidaxomicin (Dificlir®) ist ein makrozyklisches Lacton (Makrocyclin) mit einem Molekulargewicht von 1058 g/mol, das ursprünglich als Fermentationsprodukt aus Actinoplanes deccanensis gewonnen wurde. Es wird bei niedrigen pH-Werten oder durch Hydrolasen in OP-1118 umgewandelt, das etwa acht- bis 16-fach schwächer bakterizid wirkt als Fidaxomicin. Sein bakterizider Wirkungsmechanismus beruht auf einer Hemmung der RNA-Synthese, in dem die DNA-abhängige RNA-Polymerase inhibiert wird. Sein Wirkspektrum ist eng und umfasst vor allem C. difficile und C. perfringens. Der MHK90-Wert liegt bei ca. 0,25 µg/ml und ist somit etwa 20-fach niedriger als es für eine Hemmung von Escherichia-coli-Kulturen erforderlich wäre. Darüber hinaus werden in seinem Wirkspektrum auch Enterokokken und Staphylokokken erfasst. Die Dauer des postantibiotischen Effekts liegt zwischen 5,5 und 12,5 Stunden.
Es sind – wenn überhaupt – nur sehr niedrige Plasmakonzentrationen an Fidaxomicin nach Gabe einer oralen Standarddosis von 200 mg zu erwarten. So lagen die Konzentrationen an Fidaxomicin und seinem Metaboliten OP-1118 nach einer Einzeldosis von 200 mg p. o. bei ca. 0,013 µg/ml bzw. 0,06 µg/ml im Plasma, während sie fäkal bei 3,2 µg/ml bzw. 2,5 µg/ml lagen. Eine Angabe zur absoluten Bioverfügbarkeit ist deshalb kaum möglich. Beide, Fidaxomicin und OP-1118, sind Substrate des P-Glykoproteins (ABCB1), was die beobachtete, geringe absolute Bioverfügbarkeit erklären kann. Etwa 92% der verabreichten Dosis werden in den Fäzes wiedergefunden, während die Elimination über die Nieren vernachlässigbar gering ist (< 1%). Die Halbwertszeit im Plasma beträgt ca. acht bis zehn Stunden [1, 20].
Ähnlich wie beim Vancomycin finden sich auch beim Fidaxomicin Empfehlungen hin zu einem Extended-Pulse-Regime. In diesem Zusammenhang wird die Dauer der Standardtherapie von zehn Tage zweimal täglich 200 mg p. o. zunächst auf fünf Tage zweimal täglich 200 mg p. o. verkürzt, worauf sich eine Dosis von einmal 200 mg p. o. alle 48 Stunden über sieben (bis 25) Tage anschließt. Mit diesem Puls-Regime ließ sich bei Patienten mit einem Alter über 60 Jahre gegenüber Vancomycin (Dosis: viermal 125 mg/Tag über zehn Tage) eine Heilungsrate (30 Tage nach Therapieende) von 70% gegenüber 59% (Vancomycin-Gruppe) erreichen (p = 0,03). Dieses modifizierte Behandlungsregime könnte deshalb vor allem für Patienten mit einem höheren, relativen Risiko für eine Clostridioides-difficile-Infektion (z. B. Alter > 65 Jahre) von Bedeutung sein, eine Zulassung für diese abweichende Dosierung besteht bisher allerdings nicht [16].
Es ist unschwer zu erkennen, dass in den aktuellen ESCMID-Leitlinien (Tab. 1) Fidaxomicin als Mittel der ersten Wahl gegenüber Vancomycin p. o. platziert wurde [27]. In diesem Zusammenhang gibt es drei wichtige Punkte zu beachten:
- Werden die Heilungsraten, die man im Rahmen einer CDI-Behandlung mit Fidaxomicin bzw. Vancomycin erreicht, miteinander verglichen, so lässt sich zwar kein signifikanter Unterschied zwischen den beiden Behandlungsoptionen erkennen, die Diarrhoen (CDAD) sistieren allerdings deutlich schneller unter Fidaxomicin (im Mittel ca. 74 Stunden vs. 123 Stunden), sodass der Zeitraum einer kritischen fäkal-oralen Verbreitung verkürzt wird [6, 20].
- Vergleicht man die Rate an CDI-Rezidiven nach abgeschlossener Initialtherapie, so ist sie unter Fidaxomicin um ca. 10 bis 14% signifikant geringer als unter Vancomycin (das heißt 12,7 bis 15,4% vs. 25,3 bis 26,9%), was einer ca. 50%igen relativen Risikoreduktion (RRR) entspricht [6, 20].
- Studien zur potenziellen Veränderung der Mikrobiota unter Vancomycin p. o. haben gezeigt, dass es unter dem Glykopeptid im Laufe der Behandlung relativ schnell zu einer deutlichen Abnahme an z. B. Bacteroides fragilis oder Prevotella spp. kommt, während Darmbakterien wie Enterobacter spp., Clostridien und Vancomycin-resistente Enterokokken (VRE) zunehmen. Unter Fidaxomicin war hingegen eine vergleichsweise geringe Veränderung der Mikrobiota zu beobachten, was auch die geringere Rate an Rezidiven miterklären dürfte [10, 20].
Fidaxomicin wurde deshalb von der ESCMID 2021 bei Patienten mit hohem Rezidivrisiko einer Vancomycin/Bezlotoxumab-Kombination gleichgesetzt, eine Monotherapie mit Vancomycin p. o. wird in dieser Konstellation nicht mehr empfohlen [27]. Hilfreich für die Praxis ist beim Fidaxomicin die Möglichkeit, neben den handelsüblichen Tabletten mittlerweile auch auf ein Granulat zurückgreifen zu können, so dass man für Patienten mit Schluckbeschwerden aber auch für Säuglinge eine angemessenere Formulierung bereitstellen kann (s. Tab. 2).
Formulierung | Dosierung | Anmerkungen |
|---|---|---|
Dificlir 200 mg Filmtabletten | zweimal 200 mg/Tag | Anwendung bei Erwachsenen, Kindern und Jugendlichen möglich (ab ≥ 12,5 kg Körpergewicht) |
Dificlir 40 mg/ml Granulat (1 Flasche enthält 7,7 g Granulat) | Körpergewicht (KG): < 4 kg: zweimal täglich 1 ml (40 mg) KG: 4 bis ≤ 7 kg: zweimal täglich 2 ml (80 mg) KG: 7 bis ≤ 9 kg: zweimal täglich 3 ml (120 mg) KG 9 bis ≤ 12,5 kg: zweimal täglich 4 ml (160 mg) KG ≥ 12,5 kg: zweimal täglich 5 ml (200 mg) |
|
Tigecyclin
Das Glycylcyclin-Derivat Tigecyclin ist zur Behandlung komplizierter intraabdomineller Infektionen zugelassen und gegen verschiedene grampositive Erreger sehr gut wirksam. Seine in-vitro Aktivität (MHK[90]-Wert) gegen Clostridioides difficile liegt zwischen 0,03 bis 0,13 µg/ml.
Da ca. 59% der verabreichten intravenösen Dosis über die Galle ausgeschieden und weniger als 20% der Dosis metabolisiert werden, werden unter klinisch-pharmakokinetischen Gesichtspunkten im Darmlumen ausreichend hohe Tigecyclin-Konzentrationen erreicht, um Clostridioides difficile zu erfassen [22]. Allerdings liegen bis heute keine groß angelegten Phase-III-Studiendaten mit Tigecyclin bei refraktären CDI-Fällen vor, sodass man im Wesentlichen auf die Ergebnisse von Fallserien zurückgreifen muss. In diesem Zusammenhang erwies sich eine Initialdosis von 100 mg Tigecyclin i.v., gefolgt von zweimal täglich 50 mg i. v. als ausreichend. Inwieweit Flankierungen mit z. B. Rifaximin p. o. (z. B. zweimal täglich 550 mg p. o.) – wie am Beispiel von Lao et al. publiziert – tatsächlich noch erforderlich waren, bleibt unklar [18].
Bezlotoxumab
Mit dem IgG1-Antikörper Bezlotoxumab (Zinplava®) steht seit einigen Jahren der erste, zielgerichtet wirksame monoklonale Antikörper zur Verfügung, der gegen Clostridien-Toxin B gerichtet ist. Er ist nicht für die Behandlung schwerer Verläufe einer Clostridioides-difficile-Infektion geeignet, sondern als Sekundärprävention von Rezidiven zu verstehen, insbesondere, wenn ein hohes Rekurrenzrisiko besteht, z. B. Immunsuppression, ein durchgemachter schwerer Verlauf oder ein Alter ≥ 65 Jahre. Aus diesem Grund ist er in der Leitlinie der ESCMID (Tab. 1) nicht als Monotherapie, sondern grundsätzlich als Add-on-Therapie zu einer Standardtherapie (SoC) angegeben [27]. Die Infusion von 10 mg/kg Bezlotoxumab i. v. (über eine Stunde) erfolgt einmalig und ist im Zeitfenster zwischen Beginn und Ende der Antibiotika-Therapie vorzusehen. Zwar erfolgten in den Zulassungsstudien MODIFY I und MODIFY II vor allem gemeinsame Gaben mit Vancomycin p. o. bzw. Metronidazol p. o., jedoch zeigt die Analyse von Dubberke E et al., dass bei Bedarf nichts gegen eine Kombination aus Fidaxomicin und Bezlotoxumab spricht, da auch unter dieser Konstellation gegenüber Placebo eine deutliche Reduktion der Rezidivrate erreicht werden konnte. Allerdings liegen für diese Kombination noch keine Phase-III-Studienergebnisse vor [9].
Gepoolte Daten aus der MODIFY-I- und MODIFY-II-Studie konnten zeigen, dass mit Bezlotoxumab das Rezidivrisiko um 38% (RRR) gesenkt werden konnte (16,5% vs. 26,6%), wenn der Antikörper als Add-on-Therapie eingesetzt wurde. Dabei war dieser positive Effekt in verschiedenen Subgruppen durchgängig zu beobachten; das heißt sowohl bei Immunsupprimierten als auch bei Patienten mit schweren CDI-Verläufen in der Anamnese oder höherem Alter (≥ 65 Jahre) [28]. In einer Post-hoc-Analyse zeigte sich darüber hinaus, dass durch den Zusatz von Bezlotoxumab die Rehospitalisierung und die Dauer des Krankenhausaufenthalts signifikant gesenkt werden konnte [23].
Sonstige Antibiotika
Inzwischen sind zahlreiche Studien veröffentlicht worden, in denen zur Behandlung von Clostridioides-difficile-Infektionen auch noch andere Antibiotika und Wirkstoffe wie Ridinilazol, Surotomycin, Bacitracin, Rifaximin, Nitazoxanid, Fusidinsäure oder Tolevamer eingesetzt worden waren. Allerdings kommen Beinortas et al. in ihrer Metaanalyse zu dem Schluss, dass bei der Auswertung der zur Verfügung stehenden Studiendaten der Wirkstoff Fidaxomicin mit der höchsten Evidenz einer anhaltenden symptomorientierten Heilungsrate verbunden war, und in diesem Aspekt dem Glykopeptid Vancomycin deutlich überlegen ist, während Metronidazol nicht mehr weiter empfohlen werden kann. Den anderen Wirkstoffen kommt bisher keine eigenständige Bedeutung in der Behandlung von Clostridioides-difficile-Infektionen zu. Beim Ridinilazol muss wiederum zunächst eine Phase-III-Studie zeigen, ob ihm ein besonderer Stellenwert zukommen könnte. In diesem Zusammenhang wird man mittlerweile eine Vergleichsstudie mit Fidaxomicin p. o. und nicht mit Vancomycin p. o. für weitergehende Interpretationen benötigen [1].
Auf einen Blick
- In der aktualisierten ESCMID-Leitlinie zur Behandlung von Clostridioides-difficile-assoziierten Infektionen wird sowohl in der Standardbehandlung als auch bei hohem Rezidivrisiko kein Metronidazol mehr aufgeführt. Grund ist die klinische Unterlegenheit des Nitroimidazol-Derivats gegenüber Vancomycin p. o.
- Vancomycin hat keine Bedeutung mehr als Monotherapie bei Patienten mit Clostridioides-difficile-assoziierten Infektionen mit hohem Rezidivrisiko, sodass sich der Arzt zwischen Fidaxomicin als Monotherapie oder einer Kombination aus Vancomycin p. o. und dem Antikörper Bezlotoxumab entscheiden muss.
- Bei schweren Verläufen sind Vancomycin p. o. und Fidaxomicin p. o. gleichbedeutend aufgeführt, da keine direkte Überlegenheit des makrozyklischen Laktons gezeigt werden konnte.
- Es ist es sicherlich frühzeitig angebracht, weitere Therapieoptionen wie Tigecyclin i. v. bei kritischeren Situationen einzusetzen. Teilweise wurden in diesem Zusammenhang auch weitere Substanzen wie Rifaximin ins Spiel gebracht, allerdings befindet man sich dann nicht mehr auf dem Boden der studienbasierten Evidenz.
- Die fäkale Mikrobiota-Transplantation ist eine wichtige und effektive Maßnahme als Sekundärprävention nach mehrfachen Rezidiven unter Vancomycin, Fidaxomicin und Bezlotoxumab, aber auch hier ist man vor einem Therapieversagen nicht gefeit.
- Konzentrierte Mikrobiota-Aufbereitungen sind Therapiestrategien, die in naher Zukunft zur Verfügung stehen dürften. Kritisch sind die sehr hohen Therapiekosten. Die Effektivität dieser neuen Formulierungen gegenüber einer fäkalen Mikrobiota-Transplantation muss genauer geprüft werden.
Fäkale Mikrobiota-Transplantation
In den letzten zehn Jahren ist die Option einer fäkalen Mikrobiota-Transplantation (FMT) als modernes Verfahren des Stuhltransfers immer mehr in den Mittelpunkt des Interesses gerückt, wenn Patienten mit mehrfachen CDI-Rezidiven zu behandeln sind. Auch in der ESCMID-Leitlinie taucht die Stuhltransplantation als Empfehlung auf, wenn es trotz Standardtherapie zum zweiten oder mehrfachen Rezidiv kommt (s. Tab. 1). Erfreulich ist in diesem Zusammenhang, dass die fäkale Mikrobiota-Transplantation nicht mehr als Suspension über eine nasopharyngeale Sonde erfolgen muss, sondern auch als magensaftresistente Kapsel appliziert werden kann. Unter galenischen Aspekten wird die Stuhlspende zunächst mit NaCl 0,9% verdünnt, daraufhin wird sie in mehreren Schritten aufgereinigt. Am Ende des Prozesses wird das Konzentrat in magensaftresistente Gelatinekapseln pipettiert, die anschließend bei -80°C tiefgefroren werden. Weiterentwickelte Aufbereitungen sehen mittlerweile sogar die Option einer Lagerung bei -20 °C vor! Mithilfe von Glycerol als Hilfsstoff wird die vorzeitige Zerstörung der Mikrobiota während des Einfrierprozesses verhindert. Die Herstellung unterliegt dem Arzneimittelgesetz (AMG), eine Herstellungserlaubnis nach § 13 AMG ist allerdings nicht erforderlich.
Nach einer Untersuchung in mehreren kanadischen Zentren war die Einnahme der Kapseln (ca. 40 Stück) mit tiefgefrorener/aufgetauter fäkaler Mikrobiota der Therapie mit frischer fäkaler Mikrobiota (in Form eines Einlaufs [ca. 360 ml] via Koloskopie) im klinischen Ansprechen (Per-Protokoll-Analyse) nicht unterlegen (83,5% vs. 85,1%). Die Nebenwirkungsraten waren ebenfalls gleich, sodass sich absehbar die Anwendung der Kapseln immer mehr durchsetzen dürfte, da das Prozedere leichter durchführbar ist. Nach der Untersuchung von Cao et al. beschrieben 66% der Patienten die Anwendung der großen Kapselmenge als nicht unangenehm [19].
Auch wenn eine fäkale Mikrobiota-Transplantation zweifelsohne eine wirksame Methode bei rezidivierenden Clostridioides-difficile-Infektionen darstellt (s. Tab. 1), so sind auch unter einer fäkalen Mikrobiota-Transplantation Fälle von Therapieversagen bekannt. Als wichtige Prädiktoren wurden in diesem Zusammenhang unter anderem schwere und schwerste komplizierte Krankheitsverläufe in der Anamnese, sowie die Durchführung einer fäkalen Mikrobiota-Transplantation unter stationären Bedingungen identifiziert [15].
Ausblick: SER-109 und RBX2660
Mit SER-109 befindet sich inzwischen ein oral applizierbares Mikrobiota-haltiges Therapeutikum in der fortgeschrittenen klinischen Prüfungsphase, das vermehrungsfähige, gereinigte, sporenbildende Firmicutes-Bakterienstämme enthält. Sie konkurrieren mit C. difficile um metabolisch essentielle Nährstoffe und modulieren das natürliche Profil an sekundären Gallensäuren in der Weise, dass die Auskeimung von C.-difficile-Sporen deutlich erschwert wird.
In einer vor Kurzem publizierten, doppelblinden, randomisierten placebokontrollierten Phase-III-Studie (ECOSPOR), in der Patienten eingeschlossen worden waren, die bereits drei oder mehr Episoden an Clostridioides-difficile-Infektionen hinter sich hatten, erhielten die Studienarme entweder Placebo oder SER-109 (vier Kapseln am Tag über drei Tage) nach Abschluss einer Standard-of-Care-Therapie. Primärer Endpunkt der Studie war die Rate an rezidivierender CDI bis zu acht Wochen nach Abschluss der SER-109-Behandlung.
Beeindruckend war in diesem Zusammenhang das Studienergebnis: 12% der Patienten in der SER-109-Gruppe und 40% in der Placebogruppe (p < 0,001) entwickelten im vorgegebenen Beobachtungszeitraum ein CDI-Rezidiv. Subgruppenanalysen zeigten, dass der signifikante Vorteil auch bei Patienten mit höherem Alter (> 65 Jahre) zu beobachten war [26].
Mit RBX2660 befindet sich inzwischen ein standardisiertes Mikrobiota-haltiges Präparat bereits in der Zulassungsphase in den USA. Eine Phase-III-Studie in der EU befindet sich in der Planungsphase. Sollte ein entsprechendes Präparat in Europa zugelassen werden (z. B. als Add-on nach CDI-Rezidiv), so könnte die Praxis der lokal aufbereiteten fäkalen Mikrobiota-Transplantation – ohne EMA-Zulassung – unter Druck geraten. Andererseits dürften Therapiekosten von ca. 10.000 US-Dollar für RBX2660, wie sie derzeit diskutiert werden, wiederum ein starkes Argument bieten, weiter an einer fäkalen Mikrobiota-Transplantation als Therapieprinzip festzuhalten, da sie in der Regel mit Kosten von ca. 800 Euro pro Anwendung verbunden ist [26].
Der Einsatz von Probiotika auf der Basis von z. B. Lactobacillus casei ist hingegen keine Option bei Patienten mit rezidivierender Clostridioides-difficile-Infektion, sondern – wenn überhaupt – als eine simultan anzuwendende supportive Strategie zur Vermeidung Antibiotika-assoziierter Diarrhoen (inkl. CDAD) zu sehen, wobei allerdings eine Menge von 50 bis 100 Mrd. CFU (Colony-forming Units) pro Tag erforderlich sein dürften [21]. Inwieweit zukünftig Clostridioides butyricum MIYAIRI 588 spp. als probiotische Therapie im Rahmen Antibiotika-assoziierter Diarrhoen eine größere Rolle spielen könnte, wie es in Japan der Fall ist, bleibt abzuwarten [29]. |
Literatur
[1] Beinortas T, Burr NE, Wilcox MH et al. Comparative efficacy of treatments for Clostridium difficile infection: a systematic review and network meta-analysis. Lancet Infect Dis 2018;18:1035-1044
[2] Britt NS, Steed ME, Potter EM, Clough LA. Tigecycline for the treatment of severe and severe complicated Clostridium difficile infection. Infect Dis Ther 2014;3:321-331[
[3] Carroll K, Loeffelholz M. Conventional versus Molecular Methods for the Detection of Clostridium difficile. J Clin Microbiol 2011;49(Suppl.9):49-52
[4] Chahine EB, BCPS. The Rise and Fall of Metronidazole for Clostridium difficile Infection. Ann Pharmacother 2018;52:600-602
[5] Choi HK, Kim KH, Lee SH, Lee SJ. Risk Factors for Recurrence of Clostridium difficile Infection: Effect of Vancomycin-resistant Enterococci Colonization J Korean Med Sci 2011;26:859-864
[6] Cornely OA, Crook DW, Esposito R et al. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis 2012;12:281-289
[7] De Lalla F, Nicolin R, Rinaldi E et al. Prospective Study of Oral Teicoplanin versus oral Vancomycin for therapy of Pseudomembranous colitis and Clostridium difficile-Associated Diarrhea. Antimicrob Agents Chemother 1992;10:2192-2196
[8] Dormann AJ, Weinke T. Clostridium-difficile-Infektionen – Ein zunehmendes Problem in deutschen Krankenhäusern. Klinikarzt 2015;39:2-10
[9] Dubberke ER, Gerding DN, Kelly CP et al. Efficacy of Bezlotoxumab in Participants Receiving Metronidazole, Vancomycin, or Fidaxomicin for Treatment of Clostridioides (Clostridium) difficile Infection. Open Forum Infectious Diseases 2020;epub
[10] Edlund C, Barkholt L. Effect of Vancomycin on Intestinal Flora of Patients Who Previously Received Antimicrobial Therapy. Clin Infect Dis 1997;25:729-732
[11] Ensom MH, Decarie D, Lakhani A. Stability of Vancomycin 25 mg/ml in Ora-Sweet and Water in Unit-Dose Cups and Plastic Bottles at 4°C and 25°C. JCPH 2010;63:366-8.
[12] Epple HJ. Clostridium-difficile-Infektion: Evidenzbasierte Empfehlungen zur Diagnose und Therapie von durch C. difficile ausgelösten nosokomialen Diarrhöen. Thieme Leitlinie kompakt 2017;5:1-12
[13] Fawley J, Napolitano LM. Vancomycin Enema in the Treatment of Clostridium difficile Infection. Surgical Infection 2019;20:311-316
[14] Fekety R, Silva J et al. Treatment of Antibiotic-Associated Clostridium difficile Colitis with Oral Vancomycin: Comparison of Two Dosage Regimens. Am J Med 1989;86:15-19
[15] Fischer M, Kao D et al. Predictors of early failure after fecal microbiota transplantation for the therapy of Clostridium difficile infection: A multicenter study. Am J Gastroenterol 2016;111:1024-1031
[16] Guery B, Menichetti F, Attila V-J et al. Extended-pulsed fidaxomicin. Lancet Infect Dis 2018;18:296-307
[17] Hurley BW, Nguyen C. The spectrum of Pseudomembranous Enterocolitis and Antibiotic-Associated Diarrhea. Arch Intern Med. 2002;162:2177-2184
[18] Lao II D, Chiang T, Gomez E. Refractory Clostridium difficile Infection Successfully Treated with Tigecycline, Rifaximin, and Vancomycin. Case Reports in Medicine 2012;ID. 702910
[19] Li YT, Cai HF, Wang ZH et al. Systematic review with meta-analysis: Long-term outcomes of fecal microbiota transplantation for Clostridium difficile infection. Aliment Pharmacol Ther. 2016;43:445-457
[20] Louie TJ, Miller MA, Mullane KM et al. Fidaxomicin versus Vancomycin for Clostridium difficile Infection. N Engl J Med 2011;364:422-431
[21] Ma Y, Yang J, Peng X et al. Which probiotic has the best effect on preventing Clostridium difficile-associated diarrhea? A systematic review and network meta-analysis. J Dig Dis 2020;21:69-80
[22] Pankey GA. Tigecycline. J Antimicrobial Chemotherapy 2005;56:470-480
[23] Prabhu VS et al. Thirty-day readmissions in hospital patients who received beclotoxumab with antibacterial drug treatment for Clostridium difficile infection. Clin Infect Dis 2017;65:1218-21
[24] Stevens VW et al. Comparative effectiveness of Vancomycin and Metronidazole for the prevention of recurrence and death in patients with Clostridium difficile infection. JAMA Intern Med 2017, epub
[25] Tae CH, Jung SA et al. The First Case of antibiotic-associated Colitis by Clostridium difficile PCR Ribotype 027 in Korea. J Korean Med Sci 2009;24:520-524
[26] Tran M-CN, Kullar R, Goldstein EJC. Investigational drug therapies currently in early-stage clinical development for the treatment of clostridioides (clostridium) difficile infection. Expert Opin Investig Drugs 2019;28:323-335
[27] Van Prehn J et al. European Society of clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin Microbiol Infect 2021;S1:198-743
[28] Wilcox MH, Gerding DN, Poxton IR et al. MODIFY I and MODIFY II investigators: Bezlotoxumab for prevention of recurrent Clostridium difficile infection. N Engl J Med 2017;376:305-317
[29] Tomita Y, Ikeda T, Sakata S et al. Association of Probiotic Clostridium butyricum Therapy with Survival and Response to Immune Checkpoint Blockade in Patients with Lung Cancer. Cancer Immunol Res 2020;8:1236-1242




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.