
- DAZ.online
- DAZ / AZ
- DAZ 17/2022
- Herausforderung ...
Schwerpunkt Endometriose
Herausforderung Endometriose
Das Schmerzgeschehen verstehen
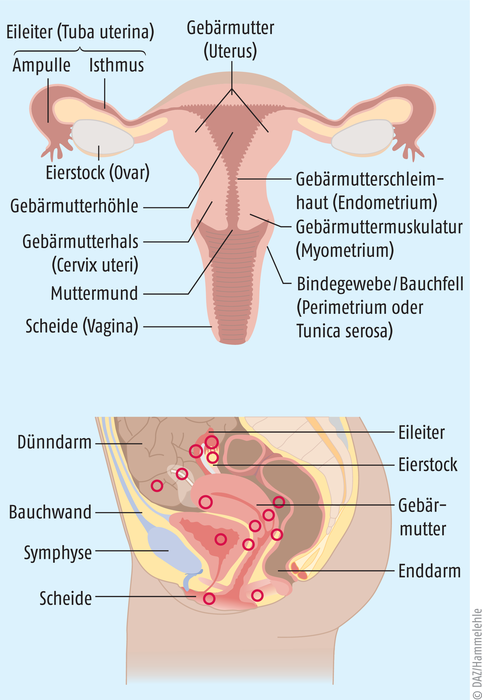
Die Endometriose ist eine Erkrankung, bei der es zur Ansiedlung von Endometrium-artigen Läsionen außerhalb der Gebärmutterhöhle kommt. Ursprünglich wurden damit ektope Läsionen auf dem Peritoneum der inneren Genitalorgane (Endometriosis genitalis externa) beschrieben, doch inzwischen ist damit auch eine Abwanderung solcher Inseln ins Myometrium, also in die Muskelschicht der Gebärmutter gemeint (Endometriosis genitalis interna = Adenomyosis uteri) (s. Abb. 1).
Endometriose in all ihren Facetten ist eine komplexe Erkrankung. Wegweisend sind jedoch Schmerzen und Infertilität als die typischen klinischen Symptome. Die charakteristischen Beschwerden dieser Erkrankung sind hinlänglich bekannt:
- schwere Dysmenorrhö,
- zyklische und azyklische Unterbauchschmerzen,
- zyklisch auftretende Schmerzen beim Wasserlassen (Dysurie) und der Stuhlentleerung (Dyschezie),
- Schmerzen beim Geschlechtsverkehr (Dyspareunie) sowie Infertilität
Abb. 1: Als Endometriose wird das Vorkommen von Endometrium-artigem Gewebe (Epithel-, Stroma- und Muskelzellen) außerhalb der Gebärmutterhöhle bezeichnet. Je nach Vorkommen der Gewebe (hier rot markiert) werden verschiedene Formen unterschieden: Endometriosis genitalis externa: außerhalb der Genitalorgane im kleinen Becken an den Sakrouterinligamenten, der Fossa ovarica, im Douglas-Raum, auf dem Blasenperitoneum oder auch den Ovarien; Endometriosis genitalis interna, auch Adenomyosis uteri: Gebärmuttermuskelwand; tief infiltrierende Herde vor allem im Septum rectovaginale oder Sigma lokalisiert, aber auch Blasenwand; Endometriosis extragenitalis: Läsionen außerhalb des kleinen Beckens wie am Zwerchfell, Nabel, Blinddarm
Trotzdem wird die Erkrankung im Mittel erst zehn Jahre nach Einsetzen der Beschwerden diagnostiziert. Neben den Endometriose-spezifischen Symptomen können im Laufe der Jahre auch unspezifische Beschwerden das klare Beschwerdebild verzerren und dazu führen, dass nicht nur Gynäkologen, sondern auch andere Fachrichtungen konsultiert werden, z. B. Innere, Gastroenterologie, Orthopädie, Schmerztherapie, Psychologie [21]. Nach solch einer langen Beschwerdezeit steht man oft einem diffusen Symptombild gegenüber, das pathophysiologisch komplex und schwer zu verstehen ist. Nicht selten geraten daher „solche“ Patientinnen fälschlich unter den Verdacht, an Somatisierungsstörungen zu leiden.
Das klinische Bild der Endometriose scheint das Resultat einer jahrelangen Entwicklung zu sein, abhängig vom biologischen Potenzial [29] kann sie früher oder später auftreten. Aktuell geht man davon aus, dass der Uterus Ursprung dieser Erkrankung ist. Eine uterine Hyperperistaltik bedingt eine Mikrotraumatisierung in der inneren Hälfte des Myometriums (Junktionalzone, JZ) mit Aktivierung von uterinen Stammzellen, die sich andernorts ansiedeln und Endometriose-Läsionen bilden können [29]. Stellt man sich den Ablauf der Endometriose-Entwicklung zeitlich vor, dann gibt es eine Phase, in der zwar bereits starke Beschwerden bestehen (primäre/sekundäre Dysmenorrhö), aber kaum Veränderungen im Uterus sichtbar sind (Archimetrose). Daher wird hier oftmals keine Therapiemaßnahme oder nur passager oder inkonsequent eingeleitet [15, 25].Die peritoneale Endometriose ist sonografisch nicht sichtbar, kann aber schon erhebliche Schmerzen (zyklische und azyklische Unterbauchschmerzen) verursachen. Erst wenn Gebärmutterschleimhautzellen sich im Myometrium angesiedelt haben und damit das Stadium der Adenomyose erreicht ist, ist die Endometriose im Ultraschall zu erkennen. Dann ist aber die uterine Architektur bereits verändert. Eine Adenomyosis uteri ist dabei ebenso wie eine fortgeschrittene Endometriose mit Organdestruktion oftmals nur von sehr geschulten Endometriose-Spezialisten sonografisch darstellbar. Daher muss die Schmerzanamnese führend sein in der Diagnostik. Denn letztlich berichten über 60% der Betroffenen, bei denen in späteren Jahren eine Endometriose diagnostiziert wurde, über einen Beschwerdebeginn vor dem 20. Lebensjahr [4]. Dabei besteht zwischen Dauer und Intensität der Beschwerden eine klare Korrelation zum Ausmaß der späteren Endometriose [4].
Endometriose-assoziierte Schmerzen
Die Kenntnis der Art und Verteilung der verschiedenen Endometriose-Läsionen erlaubt ein besseres Verständnis hinsichtlich der möglichen Auswirkungen. So können grundsätzlich alle Läsionen die unterschiedlichen Symptome hervorrufen. Beschwerden liegen meist kombiniert vor, isolierte Symptome sind eher selten. Typisch ist die Kombination zyklische Unterbauchschmerzen/Dysmenorrhö und Dyspareunie.
In Abhängigkeit der Lokalisation der Läsionen kommt es zu
- somatischen Schmerzen (Peritoneum, Beckenwand) oder
- viszeralen Schmerzen (Uterus, Blase oder Darm).
Diese beiden Schmerztypen sind sehr unterschiedlich. Viszerale Schmerzen sind dumpf und krampfartig, strahlen aus, viszerale Organe interagieren miteinander, so dass Blasenschmerzen schwer von uterin bedingten Schmerzen abgrenzbar sind. Zudem interagiert die autonome, viszerale Innervation mit den viszeralen sensorischen Neuronen, die die autonomen Ganglien durchlaufen, so dass bei starken Schmerzen auch vegetative Begleitreaktionen wie Übelkeit, Erbrechen, Kollapsneigung und vor allem auch eine zyklische Menstruations-assoziierte Diarrhö häufig vorkommen [32].
Somatische Schmerzen hingegen sind eher spitz/scharf und punktförmig. Aufgrund der hohen Dichte der sensiblen Nervenfasern im parietalen Peritoneum, also dem äußeren Blatt des die Bauchhöhle auskleidenden Bauchfells, können sie besser lokalisiert werden. Für die Schmerzwahrnehmung müssen gewisse Bedingungen erfüllt sein:
- Es muss 1. ein biochemisches Signal geben,
- das 2. in ein neuronales Signal umgesetzt wird (Sensitivierung von Schmerznervenfasern über Aktivierung der Nozizeptoren).
- Auf spinaler Ebene erfolgt 3. eine Modulation dieses Signals,
- dieses wird bearbeitet (abgeschwächt/verstärkt) an das Gehirn weitergeleitet, wo 4. dann die Schmerzwahrnehmung abgebildet wird [4].
Die erste beiden Schritte werden auch als periphere, die Schritte 3 und 4 als zentrale Sensitivierung unterschieden. Störungen der Schmerzwahrnehmung kann es auf allen Ebenen geben.
Dysmenorrhö und zyklisch auftretende Schmerzen
Die Dysmenorrhö wie auch zyklische Unterbauchschmerzen, die durch peritoneale Herde bedingt sind, können zunächst als nozizeptive = inflammatorische Schmerzen verstanden werden. Es kommt zyklisch bedingt zu einer Freisetzung von Schmerz- und Entzündungsmediatoren, die viszerale und peritoneale Nervenfasern aktivieren und zu einer Schmerzsensitivierung führen. Das sind Schmerzen, die durch Entzündung und Zellschädigung ausgelöst werden und mit Abklingen der Reaktion wieder verschwinden. Daher können diese Schmerzen anfangs gut mit nichtsteroidalen Antiphlogistika beherrscht oder durch eine Therapie-induzierte Amenorrhö ganz gestoppt werden, da dann eine zyklusbedingte Freisetzung der Mediatoren nicht stattfindet. Dabei ist zu beachten, dass die Abbruchblutung unter hormoneller Therapie mit kombinierten oralen Kontrazeptiva im zyklischen Modus weiterhin schmerzhaft sein kann. Die Mechanismen sind nicht gut untersucht, aber vermutlich kommt es aufgrund der primären Störungen der uterinen Schichten mit Hyperperistaltik trotzdem zur Freisetzung von Schmerzmediatoren und somit zur Aktivierung von Schmerzfasern.
Da zwischen dem Ausmaß der Endometriose und der Schmerzintensität nicht zwangsläufig eine Korrelation besteht, kann es auch bei „unauffälligen“ Untersuchungsbefunden schwerste Schmerzzustände geben, und umgekehrt können Patientinnen mit komplexer Endometriose weitestgehend beschwerdefrei sein. Ein Phänomen, das oft nur schwer nachvollziehbar ist.
Kommt es im Verlauf der Erkrankung zu einem Progress, verbunden mit einer Scheiden-, Darm- oder Blaseninfiltration, können auch hier zyklische Beschwerden auftreten. Bei rektovaginaler Endometriose kommt es dann typischerweise aufgrund der Nähe zum Darm bzw. bei Darminfiltration auch zur Störung der Defäkation (Dyschezie). Aufgrund der zyklischen Anschwellung der Herde kann es zu krampfartigen Schmerzen vor dem Stuhlgang kommen, zu Stuhlunregelmäßigkeiten bis hin zum zyklischen Subileus. Obstipation gefolgt von Diarrhö, paradoxe oder gar Bleistiftstühle können beobachtet werden. Die Abfrage dieser Symptome hilft, eine potenzielle Stenose zu erkennen. Dies kann das Rektum, Sigma oder auch den ersten Dickdarmabschnitt (Coecalpol-Region) betreffen. Infiltrieren die Endometriose-Läsionen komplett die ganze Darmwand, kann es zum zyklischen Auftreten von frischem Blut im Stuhl, der sogenannten zyklischen Hämatochezie kommen. Und natürlich kommt es aufgrund der Lokalisation auch zunehmend zu Beschwerden beim Geschlechtsverkehr, also zu einer Dyspareunie, die dann oft auch azyklisch besteht, da die Knoten hyperinnerviert sind und auf Druckreize schmerzhaft reagieren [2]. Blasen-Endometriose führt typischerweise zur zyklischen Dysurie, kann aber ebenfalls zu unspezifischen Beschwerden wie verstärktem Harndrang und Wasserlassen (Pollakisurie) und/oder ziehenden Schmerzen nach der Blasenentleerung führen. Auch hier kommt es erst zur zyklischen Hämaturie, wenn die Blasenwand komplett infiltriert und das Urothel betroffen ist.
Neurogene Inflammation
Manche Patientinnen entwickeln unter hormoneller Therapie (mit und ohne therapeutischer Amenorrhö) azyklische Unterbauchschmerzen. Dies ist ein wichtiger Hinweis darauf, dass Endometriose-Läsionen Mechanismen entwickeln, die hormonunabhängig aktiv sein können. Es wurden umfangreiche Analysen hinsichtlich der Innervation dieser Läsionen durchgeführt [5]. Peritoneale Läsionen zeigen eine Hyperinnervation von sensiblen Nervenfasern, aber einen Verlust von sympathischen Nervenfasern. In Analogie zur Rheumaforschung scheint es dabei zu einem Ungleichgewicht der Freisetzung von sensiblen proinflammatorischen und antiinflammatorischen sympathischen Neurotransmittern zu kommen. Folge dieser Dysbalance kann eine neurogene Inflammation sein, die dann möglicherweise zu einer Verlagerung zu azyklischen Schmerzen führt. Dieses Phänomen lässt sich auch in tief infiltrierenden Endometrioseläsionen beobachten. Daher ist die Kenntnis über Hormontherapie-resistenten Schmerz wichtig, um Therapieentscheidungen anzupassen. Erschwerend können im Verlauf der Erkrankung Schmerzen aufgrund von Verwachsungen (Adhäsions-bedingte Schmerzen) hinzukommen, die sowohl somatisch als auch viszeral sein können und die ebenfalls durch einen Übergang der zunächst zyklischen in azyklische Unterbauchschmerzen charakterisiert sind. Aufgrund der chronischen Schmerzen entwickeln die Patientinnen nicht selten eine reaktive Depression sowie somatoforme Schmerzstörungen, die das Krankheitsbild noch komplexer erscheinen lassen.
→ Fortbestehende stark schmerzhafte Abbruchblutung unter kombinierten oralen Kontrazeptiva ist als Warnhinweis zu sehen!
Entwicklung einer zentralen Sensitivierung mit spinaler Hyperalgesie
Schmerz ist physiologisch ein Warnsignal. Werden Schmerzen ignoriert, können sie zunehmen. Zudem ist Schmerz ein individuelles Geschehen, die Schmerzwahrnehmung ist subjektiv. Bleibt eine schwere Dysmenorrhö (Menstruationsschmerzen, die ohne Einnahme von Analgetika zur Bettlägerigkeit, Schul- oder Arbeitsunfähigkeit führen) unbehandelt, kehrt sie also monatlich wieder, so wird dieser Schmerz anfangs wie oben beschrieben als nozizeptiver Schmerz wahrgenommen, der mit Nachlassen der Freisetzung von Entzündungs- und Schmerzmediatoren auch wieder abflaut. Tritt dieser Schmerz jedoch wiederholt auf, greifen die körpereigenen Warnsignale, der Schmerz wird als bedrohlich eingestuft, und die Modulation auf spinaler Ebene reguliert diesen nicht etwa herunter, sondern verstärkt ihn noch. Auf spinaler Ebene wird die Neurotransmitterfreisetzung verändert, und eine Reihe modulierender Mechanismen setzt ein, das nozizeptive Feld wird erweitert, so dass auch Dysurie und/oder Schwierigkeiten bei der Defäkation auftreten können [24]. Es kommt zu einer spinalen Hyperalgesie mit heruntergesetzter Schmerzschwelle und Wahrnehmung von Schmerzen schon bei geringen Reizen wie bei Berührung. Durch zunehmende Schmerzen werden Patientinnen geängstigt, die Schmerzverarbeitung wird dadurch erschwert. Starke Krämpfe mit Schmerzen, auch von vegetativer Reaktion begleitet, führen zudem zum Einnehmen einer Schonhaltung, wodurch eine Schmerzlinderung gesucht wird. Reaktiv kommt es im Zuge dessen zu einer reflektorischen Kontraktion der Beckenbodenmuskulatur und damit zu einer Beckenbodendysfunktion, die die Schmerzen verstärkt und zu einer Dyspareunie führen kann [1]. Halten diese Verspannungen an, entwickelt und verstärkt sich die Dyspareunie. Angst vor Schmerzen beim Geschlechtsverkehr kann die Fähigkeit zur Entspannung stark beeinflussen, und es manifestiert sich eine Störung, die immer größere Ausmaße annimmt und nicht mehr nur zyklische Probleme hervorruft, sondern sich zunehmend auch dauerhaft manifestiert. Das Phänomen erklärt die oft starken Schmerzzustände, die die Patientinnen begleiten, auch ohne dass pathologische Befunde vorliegen. Es ist unerlässlich, dies zu verstehen und der Patientin Therapievorschläge anzubieten. Denn es besteht eine Korrelation zwischen der Dauer der Schmerzen und dem Auftreten von reaktiven Depressionen, weil Patientinnen zunehmend verzweifelt sind und nach Rat und Hilfe suchen, oft aber auf Unverständnis stoßen [36]. Auch auf zentraler Ebene können Veränderungen beobachtet werden. Erste hirnmorphologische Anpassungen lassen sich nach einer Schmerzlatenz von zwei Jahren mittels funktioneller Magnetresonanztomografie nachweisen [2]. Solche Patientinnen haben ein erhöhtes Risiko, komplexe chronische Schmerzsyndrome mit Blasendysfunktion, Reizdarmsymptomatik und Vulvodynie zu entwickeln [24]. Zusammengenommen ist die Pathogenese der Endometriose-assoziierten Schmerzen sehr komplex und sicher noch nicht in allen Bereichen verstanden [29]. |
Der vorliegende Beitrag ist ein modifizierter Auszug aus dem Artikel: Mechsner S. „Endometrioseschmerz beherrschen – Stufenschema und klinische Erfahrungen“, Der Schmerz 2021, https://doi.org/10.1007/s00482-021-00543-8. Mit freundlicher Genehmigung der Springer Medizin Verlag GmbH.
Literatur
[1] Aredo JV, Heyrana KJ, Karp BI et al. Relating Chronic Pelvic Pain and Endometriosis to Signs of Sensitization and Myofascial Pain and Dysfunction. Semin Reprod Med 2017;35:88-97
[2] As-Sanie S, Harris RE, Napadow V et al. Changes in regional gray matter volume in women with chronic pelvic pain: a voxel-based morphometry study. Pain 2012;153:1006-1014
[3] Ata B, Yildiz S, Turkgeldi E et al. The Endobiota Study: Comparison of Vaginal, Cervical and Gut Microbiota Between Women with Stage 3/4 Endometriosis and Healthy Controls. Scientific Reports 2019;9:2204
[4] Ballweg ML. Impact of endometriosis on women‘s health: comparative historical data show that the earlier the onset, the more severe the disease. Best practice and research. Clinical obstetrics and gynaecology 2004;18:201-218
[5] Barcena De Arellano ML, Mechsner S. The peritoneum--an important factor for pathogenesis and pain generation in endometriosis. J Mol Med (Berl) 2014;92:595-602
[6] Becker CM, Gattrell WT, Gude K et al. Reevaluating response and failure of medical treatment of endometriosis: a systematic review. Fertility and Sterility 2017;108:125-136
[7] Bergeron S, Morin M, Lord M-J. Integrating pelvic floor rehabilitation and cognitive-behavioural therapy for sexual pain: what have we learned and were do we go from here? Sexual and Relationship Therapy 2010;25:289-298
[8] Berman BM, Langevin HM, Witt CM et al. Acupuncture for Chronic Low Back Pain. NEJM 2010;363:454-461
[9] Borrelli G, Carvalho K, Kallas E et al. Chemokines in the pathogenesis of endometriosis and infertility. Journal of reproductive immunology 2013;98:1-9
[10] Bouaziz J, Bar On A, Seidman DS et al. The clinical significance of endocannabinoids in endometriosis pain management. Cannabis and Cannabinoid Research 2017;2:72-80
[11] Brandes I, Neuser M, Kopf A et al. Endometriosis-associated Pain in Patients with and without Hormone Therapy. Journal of Endometriosis and Pelvic Pain Disorders 2017;9:200-205
[12] Campo S, Campo V, Benagiano G. Adenomyosis and infertility. Reprod Biomed Online 2012;24:35-46
[13] Chapron C, Marcellin L, Borghese B et al. Rethinking mechanisms, diagnosis and management of endometriosis. Nature Reviews Endocrinology 2019;15:666-682
[14] Chapron C, Pietin-Vialle C, Borghese B et al. Associated ovarian endometrioma is a marker for greater severity of deeply infiltrating endometriosis. Fertility and Sterility 2009;92:453-457
[15] Cousins FL, Gargett CE. Endometrial stem/progenitor cells and their role in the pathogenesis of endometriosis. Best Practice & Research Clinical Obstetrics & Gynaecology 2018;50:27-38
[16] Davidson MJ, Bryant A, Frawley H. Perineal muscle stiffness in women with and without vulvodynia: reliability of measurement and differences in muscle stiffness. Neurourol Urodyn 2014;33:Abstract 46
[17] De Graaff A, D‘hooghe T, Dunselman G et al. The significant effect of endometriosis on physical, mental and social wellbeing: results from an international cross-sectional survey. Human reproduction 2013;28:2677-2685
[18] De Ziegler D, Borghese B, Chapron C. Endometriosis and infertility: pathophysiology and management. Lancet;376:730-738
[19] Finas D, Hüppe M, Diedrich K et al. Chronischer Unterbauchschmerz am Beispiel der Endometriose – Problempatientin in der Gynäkologie? Geburtshilfe Frauenheilkd 2005;65:156-163
[20] Germeyer A, Sharkey AM, Prasadajudio M et al. Paracrine effects of uterine leucocytes on gene expression of human uterine stromal fibroblasts. Molecular human reproduction 2009;15:39-48
[21] Greene R, Stratton P, Cleary SD et al. Diagnostic experience among 4,334 women reporting surgically diagnosed endometriosis. Fertility and sterility 2009;91:32-39
[22] He W, Liu X, Zhang Y et al. Generalized hyperalgesia in women with endometriosis and its resolution following a successful surgery. Reproductive Sciences 2010;17:1099-1111
[23] Henzl MR, Buttram V, Segre EJ et al. The treatment of dysmenorrhea with naproxen sodium: a report on two independent double-blind trials. Am J Obstet Gynecol 1977;127:818-823
[24] Hoffman D. Central and peripheral pain generators in women with chronic pelvic pain: patient centered assessment and treatment. Current rheumatology reviews 2015;11:146-166
[25] Ibrahim MG, Sillem M, Plendl J et al. Myofibroblasts are evidence of chronic tissue microtrauma at the endometrial–myometrial junctional zone in uteri with adenomyosis. Reproductive Sciences 2017;24:1410-1418
[26] Johnson NP, Hummelshoj L, Adamson GD et al. World Endometriosis Society consensus on the classification of endometriosis. Human Reproduction 2017;32:315-324
[27] Köhler G, Faustmann TA, Gerlinger C et al. A dose-ranging study to determine the efficacy and safety of 1, 2, and 4 mg of dienogest daily for endometriosis. International Journal of Gynecology & Obstetrics 2010;108:21-25
[28] Lasco A, Catalano A, Benvenga S. Improvement of Primary Dysmenorrhea Caused by a Single Oral Dose of Vitamin D: Results of a Randomized, Double-blind, Placebo-Controlled Study. Archives of Internal Medicine 2012;172:366-367
[29] Leyendecker G, Wildt L. Evolutionäre Aspekte in der Pathogenese und Pathophysiologie von Adenomyose und Endometriose. Journal für Gynäkologische Endokrinologie/Österreich 2019;29:110-121
[30] Lund I, Lundeberg T. Is acupuncture effective in the treatment of pain in endometriosis? J Pain Res 2016;9:157-165
[31] Mariani M, Viganò P, Gentilini D et al. The selective vitamin D receptor agonist, elocalcitol, reduces endometriosis development in a mouse model by inhibiting peritoneal inflammation. Human Reproduction 2012;27:2010-2019
[32] Mechsner S. Endometriose. Der Schmerz 2016;30:477-490
[33] Mira TA, Buen MM, Borges MG et al. Systematic review and meta-analysis of complementary treatments for women with symptomatic endometriosis. International Journal of Gynecology & Obstetrics 2018;143:2-9
[34] Mira TA, Giraldo PC, Yela DA et al. Effectiveness of complementary pain treatment for women with deep endometriosis through Transcutaneous Electrical Nerve Stimulation (TENS): randomized controlled trial. European Journal of Obstetrics & Gynecology and Reproductive Biology 2015;94:1-6
[35] Miyashita M, Koga K, Izumi G et al. Effects of 1,25-Dihydroxy Vitamin D3 on Endometriosis. The Journal of Clinical Endocrinology & Metabolism 2016;101:2371-2379
[36] Ng N, Wahl K, Orr NL et al. Endometriosis and Negative Perception of the Medical Profession. Journal of Obstetrics and Gynaecology Canada 2020;42:248-255
[37] Nodler JL, Divasta AD, Vitonis AF et al. Supplementation with vitamin D or ω-3 fatty acids in adolescent girls and young women with endometriosis (SAGE): a double-blind, randomized, placebo-controlled trial. The American Journal of Clinical Nutrition 2020;112:229-236
[38] Rubin R. Botulinum Toxin to Treat Endometriosis Pain. JAMA 2019;322:716-716
[39] Seo J-W, Lee D-Y, Yoon B-K et al. Effects of long-term postoperative dienogest use for treatment of endometriosis on bone mineral density. European Journal of Obstetrics & Gynecology and Reproductive Biology 2017;212:9-12
[40] Shakiba K, Bena JF, Mcgill KM et al. Surgical Treatment of Endometriosis: A 7-Year Follow-up on the Requirement for Further Surgery. Obstetrics & Gynecology 2008;111:1285-1292
[41] Sillem M, Juhasz-Böss I, Klausmeier I et al. Osteopathy for endometriosis and chronic pelvic pain –a pilot study. Geburtshilfe und Frauenheilkunde 2016;76:960
[42] Stein C, Clark JD, Oh U et al. Peripheral mechanisms of pain and analgesia. Brain Res Rev 2009;60:90-113
[43] Stratton P, Khachikyan I, Sinaii N et al. Association of chronic pelvic pain and endometriosis with signs of sensitization and myofascial pain. Obstet Gynecol 2015;125:719-728
[44] Strowitzki T, Marr J, Gerlinger C et al. Dienogest is as effective as leuprolide acetate in treating the painful symptoms of endometriosis: a 24-week, randomized, multicentre, open-label trial. Human Reproduction 2010;25:633-641
[45] Vercellini P, Somigliana E, Vigano P et al. Surgery for endometriosis-associated infertility: a pragmatic approach. Human Reproduction 2009;24:254-269
[46] Weinschenk S. Neuraltherapie in der Gynäkologie. Der Gynäkologe 2015;48:20-27
[47] Wienhard J, Tinneberg H. Alternative treatment possibilities of complaints due to endometriosis. Zentralblatt für Gynäkologie 2003;125:286-289
[48] Yaraghi M, Ghazizadeh S, Mohammadi F et al. Comparing the effectiveness of functional electrical stimulation via sexual cognitive/behavioral therapy of pelvic floor muscles versus local injection of botulinum toxin on the sexual functioning of patients with primary vaginismus: a randomized clinical trial. International Urogynecology Journal 2019;30:1821-1828

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.