
- DAZ.online
- DAZ / AZ
- DAZ 11/2021
- RNA mit großem ...
Innovative Therapien
RNA mit großem therapeutischem Potenzial
Mit Erbinformationen vorbeugen und heilen
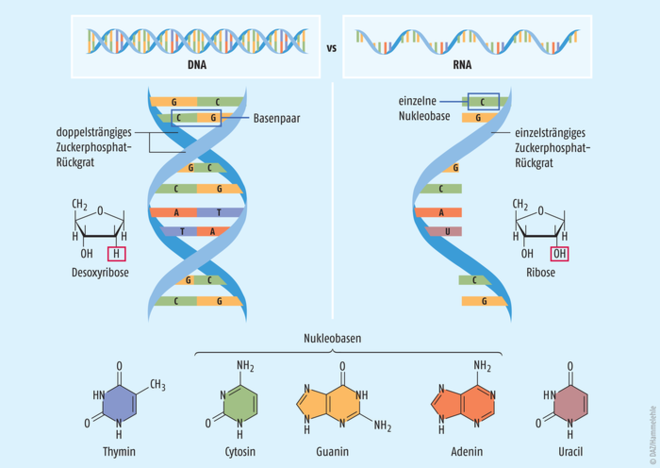
Die Ribonukleinsäure (RNA, Ribonucleic Acid) ist von ihrer molekularen Struktur her eine Polymerkette, die aus sogenannten Nukleotiden zusammengesetzt ist. Daher wird RNA auch als Polynukleotid bezeichnet. Ein Nukleotid der RNA beinhaltet eine der vier stickstoffhaltigen Nukleobasen Cytosin, Guanin, Adenin oder Uracil, die jeweils über ein Zuckerphosphat aus Ribose (ein Monosaccharid mit fünf Kohlenstoff-Atomen) und einen Phosphatsäurerest miteinander verbunden sind. Von der Struktur her ist die Ribonukleinsäure also ähnlich wie die Desoxyribonukleinsäure (DNA, Desoxy-Ribonucleic Acid) aufgebaut, welche die menschliche Erbsubstanz bildet. Es gibt aber auch Unterschiede (Abb. 1) [1, 2]:
- Im Gegensatz zur DNA ist die RNA meist einsträngig. Dadurch bedingt hat das Molekül mehr Möglichkeiten, dreidimensionale Strukturen zu bilden, und kann chemische Reaktionen eingehen, die bei der DNA nicht möglich sind.
- Die RNA enthält das Monosaccharid Ribose statt Desoxyribose. Damit ist eine RNA weniger stabil als eine DNA, da die zusätzliche Hydroxyl-Gruppe der Ribose eine Hydrolyse durch Basen und damit den Abbau der RNA ermöglicht.
- Zudem erhält die RNA die Nukleobase Uracil statt Thymidin, die stattdessen in der DNA vorkommt.
RNA und DNA weisen demnach zwar ähnliche molekulare Strukturen auf, die sich aber in wichtigen Punkten voneinander unterscheiden. Daher kann eine RNA normalerweise nicht in das menschliche Erbgut integriert werden, zumal die dafür notwendigen Enzyme in der Zelle nicht vorhanden sind [3]. Zudem ist RNA, die in menschliche Zellen eingeschleust wird, im Zellplasma lokalisiert und gelangt von dort nicht in den Zellkern. Darüber hinaus ist RNA von Natur aus sehr instabil und wird im Körper schnell abgebaut [3]. Diese Aspekte sprechen dafür, dass RNA-basierte Impfungen oder Therapien keine Veränderungen des Erbguts hervorrufen können, diesbezüglich also sehr sichere Behandlungen sind. Andererseits bietet die hohe Instabilität der RNA keine optimale Voraussetzung für einen Impfstoff oder ein Arzneimittel, das in die Zellen gelangen und dort langfristig wirken soll. Daher werden RNA-basierte Wirkstoffe in der Regel durch chemische Modifikationen stabilisiert und durch eine „Verpackung“ z. B. in Form von sogenannten Nanopartikeln geschützt [4].
RNA mit verschiedenen Funktionen
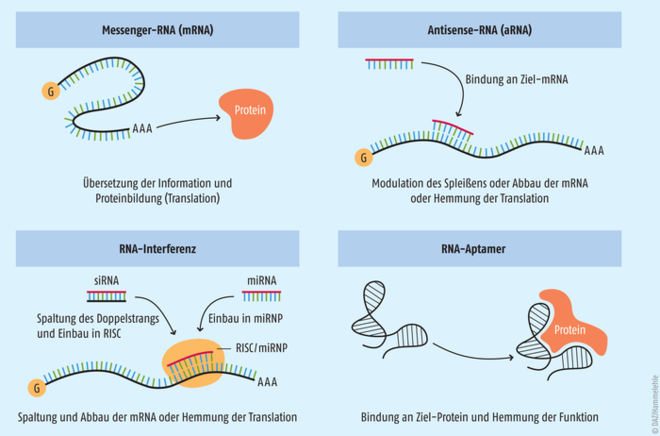
Es gibt mehrere Klassen von Ribonukleinsäuren, die unterschiedliche Funktionen wahrnehmen können. Hierzu gehören unter anderem (Abb. 2) [1, 2, 4–6]:
- Messenger-RNA (mRNA) kopieren die in einem Gen auf der DNA liegenden Informationen und gelangen dann vom Zellkern zu den Ribosomen im Zytoplasma. Dort kann mithilfe der kopierten Informationen die Proteinbiosynthese stattfinden.
- Antisense-RNA (aRNA) sind einzelsträngige RNA, die komplementär zu jeweils einer mRNA sind. In der Zelle entstehen aRNA dann, wenn im Rahmen der Transkription nicht nur der kodierende DNA-Strang in mRNA, sondern auch der dazu komplementäre nicht kodierende DNA-Strang in eine Antisense-RNA übersetzt wird. Über aRNA kann in der Zelle die Proteinbiosynthese reguliert werden, indem sie an die passende Messenger-RNA binden und so die Translation dieser mRNA in Protein hemmen oder den Abbau der mRNA induzieren. Antisense-RNA kann auch die Weiterverarbeitung (Spleißen) der sogenannten Vorläufer-mRNA (prä-mRNA) zu mRNA modulieren.
- Small interfering RNA (siRNA) sind kleine doppelsträngige RNA-Fragmente. Diese entstehen durch Spaltung einer langen doppelsträngigen RNA, die meist von außen, z. B. durch Infektion mit einem RNA-Virus, in den Organismus gelangt. siRNA spielt bei der zielgerichteten Abschaltung von Genen eine wichtige Rolle. Dieser natürliche Schutzmechanismus der Zelle gegen zellfremde RNA wird auch RNA-Interferenz (RNAi) bzw. RNA-Silencing genannt. Dabei wird der Doppelstrang der siRNA aufgespalten und einer der entstehenden Einzelstränge in einen „RNA-Induced Silencing Complex (RISC)“ eingebaut. Der kann dann über die eingebaute siRNA an die Ziel-mRNA binden und diese spalten bzw. abbauen.
- Micro-RNA (miRNA) haben im Rahmen der RNA-Interferenz eine ähnliche Funktion wie siRNA. Allerdings sind miRNA kleine, einsträngige RNA-Moleküle, die von spezifischen Genen innerhalb der Zelle hergestellt werden. Diese werden in einen Ribonukleoprotein-Komplex aufgenommen (miRNP), der eine große Ähnlichkeit zum RISC-Komplex aufweist. Im Gegensatz zur siRNA ist die Paarung mit der Ziel-mRNA bei miRNA häufig nicht perfekt. Dadurch bedingt kann eine miRNA die Translation mehrerer verschiedener mRNA-Sequenzen hemmen. Micro-RNA dienen der Regulation zellulärer Prozesse wie z. B. Proliferation und Zelltod.
- RNA-Aptamere sind künstlich hergestellte kurze einzelsträngige RNA-Oligonukleotide mit einer Länge von 25 bis 70 Basen. Die können eine 3D-Struktur ausbilden und sind deswegen in der Lage, mit hoher Spezifität jeweils an ein bestimmtes Molekül (z. B. Protein, bakterielle Gifte, niedermolekulare Stoffe wie Antibiotika und Aminosäuren, Viruspartikel) zu binden und dieses zu inaktivieren.
Daneben ist in den menschlichen Zellen noch eine Reihe weiterer RNA-Klassen nachweisbar, z. B. ribosomale RNA (rRNA), die am Aufbau der Ribosomen beteiligt ist, sowie Transfer-RNA (tRNA), die bei der Translation im Rahmen der Proteinbiosynthese einzelne Aminosäuren aus dem Zytoplasma aufnimmt und zum Ribosom transportiert. In den letzten Jahren wurde zudem eine weitere Klasse von RNA entdeckt und erforscht, die zirkuläre RNA (circRNA). Die ringförmigen RNA-Moleküle sind aufgrund ihrer Struktur stabiler und weniger anfällig für Abbau. Die Funktion der meisten circRNA ist noch nicht abschließend geklärt, aber von einigen ist bekannt, dass sie die Wirkung von miRNA steuern [7]. Auch bei der Pathogenese von Morbus Alzheimer spielt circRNA eine Rolle [8]. Eine aktuelle Studie zeigt zudem, dass circRNA die Lebensspanne von Fruchtfliegen über den Insulinsignalweg verlängert, was möglicherweise auch von Bedeutung für den Alterungsprozess des menschlichen Organismus ist [9]. Zirkuläre RNA könnte aufgrund ihrer Stabilität in Zukunft auch ein wichtiger Wirkstoff für längerfristige therapeutische Anwendungen werden [5]. In der Regel dient die RNA somit als Überträgerin bzw. Übersetzerin genetischer Informationen oder spielt bei der Regulation der Gene eine wichtige Rolle. Darüber hinaus nutzen zahlreiche Viren, wie z. B. Coronaviren, HI- und Ebola-Viren, Doppel- oder Einzelstrang-RNA statt DNA als Erbsubstanz.
Auf Basis der unterschiedlichen RNA-Klassen lassen sich Vakzine bzw. Arzneimittel herstellen, die im Rahmen der Impfung gegen SARS-CoV-2 oder auch zur Behandlung verschiedener Erbkrankheiten bereits zum Einsatz kommen (s. Tab.). Darüber hinaus sind zahlreiche weitere RNA-basierte Therapien und Impfstoffe in der Entwicklung.
Präparat (Handelsname) / Hersteller | eingesetzte RNA | Indikation | Target |
|---|---|---|---|
mRNA-basierte Impfstoffe | |||
Tozinameran (Comirnaty®)/Biontech / Pfizer | synthetisch hergestellte mRNA | Prophylaxe gegen Infektion mit dem Coronavirus SARS-CoV-2 (COVID-19) | Translation in virenspezifisches Antigen → Aktivierung des Immunsystems |
COVID-19 Vaccine Moderna /Moderna | synthetisch hergestellte mRNA | Prophylaxe gegen Infektion mit dem Coronavirus SARS-CoV-2 (COVID-19) | Translation in virenspezifisches Antigen → Aktivierung des Immunsystems |
Antisense-RNA-basierte Therapien | |||
Inotersen (Tegsedi®) / Akcea Therapeutics | synthetisch hergestellte aRNA | hereditäre Transthyretin-Amyloidose mit Polyneuropathie der Stadien I oder II | selektive Bindung an mRNA des Transthyretins → Hemmung der Biosynthese von mutiertem und Wildtyp-Transthyretin |
Nusinersen (Spinraza®) / Biogen/Ionis Pharmaceuticals | synthetisch hergestellte aRNA | 5q-assoziierte spinale Muskelatrophie | Bindung an die prä-mRNA des SMN2-Gens und Modifikation des Spleißvorgangs→ vermehrte Bildung des SMN-Proteins, das für das Überleben der Motoneurone notwendig ist |
Volanesorsen (Waylivra®) / Akcea Therapeutics | synthetisch hergestellte aRNA | unterstützende Therapie bei familiärem Chylomikronämie-Syndrom | selektive Bindung an mRNA von Apolipoprotein C3 (APOC3)→ Hemmung der Biosynthese von APOC3, das im Fettstoffwechsel eine Rolle spielt. Dadurch können Chylomikronen wieder abgebaut werden. |
RNA-Interferenz-basierte Therapien | |||
Givosiran (Givlaari®) /Alnylam Pharmaceuticals | synthetisch hergestellte siRNA | akute hepatische Porphyrie | RNA-Interferenz an der mRNA von Delta-Aminolävulinatsynthase (ALAS1)→ Abbau der ALAS1-mRNA in den Leberzellen. Dadurch reduziert sich der Plasmaspiegel der neurotoxischen Zwischenprodukte Aminolävulinsäure und Porphobilinogen, die als wichtigste Faktoren der akuten hepatischen Porphyrie gelten. |
Lumasiran (Oxlumo®) /Alnylam Pharmaceuticals | synthetisch hergestellte siRNA | primäre Hyperoxalurie Typ 1 | RNA-Interferenz an der mRNA von Hydroxysäureoxidase 1 (HAO1)→ Abbau der HAO1-mRNA; dadurch wird die Menge des von der Leber produzierten Enzyms Glykolatoxidase reduziert, das an der Oxalatproduktion beteiligt ist: Oxalatspiegel in Urin und Blut sinken |
Patisiran (Onpattro®) /Alnylam Pharmaceuticals | synthetisch hergestellte siRNA | hereditäre Transthyretin-Amyloidose mit Polyneuropathie der Stadien I oder II | RNA-Interferenz an der mRNA von mutiertem und Wildtyp-Transthyretin (TTR)→ Abbau der TTR-mRNA in den Leberzellen und dadurch Hemmung der Biosynthese von mutiertem und Wildtyp-Transthyretin |
mRNA: Messenger-RNA, aRNA: Antisense-RNA, siRNA: small interfering RNA | |||
Impfstoffe auf Basis von mRNA
Vakzine gegen COVID-19
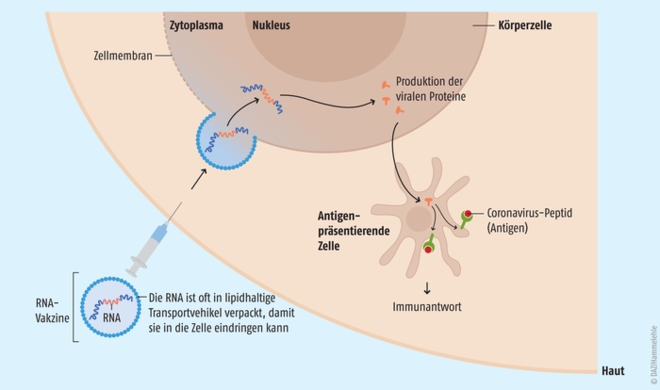
Eine Impfung beruht darauf, dass das Immunsystem des Körpers lernen kann, eine Infektion mit Krankheitserregern, wie z. B. dem Coronavirus, zu erkennen und adäquat zu reagieren. Vakzine gegen SARS-CoV-2, die auf mRNA basieren, enthalten daher eine mittels gentechnischer Methoden synthetisierte mRNA, die für ein spezifisches Eiweiß des SARS-CoV-2 kodiert. Hier wird das „Spike-Protein“ gewählt, da dieses für die Anheftung von SARS-CoV-2 an die menschliche Zelle notwendig ist und gleichzeitig ein wirksames Antigen darstellt. Die mRNA kann zusätzlich eine sogenannte Replikase enthalten ‒ ein Enzym, das die eigenständige Vervielfachung der Ribonukleinsäure in der Zelle ermöglicht [10]. In diesem Fall spricht man auch von einer selbst-amplifizierenden mRNA (samRNA). Damit können trotz deutlich reduzierter Dosierung des Impfstoffs sehr schnell Tausende von mRNA-Kopien pro Zelle vorliegen, wodurch größere Antigenmengen exprimiert werden als bei nicht-replizierenden mRNA. Beim Einsatz von selbst-amplifizierenden mRNA ist eine geringere Impfdosis notwendig, das Molekül ist aber auch größer und anfälliger für Ablesefehler. Andererseits ist sich nicht selbst vermehrende mRNA einfacher aufgebaut und enthält keine weiteren Proteine, die eine ungewollte Immunantwort hervorrufen könnten. Nach der Synthese der mRNA wird üblicherweise wie folgt weiter vorgegangen (Abb. 3) [11 – 13]:
- Die mRNA wird vor der Injektion meist noch chemisch modifiziert, stabilisiert und in Lipid-Nanopartikel verpackt. Diese kleinen, kugelförmigen Kapseln (60 bis 80 nm) schützen die empfindliche mRNA und sorgen gleichzeitig für deren effiziente Aufnahme in die Zellen, da sie mit der Zellmembran verschmelzen können.
- Der RNA-Impfstoff wird dann mittels herkömmlicher Spritzen intravenös, intradermal oder intramuskulär injiziert oder auch per Impfpistole durch hohen Druck ‒ ohne Verwendung einer Kanüle ‒ subkutan oder intradermal verabreicht („nadelfreie Injektion“).
- Die applizierte mRNA wird in die Zellen des menschlichen Organismus transportiert. Dort lesen Ribosomen, die als „Proteinfabriken“ der Zelle fungieren, die kodierte Erbinformation ab (Translation), anhand derer das virusspezifische Protein gebildet und im Körper freigesetzt werden kann. Dies erkennt das Immunsystem als „köperfremdes“ Antigen, bekämpft es über verschiedene Abwehrmechanismen und wird gleichzeitig „trainiert“, bei zukünftigen Infektionen schneller und effektiver zu reagieren.
Aktuell (Stand 9. Februar 2021) sind in Deutschland bzw. der Europäischen Union zwei mRNA-basierte Impfstoffe gegen SARS-CoV-2 zugelassen: Tozinameran (Comirnaty®) von Biontech/Pfizer (Zulassung: 21. Dezember 2020) und die COVID-19-Vaccine Moderna von Moderna (Zulassung: 6. Januar 2021) [14, 15]. Mit CVnCoV von CureVac steht der nächste mRNA-basierte COVID-19-Impfstoffkandidat vor der europäischen Zulassung. Gleichzeitig forscht das Unternehmen zusammen mit dem britischen Pharmaunternehmen GlaxoSmithKline bereits an einem Impfstoff der nächsten Generation gegen mutierte Varianten von SARS-CoV-2 [16].
Neben COVID-19 sind auch andere virale Erkrankungen Ziel einer möglichen RNA-basierten Impfung. So wird die Entwicklung von RNA-Impfstoffen gegen das Influenzavirus durch europäische Forschungsprojekte wie UniVax vorangetrieben [17]. Auch zu RNA-basierten Impfungen gegen das Rabiesvirus, den Verursacher der Tollwut, wurden bereits Studien durchgeführt [18].
Krebs
Das Prinzip der mRNA-basierten Impfung ist aber nicht nur bei der Prophylaxe gegen Infektionskrankheiten wie COVID-19 eine Option, sondern kann auch als therapeutische Impfung gegen verschiedene Krebserkrankungen zum Einsatz kommen. Hierzu werden Proteine auf der Oberfläche der Krebszellen identifiziert, die charakteristisch für den jeweiligen Tumor sind. Die entsprechende kodierende mRNA wird dann dem Patienten verabreicht, der daraufhin eine spezifische Immunantwort gegen die Tumorzellen entwickelt [19]. Die Ärzte können damit eine Therapie anwenden, die spezifisch auf den Patienten und seinen Krebs zugeschnitten ist. Bislang ist in Deutschland noch kein Impfstoff gegen eine Krebserkrankung zugelassen. Laut dem Verband Forschender Arzneimittelhersteller (VFA) laufen in Deutschland derzeit aber Untersuchungen zur therapeutischen Impfung beim nicht kleinzelligen Lungenkarzinom bzw. beim Melanom (jeweils Wirkstoff: RO7198457), die bis zum Jahr 2023 zu einer Zulassung führen könnten [20].
Therapien mit Antisense-RNA
Eine weitere Option für eine RNA-basierte Therapie bietet die Antisense-RNA. Durch die spezifische Bindung der einzelsträngigen aRNA an die komplementäre Zielsequenz der mRNA kann der Abbau dieser mRNA induziert oder deren Translation blockiert werden [4]. Dadurch lässt sich die Produktion bestimmter Proteine gezielt hemmen. So können Erkrankungen wie die hereditäre Amyloidose oder das familiäre Chylomikronämie-Syndrom positiv beeinflusst werden [21, 22]. Antisense-RNA kann auch die Weiterverarbeitung (Spleißen) von Vorläufer-mRNA (prä-mRNA) zu mRNA modulieren, so dass z. B. von einem notwendigen Protein eine größere Menge gebildet werden kann. Dieser Mechanismus spielt bei der Behandlung von spinaler Muskelatrophie eine Rolle [23]. In Deutschland sind derzeit drei Arzneimittel auf Basis von Antisense-RNA zugelassen:
- Nusinersen (Spinraza®) zur Behandlung der 5q-assoziierten spinalen Muskelatrophie [24],
- Inotersen (Tegsedi®) zur Behandlung von erwachsenen Patienten mit hereditärer Transthyretin-Amyloidose und Polyneuropathie der Stadien 1 oder 2 [25] und
- Volanesorsen (Waylivra®) zur unterstützenden Behandlung bei erwachsenen Patienten mit genetisch bestätigtem familiärem Chylomikronämie-Syndrom und einem hohen Risiko für Pankreatitis, wenn diese auf eine Diät und eine Triglycerid-senkende Therapie unzureichend ansprechen [26].
Mit Fomivirsen (Vitravene®) war noch ein weiteres Antisense-RNA-Arzneimittel zugelassen, das bei immundefizienten Patienten zur Behandlung von okulären Infektionen mit dem Cytomegalievirus eingesetzt wurde. Die Zulassung wurde in der EU allerdings im Jahr 2002 aus wirtschaftlichen Gründen zurückgezogen [27]. Weitere aRNA-basierte Arzneimittel gegen Chorea Huntington und amyotrophe Lateralsklerose, die bis zum Jahr 2023 zu einer Zulassung führen könnten, befinden sich in Deutschland derzeit in der Entwicklungsphase [20]. Retinitis pigmentosa, zystische Fibrose und Lebersche kongenitale Amaurose sind ebenfalls Erkrankungen, bei denen der therapeutische Einsatz von Antisense-RNA erforscht wird [5].
RNA-Interferenz-basierte Therapien (siRNA, miRNA)
Der Mechanismus der RNA-Interferenz kann auch therapeutisch genutzt werden. Dazu wird siRNA oder auch miRNA injiziert, die spezifisch auf das mRNA-Transkript desjenigen Gens abzielt, dessen kodiertes Protein bei der zu behandelnden Erkrankung eine wichtige Rolle spielt. Dadurch wird die entsprechende mRNA blockiert oder gespalten. In Deutschland sind derzeit drei Arzneimittel zugelassen, deren Wirkprinzip auf der RNA-Interferenz mittels siRNA basiert:
- Patisiran (Onpattro®) zur Behandlung von erwachsenen Patienten mit hereditärer Transthyretin-Amyloidose und Polyneuropathie der Stadien 1 oder 2 [28],
- Givosiran (Givlaari®) zur Behandlung einer akuten hepatischen Porphyrie bei Erwachsenen und Jugendlichen ab zwölf Jahren [29] und
- Lumasiran (Oxlumo®) zur Behandlung der primären Hyperoxalurie Typ 1 bei Patienten aller Altersgruppen [30].
Mit Lademirsen befindet sich ein Arzneimittel gegen hereditäre Nephritis (Alport Syndrom) derzeit in der Entwicklungsphase, das auf miRNA basiert und in Deutschland bis 2023 eine Zulassung erhalten könnte. Auch das siRNA-Medikament Fitusiran wird im Rahmen einer Studie zur Antithrombintherapie an Hämophilie-Patienten untersucht [20]. Allerdings ist diese Studie aktuell wegen des Auftretens unerwarteter Nebenwirkungen gestoppt [31]. Darüber hinaus wurden oder werden derzeit zahlreiche weitere Studien mit RNA-Interferenz-basierten Therapien unter anderem zur Behandlung von chronischer Hepatitis B, nichtalkoholischer Steatohepatitis, klarzelligem Nierenzellkarzinom und Pankreaskarzinom durchgeführt [5].
Behandlung mit RNA-Aptameren
Im Gegensatz zu den oben beschriebenen Antisense-RNA- und RNA-Interferenz-basierten Therapien, die auf mRNA abzielen, können RNA-Aptamere aufgrund ihrer dreidimensionalen Struktur direkt an Proteine binden und deren Funktion blockieren. Dazu werden RNA-Aptamere in einem Verfahren ausgewählt, das als „systematische Evolution von Liganden durch exponentielle Anreicherung” (Systematic Evolution of Ligands by EXponential Enrichment oder SELEX) bezeichnet wird [32]. Im Rahmen dieses Prozesses wird zunächst durch Synthese einer sehr großen Anzahl von unterschiedlichen RNA-Oligonukleotiden (bis zu 1016) eine sogenannte Molekülbibliothek erstellt. Aus der können dann durch wiederholtes Selektionieren, Separieren und gezieltes Vermehren diejenigen Sequenzen ausgewählt werden, die sehr spezifisch und mit hoher Affinität an die gewünschte Proteinstruktur binden [33]. RNA-Aptamere funktionieren ähnlich wie Antikörper, sind aber einfacher herzustellen, und ihre geringe Größe ermöglicht die Interaktion mit den schwer zugänglichen Bindungsstellen eines Zielproteins. Zudem sind sie strukturstabil und hitzebeständig [32].
Auf einen Blick
- Die RNA ähnelt von ihrer molekularen Struktur her zwar der menschlichen Erbsubstanz DNA, weist aber im Vergleich zu dieser auch einige Unterschiede auf. So ermöglicht die Einzelsträngigkeit der RNA chemische Reaktionen, die mit der DNA nicht möglich sind. Allerdings ist die RNA auch instabiler als DNA und wird im Körper rasch abgebaut, was für den therapeutischen Einsatz von Nachteil sein kann.
- Von der RNA gibt es verschiedene Klassen mit unterschiedlichen Funktionen. So überträgt mRNA genetische Informationen, die mithilfe von rRNA und tRNA in Proteine übersetzt werden. Bei der Regulation der Genexpression spielen unter anderem aRNA sowie siRNA und miRNA eine wichtige Rolle.
- Aktuell sind mRNA-basierte Impfungen gegen SARS-CoV-2 ein wichtiger Baustein zur Bekämpfung der COVID-19-Pandemie. Hier wurden in der Europäischen Union bisher zwei Impfstoffe zugelassen.
- Es kommen auch bereits einige Therapien, die auf verschiedenen RNA-Klassen basieren, gegen erblich bedingte Erkrankungen zum Einsatz oder befinden sich in der Entwicklungsphase.
- Die gRNA ist Teil der CRISPR / Cas-Genschere, die in Zukunft eine wichtige Rolle bei der Behandlung verschiedener Erkrankungen spielen könnte.
In Deutschland wurde mit Pegaptanib (Macugen®) bereits im Jahr 2006 das erste RNA-Aptamer zugelassen zur Behandlung der neovaskulären (feuchten) altersabhängigen Makuladegeneration (AMD) bei Erwachsenen [34]. Pegaptanib wird intravitreal verabreicht und bindet an den Wachstumsfaktor VEGF-A 165 (VEGF: Vascular Endothelial Growth Factor), der bei der Angiogenese und Regulation der Gefäßdurchlässigkeit eine wichtige Rolle spielt, die wiederum entscheidende Faktoren für den Sehverlust bei AMD sind [35]. Da es mittlerweile wirksamere Medikamente gibt, wurde Pegaptanib inzwischen vom Markt genommen. Derzeit wird Avacincaptad Pegol (Zimura), ein Inhibitor des Komplementsystems C5 in Kombination mit Ranibizumab (Lucentis®) zur Therapie der AMD klinisch erprobt [32]. Auch bei der Behandlung des Glioblastoms und des Pankreaskarzinoms sowie weiterer Indikationen wird der Einsatz von Aptameren aktuell untersucht [5].
RNA spielt bei der „Genschere“ eine wichtige Rolle
Zu den RNA-basierten Therapeutika zählt auch die Gruppe der Guide-RNA (gRNA) [36]. Diese kommen im Rahmen der CRISPR / Cas-Methode (CRISPR: Clustered Regularly Interspaced Short Palindromic Repeats, Cas: CRISPR associated proteins) zum Einsatz, mit deren Hilfe sich DNA gezielt schneiden und verändern lässt. Guide-RNA sind kurze synthetisch hergestellte einzelsträngige RNA-Sequenzen, die einen Molekülteil für die Bindung an das Cas9-Protein enthalten sowie eine spezifische Sequenz von etwa 20 Nukleotiden, die komplementär an die Ziel-DNA-Sequenz binden kann [37]. So wird das Cas9-Protein an die „richtige Stelle“ der DNA gebracht, an der dann gezielt Doppelstrangbrüche erzeugt werden sollen. Durch diese Methode können Gensequenzen vollständig eliminiert werden. Arzneimittel, die dieses Prinzip nutzen, z. B. zur Behandlung von Beta-Thalassämie, Sichelzellanämie oder Hämophilie A sind derzeit in der klinischen Erprobung [38]. |
Literatur
[1] Ribonukleinsäure. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Ribonukleinsäure, Abruf am 8. Februar 2021
[2] Ribonukleinsäure. www.chemie.de, www.chemie.de/lexikon/Ribonukleinsäure.html, Abruf am 8. Februar 2021
[3] Probst J. Messenger RNA-basierte Impfstoffe zur Behandlung. Biospektrum 2007;1:49-51
[4] Kim Y-K. RNA Therapy: Current Status and Future Potential. Chonnam Med J 2020;56:87-93
[5] Dammes N, Peer D. Paving the Road for RNA Therapeutics. Trends in Pharmacological Sciences 2020;41:755-775
[6] Aptamer. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Aptamer, Abruf am 12. Februar 2021
[7] Memczak S, Jens M, Elefsinioti A, Torti F, Krueger J, Rybak A, Maier L, Mackowiak SD, Gregersen LH, Munschauer M, Loewer A, Ziebold U et al. Circular RNAs are a large class of animal RNAs with regulatory potency. Nature 2013;495:333-338
[8] Dube U, Del-Aguila JL, Li Z, Budde JP, Jiang S, Hsu S, Ibanez L, Fernandez MV, Farias F, Norton J, Gentsch J, Wang F et al. An atlas of cortical circular RNA expression in Alzheimer disease brains demonstrates clinical and pathological associations. Nat Neurosci 2019;22:1903-1912
[9] Weigelt CM, Sehgal R, Tain LS, Cheng J, Eßer J, Pahl A, Dieterich C, Grönke S, Partridge L. An Insulin-Sensitive Circular RNA that Regulates Lifespan in Drosophila. Mol Cell 2020;79:268-279.e5
[10] Jackson NAC, Kester KE, Casimiro D, Gurunathan S, DeRosa F. The promise of mRNA vaccines: a biotech and industrial perspective. NPJ Vaccines 2020;5
[11] Callaway E. The race for coronavirus vaccines: a graphical guide. Nature 2020;580:576-577
[12] Wie berechtigt sind Hoffnungen auf RNA-Impfstoffe gegen SARS-CoV-2? Science Media Center Germany gGmbH (SMC), www.sciencemediacenter.de/alle-angebote/fact-sheet/details/news/wie-berechtigt-sind-hoffnungen-auf-rna-impfstoffe-gegen-sars-cov-2/, Abruf am 4. Mai 2020
[13] Roier S, Petsch B. Design und Funktionsweise von mRNA-basierten Impfstoffen zum Schutz vor Infektionskrankheiten. www.trillium.de/zeitschriften/trillium-immunologie/archiv/ausgaben-2019/heft-32019/aus-der-grundlagenforschung/design-und-funktionsweise-von-mrna-basierten-impfstoffen-zum-schutz-vor-infektionskrankheiten.html, Abruf am 8. Mai 2020, Trillium Immunologie 2019;3
[14] Produktinformation Comirnaty. European Commission, https://ec.europa.eu/health/documents/community-register/html/h1528.htm, Abruf am 9. Februar 2021
[15] Produktinformation COVID-19 Vaccine Moderna. European Commission, https://ec.europa.eu/health/documents/community-register/html/h1507.htm, Abruf am 9. Februar 2021
[16] GSK und CureVac entwickeln mRNA-Impfstoff der nächsten Generation gegen COVID-19 – gemeinsame Pressemitteilung. Informationen der Curevac, www.curevac.com/2021/02/03/gsk-und-curevac-entwickeln-mrna-impfstoff-der-naechsten-generation-gegen-covid-19/, Abruf am 11. Februar 2021
[17] UniVax’s overall goal. Informationen der UniVax, https://univax-fp7.eu/index.php?id=1292, Abruf am 12. Februar 2021
[18] Armbruster N, Jasny E, Petsch B. Advances in RNA Vaccines for Preventive Indications: A Case Study of a Vaccine against Rabies. Vaccines 2019;7:132
[19] Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines — a new era in vaccinology. Nature Reviews Drug Discovery 2018;17:261-279
[20] Perspektive 2023: neue Medikamente in Entwicklung. Verband Forschender Arzneimittelhersteller e. V. (vfa), www.vfa.de/download/perspektive-2023-broschuere.pdf, Abruf am 12. Februar 2021
[21] Inotersen. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Inotersen, Abruf am 10. Februar 2021
[22] Volanesorsen. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Volanesorsen, Abruf am 10. Februar 2021
[23] Nusinersen. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Nusinersen, Abruf am 10. Februar 2021
[24] Fachinformation Spinraza®. Stand August 2019, www.fachinfo.de.
[25] Fachinformation Tegsedi®. Stand Oktober 2020, www.fachinfo.de.
[26] Fachinformation Waylivra®, Stand Mai 2020, www.fachinfo.de.
[27] Fomivirsen. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Fomivirsen Abruf am 12. Februar 2021
[28] Fachinformation Onpattro®, Stand November 2020, www.fachinfo.de.
[29] Fachinformation Givlaari®, Stand März 2020, www.fachinfo.de.
[30] Fachinformation Oxlumo®, Stand November 2020, www.fachinfo.de.
[31] Global dosing hold in fitusiran trials initiated by Sanofi Genzyme to investigate new adverse events. WFH Network, https://news.wfh.org/global-dosing-hold-in-fitusiran-trials-initiated-by-sanofi-genzyme-to-investigate-new-adverse-events/, Abruf am 12. Februar 2021
[32] Gopinath RK. RNA Therapeutics: An Overview. https://geneonline.news/en/rna-therapeutics-an-overview/, Abruf am 11. Februar 2021
[33] SELEX. chemie.de, www.chemie.de/lexikon/SELEX.html Abruf am 11. Februar 2021
[34] Fachinformation Macugen®. Stand August 2012);www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Risikoinformationen/RI_rhb/info-macugen-fi.pdf?__blob=publicationFile&v=3
[35] Pegaptanib. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Pegaptanib, Abruf am 11. Februar 2021
[36] Oberle D, Mentze D, Weber G. Befragung zur Verträglichkeit der Impfstoffe gegen das neue Coronavirus (SARS-CoV-2) mittels Smartphone-App SafeVac 2.0. Bulletin zur Arzneimittelsicherheit 2020;4:27-31, Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Bulletin/2020/4-2020.pdf, Abruf am 10. Februar 2021
[37] Guide-RNA. DocCheck-Flexikon, https://flexikon.doccheck.com/de/Guide-RNA, Abruf am 12. Februar 2021
[38] CRISPR/Cas9: Von Genomchirurgie und Genome Editing. Verband Forschender Arzneimittelhersteller e.V. (vfa), www.vfa-bio.de/vb-de/aktuelle-themen/forschung/von-genomchirurgie-und-genome-editing.html, Abruf am 12. Februar 2021
[39] DNA vs. RNA. Biology Dictionary, https://biologydictionary.net/dna-vs-rna/, Abruf am 12. Februar 2021






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.