
- DAZ.online
- DAZ / AZ
- DAZ 3/2020
- Wenn Vancomycin versagt
Infektiologie
Wenn Vancomycin versagt
Resistente Enterokokken bereiten Probleme
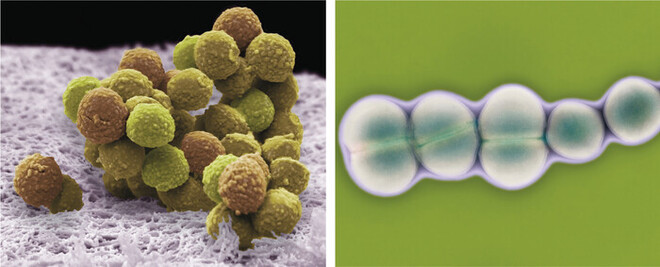
Enterokokken sind kugelförmige, fakultativ anaerobe, kettenförmig angeordnete, grampositive Bakterien (Abb. 1) [1, 2]. Bekannte Vertreter sind Enterococcus faecalis und Enterococcus faecium. Sie gehören zum natürlichen Mikrobiom des Menschen und besitzen als opportunistische Erreger große humanpathogene Bedeutung [1, 3].
Abb. 1:Mikroskopische Aufnahme von Staphylokokken und Enterokokken. Während Staphylokokken (links) in Trauben zusammengelagert sind, bilden Enterokokken kettenförmige Strukturen (rechts).
Ihre hohe Widerstandsfähigkeit gegenüber Umwelteinflüssen wie Trockenheit und Hitze kann Enterokokken zu Problemkeimen machen, denn diese große Überlebensfähigkeit steigert die Wahrscheinlichkeit einer Übertragung [3]. Verschärfend weisen Enterokokken eine natürliche Resistenz gegen eine Vielzahl von Antibiotika auf (Tab. 1). Diese verschiedene Substanzklassen umfassenden natürlichen Resistenzen schränken die Therapiemöglichkeiten von Enterokokken-Infektionen ein. Zusätzlich können Resistenzen gegen weitere Antibiotika erworben werden. Dies geschieht durch spontane Mutationen oder den Austausch resistenzvermittelnder Gene.
natürliche Resistenzen | |
Substanzklasse | Beispiel |
Cephalosporine | Cefuroxim |
Semisynthetische Penicilline | Flucloxacillin |
Monobactame | Aztreonam |
Aminoglykoside | Gentamicin (low-level)* |
Lincosamide | Clindamycin |
Polymyxine | Colistin |
spezifische Resistenzen | |
Spezies | Substanz |
E. gallinarum | Vancomycin (low-level)* |
E. casseliflavus | Vancomycin (low-level)* |
E. faecalis | Streptogramine, Mupirocin |
E. faecium | Ampicillin, Amoxicillin, Piperacillin |
* Low-level-Resistenz: Die wachstumshemmende Konzentration des Antibiotikums ist wenige Potenzen über der Grenzkonzentration für eine Resistenz. | |
Vancomycin-resistente Enterokokken
Die bedeutendsten Einschränkungen der Therapieoptionen resultieren aus Resistenzen gegen Gyrasehemmer (z. B. Ciprofloxacin), sogenannte High-level-Resistenzen gegen Aminoglykoside (Widerstandsfähigkeit gegen hohe Antibiotika-Konzentrationen) und vor allem Resistenzen gegen Vancomycin. Vancomycin-Resistenzen sind eine Unempfindlichkeit gegenüber dem wichtigsten Reserveantibiotikum für Infektionen mit grampositiven Bakterien [6].
Das Glykopeptid Vancomycin wurde erstmals 1953 aus dem Bakterium Amycolatopsis orientalis isoliert [9]. Es hemmt die Zellwandsynthese der Bakterien, indem die Quervernetzung der Muraminsäure-Ketten inhibiert wird [3]. Dabei wird die natürliche Peptidseitenkette des Muramyl-Pentapeptids, einer Zellwandvorstufe, von Vancomycin blockiert [10]. Die Resistenzen von Enterokokken gegen Vancomycin beruhen auf Veränderungen dieser Peptidseitenkette [10]. Vancomycin-resistente Enterokokken verändern diese Sequenz von D-Ala-D-Ala zu D-Ala-D-Lac (Resistenz vom VanA-Typ und Resistenz vom VanB-Typ oder D-Ala-D-Ser (VanC-Typ) [3]. Durch diese Modifikation wird die Affinität von Glykopeptiden zur Zielstruktur reduziert, wobei der VanA-Resistenztyp sowohl gegen Vancomycin als auch gegen Teicoplanin resistent ist, während der VanB-Resistenztyp für Teicoplanin sensibel bleibt. Obwohl Resistenzgene gegen Vancomycin bereits 30.000 Jahre alt sind, hat erst der Selektionsdruck durch Gebrauch von Antibiotika zu ihrer weltweiten Ausbreitung geführt [7]. Vancomycin-resistente Enterokokken wurden erstmals 1988 klinisch beschrieben [8]. In den USA wird inzwischen angenommen, dass über 50% der Enterococcus-faecium-Isolate resistent gegen Vancomycin sind [1]. Auch im Alltag deutscher Kliniken sind Vancomycin-resistente Enterokokken ständig präsent, wie die Antibiogramme klinischer Patientenisolate des Universitätsklinikums Heidelberg beispielhaft zeigen (Tab. 2).
Einteilung der Vancomycin-Resistenzen
Vancomycin-Resistenzen werden in verschiedene Klassen eingeteilt. Obwohl neun Vancomycin-Resistenzklassen beschrieben sind, sind nur die Typen VanA, VanB und in geringem Maße VanC klinisch relevant (Tab. 3). Bei Resistenzen vom Typ VanC handelt es sich um Low-level-Resistenzen, die natürlich bei E. casseliflavus und E. gallinarum vorkommen und nicht zwischen Bakterien ausgetauscht werden können [11]. High-level-Resistenzen durch VanA- und VanB-Resistenzgene sind transposon- oder plasmidcodiert und können zwischen einzelnen Bakterienarten übertragen werden [3].
Die antimikrobielle Aktivität kann in vitro über die minimale Hemmkonzentration (MHK) bestimmt werden. Während Vancomycin-empfindliche Bakterien eine typische minimale Hemmkonzentration für Vancomycin zwischen 0,5 und 2 mg/l aufweisen, können VanA-Resistenzen zu MHK von über 1000 mg/l führen [3].
Die verschiedenen Resistenztypen unterscheiden sich nicht nur in ihrer Empfindlichkeit gegen Vancomycin, sondern auch gegenüber anderen Vancomycin-Derivaten wie dem Lipoglykopeptid Teicoplanin. Während Stämme mit VanC- und VanB-Resistenzen für Teicoplanin sensitiv sind, sind Stämme mit VanA-Resistenzen nicht empfindlich [3]. Das liegt daran, dass Vancomycin die Expression von VanA- und VanB-Resistenzgenen induziert, während Teicoplanin nur die Expression von VanA-Resistenzgenen induziert [4].
Resistenzklasse | VanA | VanB | VanC |
|---|---|---|---|
Vancomycin-Sensitivität | – | – | |
Teicoplanin-Sensitivität | – | + | + |
Expression | induzierbar | induzierbar | konstitutiv |
terminale Sequenz Muramylpentapeptid | D-Ala-D-Lac | D-Ala-D-Lac | D-Ala-D-Ser |
Übertragbarkeit | + | + | – |
Vorkommen1 | E. faecium E. faecalis | E. faecium E. faecalis | E. gallinarum2 E. casseliflavus2 |
Wie gefährlich sind Vancomycin-resistente Enterokokken?
Ein Bakterium, das gegen Vancomycin resistent ist, muss nicht zwingend pathogen sein. Selbst das häufig als Probiotikum eingesetzte Bakterium Lactobacillus rhamnosus GG besitzt eine natürliche Resistenz gegen Vancomycin [17]. Enterokokken sind nicht sehr virulent und wenig pathogen [4]. Eine Hemmung der anaeroben Darmflora z. B. durch eine Therapie mit Metronidazol führt jedoch zu einer massiven Proliferation von Enterokokken [15]. Bei Menschen in gutem Allgemeinzustand ohne zusätzliche Grunderkrankungen sind Enterokokken-Infektionen meist auf eine Blinddarm- oder Eileiterentzündung beschränkt [4]. Abweichend verhält es sich bei hospitalisierten Patienten. Enterokokken sind typische nosokomiale Erreger, das heißt, diese Infektionen entstehen hauptsächlich während Krankenhausaufenthalten bei Patienten mit geschwächtem Immunsystem. Nach Clostridium difficile und Escherichia coli sind Enterokokken die dritthäufigsten Erreger nosokomialer Infektionen [16]. Daher werden Vancomycin-resistente Enterokokken zur sogenannten ESKAPE-Gruppe gezählt (siehe Kasten „ESKAPE-Keime“) [14]. In speziellen Patientengruppen können sie Infektionen mit erheblicher Mortalität auslösen [4]. Als Risikofaktoren für eine Infektion mit Vancomycin-resistenten Enterokokken sind zu nennen:
- Multimorbidität,
- Organtransplantationen mit Immunsuppression,
- hämatologische und onkologische Patienten,
- Dialyse sowie
- ein längerer Aufenthalt auf Intensivstationen [5].
Typischerweise treten hierbei Wundinfektionen, katheterassoziierte Infektionen, Infektionen der Blutbahn und/oder intraabdominale Infektionen auf [4, 5]. Zu einem Problem der heutigen Medizin entwickelt sich die Übertragbarkeit des Vancomycin-Resistenzgens auf andere Bakteriengattungen [12]. Bereits 1997 sorgte die Entdeckung eines Vancomycin-resistenten Staphylococcus-aureus-Isolats (VRSA) für großes Aufsehen [13].
ESKAPE-Keime
ESKAPE ist ein Akronym aus den Anfangsbuchstaben der folgenden einzelnen Bakterienarten:
- Enterococcus faecium
- Staphylococcus aureus
- Klebsiella pneumoniae
- Acinetobacter baumannii
- Pseudomonas aeruginosa
- Enterobacter species
Ein Großteil nosokomialer Infektionen wird durch diese Keime verursacht. Bei multiresistenten Erregern ist die erfolgreiche antibiotische Therapie erschwert.
Epidemiologie
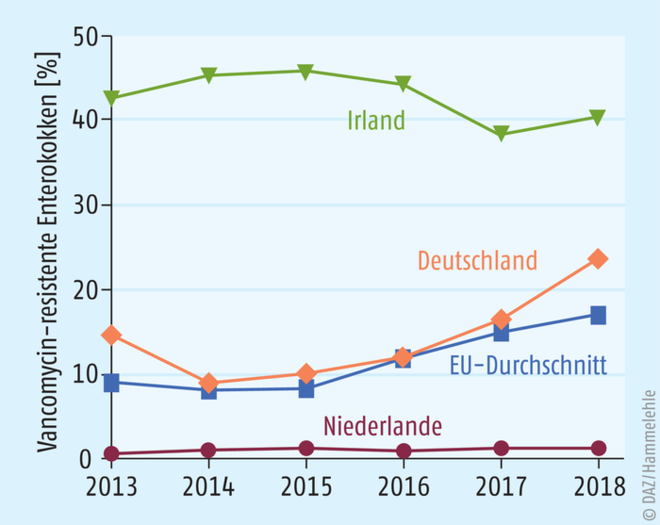
Seit ihrer Erstbeschreibung 1988 haben sich Infektionen durch Vancomycin-resistente Enterokokken weltweit ausgebreitet. Nach dem Verbot von Avoparcin, einem Vancomycin-ähnlichen Futterzusatzstoff (Wachstumsförderer) in der Tiermast, waren die Resistenzzahlen kurzfristig rückläufig [18]. Inzwischen ist der Anteil invasiver Infektionen durch Vancomycin-resistente Enterokokken wieder stark gestiegen [4]. In Europa sind Resistenzen gegen Vancomycin hauptsächlich bei E. faecium vorhanden [4]. Weltweit sind Resistenzen aus der Klasse VanA am häufigsten, in Deutschland ist der Anteil von VanA und VanB in etwa gleich verteilt [19]. Der Anteil von Vancomycin-Resistenzen bei Infektionen durch E. faecium ist im europäischen Durchschnitt auf 15% gestiegen, in Deutschland sogar auf 16% (Abb. 2) [19]. Auffällig ist die ungleichmäßige Resistenzverteilung in den einzelnen europäischen Staaten (Niederlande 1%; Irland 38%) [19].
Abb. 2: Prozentualer Anteil von Vancomycin-resistenten Enterokokken an Hospitalinfektionen mit E. faecium im europäischen Vergleich [19]. Der Anteil von Vancomycin-resistenten Enterokokken ist in Europa regional stark unterschiedlich. Während in Irland die Zahlen kontinuierlich bei etwa 40% liegen, liegt der Anteil in den Niederlanden bei ca. 1%. Deutschland liegt leicht über dem europäischen Durchschnitt.
Behandlung
Grundsätzlich muss zwischen einer Besiedlung (Vorhandensein von Vancomycin-resistenten Enterokokken z. B. auf der Haut) und einer Infektion unterschieden werden. Eine Besiedlung durch diese Erreger ist nicht behandlungsbedürftig [4]. Dagegen müssen Patienten mit Vancomycin-resistenten Enterokokken-Infektionen in der Regel therapiert werden. Dabei muss berücksichtigt werden, dass Blutinfektionen durch Enterokokken ein niedrigeres pathogenes Potenzial haben als z. B. Infektionen mit S. aureus oder E. coli. Im Allgemeinen gilt, dass E. faecium aufgrund seiner natürlichen Resistenz gegen Aminopenicilline schwerer zu behandeln ist als E. faecalis [4]. Infektionen mit Vancomycin-resistenten Enterokokken sind problematisch, weil nur wenige Möglichkeiten einer antibiotischen Therapie vorhanden sind.
Linezolid (Zyvoxid®) ist aktuell das einzige gegen Infektionen mit Vancomycin-resistenten Enterokokken zugelassene Antibiotikum [4]. Bei einer Therapie mit Linezolid können sich jedoch Resistenzen bilden, die spontan über eine Punktmutation entstehen oder durch Resistenzgene auf Plasmiden erworben werden [21, 33]. Linezolid ist derzeit das meistgenutzte Reserveantibiotikum bei VRE-Infektionen, doch die Resistenzraten steigen deutlich [35]. Um auch in Zukunft Linezolid als Reserveantibiotikum gegen Infektionen mit Vancomycin-resistenten Enterokokken nutzen zu können, sollte diese Substanz nur zurückhaltend und abgewägt eingesetzt werden [4].
Als weiteres Reserveantibiotikum für VRE-Infektionen gilt Tigecyclin (Tygacil®). Die Wirksamkeit gegen Vancomycin-resistente Enterokokken im Patienten ist nicht einschätzbar, weshalb nur eine sehr eingeschränkte Anwendungsempfehlung vorliegt [4]. Resistenzen gegen Tigecyclin sind zwar bekannt, bisher aber sehr selten [22, 35]. Tigecyclin sollte zur Behandlung von Infektionen mit Vancomycin-resistenten Enterokokken nur nach Abwägung möglicher Therapiealternativen, mit einem Kombinationsantibiotikum, beispielsweise einem Carbapenem oder Daptomycin, als letzte Option unter engmaschiger Überwachung der Nebenwirkungen eingesetzt werden [4, 23].
Bei Infektionen mit multiresistenten, grampositiven Keimen wird in der Regel Daptomycin (Cubicin®) als letzte Therapieoption eingesetzt. In den zugelassenen Dosierungen ist Daptomycin jedoch nicht gegen Enterokokken wirksam [4]. Entsprechend der Empfehlung der EUCAST (European Committee on Antimicrobial Susceptibility Testing) wird allerdings ein Einsatz zur Behandlung einer Enterokokken-Endokarditis bei erhöhter Dosierung diskutiert [34]. Insgesamt ist die Studienlage jedoch widersprüchlich, weshalb keine Aussage über die Wirksamkeit von Daptomycin zur Behandlung von Infektionen mit Vancomycin-resistenten Enterokokken gemacht werden kann.
Die neueren Glykopeptid-Derivate wie Teicoplanin (Targocid®), Oritavancin (Orbactiv®, in Deutschland nicht im Handel), Telavancin (Vibativ®) und Dalbavancin (Xydalba®) sind in vitro gegen Resistenzen der Typen VanB und VanC wirksam (Oritavancin ist in vitro sogar gegen VanA-Resistenzen wirksam), aber sie werden bisher nicht zur Therapie einer VRE-Infektion herangezogen. Einerseits liegt das daran, dass Isolate mit VanC-Resistenz zusätzlich Resistenzgene der Typen VanA und VanB aufnehmen können [4]. Andererseits ist Teicoplanin zwar in vitro gegen Enterokokken mit VanB-Resistenzen wirksam, es kann aber in der klinischen Anwendung zu mutationsbedingtem Therapieversagen kommen [20]. Synergieeffekte können auch bei antibiotischen Therapien erfolgsversprechend sein. Bei der Behandlung einer Endokarditis durch E. faecalis setzt man auf eine Kombination von Ampicillin und Gentamicin, um Low-level-Resistenzen zu überwinden [3, 4]. Voraussetzung für diese Therapie ist jedoch, dass gegen keine der Antibiotikaklassen eine High-level-Resistenz vorliegt [4].
Nichtmedikamentöse Behandlung
Die nichtmedikamentösen Behandlungsmöglichkeiten konzentrieren sich auf die Prävention therapiebedürftiger Infektionen mit Vancomycin-resistenten Enterokokken [4]. Vancomycin-resistente Enterokokken sind in der Lage, lange auf unbelebten Flächen wie Telefonen, Türgriffen, Thermometern und medizinischen Instrumenten zu überleben [24]. Sie können sowohl direkt über Hände als auch indirekt über Gegenstände übertragen werden [25, 26]. Daher werden Vancomycin-resistente Enterokokken häufiger übertragen als alle anderen multiresistenten Bakterien [27]. Wirkungsvolle Hygienemaßnahmen und damit eine Reduktion der Übertragungswahrscheinlichkeit dieser Erreger könnten ein Instrument zur Einschränkung von Infektionen mit Vancomycin-resistenten Enterokokken darstellen.
Es konnte gezeigt werden, dass die Basishygiene die wichtigste Maßnahme zur Prävention einer Übertragung der resistenten Enterokokken ist [4]. Andere Einzelmaßnahmen, wie ein Screening der Patienten bei Krankenhausaufnahme, die räumliche Isolierung von infizierten Patienten oder einfache Schutzmaßnahmen wie das Tragen von Handschuhen und Kitteln, haben sich als nicht ausreichend erwiesen [4, 36]. Eine Schulung des Personals ist Voraussetzung für eine erfolgreiche Umsetzung mehrerer, parallel angewendeter Präventionsmaßnahmen. Auch die Einbeziehung des Patienten und die konsequente Umsetzung von Händedesinfektion nach dem Toilettengang, vor Arzneimitteleinnahme und vor Mahlzeiten hat sich als hilfreich erwiesen [4].
Ausblick
Aufgrund der sinkenden Zahl Methicillin-resistenter Staphylokokken und der steigenden Zahl Vancomycin-resistenter Enterokokken müssen Enterokokken kritisch beobachtet werden. In den USA wurde der breite Einsatz von Vancomycin eingeschränkt, um eine Selektion Vancomycin-resistenter Erreger zu vermeiden [3]. Aufgrund mangelnder antibiotischer Therapieoptionen steht aktuell die Optimierung nichtmedikamentöser Maßnahmen zur Infektions- und Übertragungsprophylaxe im Vordergrund. Um jedoch Vancomycin-resistente Enterokokken in voller Stärke bekämpfen zu können, sind neue Antibiotika zwingend erforderlich, die alle Vancomycin-Resistenztypen überwinden können. Die World Health Organisation (WHO) hat daher manifestiert, dass die Entwicklung neuer Antibiotika gegen Vancomycin-resistente Enterokokken eine hohe Priorität besitzt [28].
Ein Ansatz sind sogenannte antimikrobielle Peptide (AMP). Diese werden von vielen Organismen produziert und besitzen ein breites antimikrobielles Wirkspektrum, ohne dabei für klassische Resistenzmechanismen zugänglich zu sein. Die Optimierung dieser Peptide kann für neue antibiotische Optionen gegen multiresistente Bakterien erfolgversprechend sein [32].
Ein weiterer interessanter Ansatz ist eine gezielte antibakterielle Therapie mit Bakteriophagen. Phagen sind Viren, die artspezifisch Bakterien angreifen können. Im Gegensatz zu einer klassischen Antibiotikatherapie wird das natürliche Mikrobiom nicht geschädigt. Erste Ansätze, mit Bakteriophagen selektiv Vancomycin-resistente Enterokokken zu bekämpfen, waren erfolgreich [37]. Vor einer klinischen Anwendung müssen jedoch Probleme wie eine schnelle Resistenzentwicklung oder die Freisetzung zytotoxischer Endolysine gelöst werden [38].
Auf einen Blick
- Vancomycin-resistente Enterokokken haben in den letzten Jahren als Erreger deutlich zugenommen.
- Die Resistenz gegen Vancomycin stellt eine Unempfindlichkeit gegen das wichtigste Reserveantibiotikum für grampositive Bakterien dar.
- Die Vancomycin-Resistenz beruht auf Veränderungen der Zielstruktur in der bakteriellen Zellwand.
- Linezolid ist derzeit das meistgenutzte Reserveantibiotikum bei Infektionen mit Vancomycin-resistenten Enterokokken, doch die Resistenzraten steigen deutlich.
- Am Beispiel von Vancomycin-resistenten Enterokokken wird deutlich, dass dringend neue, klinisch effektive Antibiotika benötigt werden.
Alternative Lösungsansätze, die in der aktuellen Forschung verfolgt werden, sind die Indikationserweiterung neuer Vancomycin-Derivate wie Oritavancin zur Behandlung von Infektionen mit Vancomycin-resistenten Enterokokken und Modifikationen von Vancomycin [29]. Eine Idee ist es, Vancomycin so zu modifizieren, dass das veränderte Vancomycin-Bindungsmotiv resistenter Enterokokken gebunden werden kann, oder es werden strukturelle Veränderungen an Vancomycin vorgenommen, um zusätzliche Bindungsmotive einzufügen, die einen zweiten Wirkmechanismus erhoffen lassen [30, 31]. Es bleibt abzuwarten, ob diese Therapieoptionen in absehbarer Zeit dem Markt zur Verfügung stehen und die wachsende Problematik der Vancomycin-resistenten Enterokokken unter Kontrolle gehalten werden kann.
Literatur
[1] Santajit S, Indrawattana N. Mechanisms of antimicrobial resistance in ESKAPE pathogens. Biomed Res Int 2016:2475067
[2] Schleifer KH, Kilpper-Balz R. Transfer of Streptococcus faecalis and Streptococcus faecium to the genus Enterococcus nom. rev. as Enterococcus faecalis comb. nov. and Enterococcus faecium comb. nov. Int J Syst Bacteriol 1984;34:31-34
[3] Klare I, Witte W, Wendt C, Werner G. Vancomycin-resistente Enterokokken (VRE). Bundesgesundheitsblatt 2012;55:1387-1400
[4] Hygienemaßnahmen zur Prävention durch Enterokokken mit speziellen Antibiotikaresistenzen. Empfehlungen der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut. Bundesgesundheitsblatt 2018;61:1310-1361
[5] Vehreschild M, Lemmen S, Fätkenheuer G. Vancomycin-resistente Enterokokken (VRE): Ein Grund zur Isolierung? Dtsch Arztebl 2018;115:27-28
[6] Aminov R. History of antimicrobial drug discovery: Major classes and health impact. Biochem Pharmacol 2017;133:4-19
[7] D’Costa VM, King CE, Kalan L, Morar M, Sung WW, Schwarz C, Froese D, Zazula G, Calmels F, Debruyne R, Golding GB, Poinar HN, Wright GD. Antibiotic resistance is ancient. Nature 2011;477:451-461
[8] Leclercq R, Derlot E, Duval J, Courvalin P. Plasmid-mediated resistance to vancomycin and teicoplanin in Enterococcus faecium. N Engl J Med 1988;319:157-161
[9] Levine DP. Vancomycin: a history. Clin Infect Dis 2006;42(Suppl1):5-12
[10] James RC, Pierce JG, Okano A, Xie J, Boger DL. Redesign of glycopeptide antibiotics: back to the future. ACS Chem Biol 2012;7:797-804
[11] Toye B, Shymanski J, Bobrowska M, Woods W, Ramotar K. Clinical and epidemiological significance of enterococci intrinsically resistant to vancomycin (possessing the vanC genotype). J Clin Microbiol 1997;35:3166-3170
[12] Poyart C, Pierre C, Quesne G, Pron B, Berche P, Trieu-Cuot P. Emergence of vancomycin resistance in the genus Streptococcus: characterization of a vanB transferable determinant in Streptococcus bovis. Antimicrob Agents Chemother 1997;41:24-29
[13] Gardete S, Tomasz A. Mechanisms of vancomycin resistance in Staphylococcus aureus. J Clin Invest 2014;124:2836-2840
[14] Rice LB. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE. J Infect Dis 2008;197:1079-1081
[15] Ubeda C, Taur Y, Jenq RR et al. Vancomycin-resistant Enterococcus domination of intestinal microbiota is enabled by antibiotic treatment in mice and precedes bloodstream invasion in humans. J Clin Invest 2010;120:4332-4341
[16] Deutsche nationale Punkt-Prävalenzerhebung zu nosokomialen Infektionen und Antibiotikaanwendung 2016. Abschlussbericht des Nationalen Referenzzentrums für Surveillance von nosokomialen Infektionen (NRZ) 2017, www.nrz-hygiene.de/fileadmin/nrz-/download/pps2016/PPS_2016_Abschlussbericht_20.07.2017.pdf, Abruf am 24. Mai 2019
[17] Tynkkynen S, Singh KV, Varmanen P. Vancomycin resistance factor of Lactobacillus rhamnosus GG in relation to enterococcal vancomycin resistance (van) genes. Int J Food Microbiol 1998;41:95-204
[18] Acar J, Casewell M, Freeman J, Friis C, Goossens H. Avoparcin and virginiamycin as animal growth promoters: a plea for science in decision-making. Clin Microbiol Infect 2000;6:477-482
[19] Annual surveillance reports on antimicrobial resistance. European Centre for Disease Prevention and Control (ECDC) 2018, www.ecdc.europa.eu/en/home
[20] Holmes NE, Ballard SA, Lam MM et al. Genomic analysis of teicoplanin resistance emerging during treatment of vanB vancomycin-resistant Enterococcus faecium infections in solid organ transplant recipients including donor-derived cases. J Antimicrob Chemother 2013;68:2134-2139
[21] Anforderungen an die Hygiene bei der medizinischen Versorgung von immunsupprimierten Patienten. Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO), Bundesgesundheitsblatt 2010;53:357-388
[22] Werner G, Gfrorer S, Fleige C, Witte W, Klare I. Tigecycline-resistant Enterococcus faecalis strain isolated from a German intensive care unit patient. J Antimicrob Chemother 2008;61:1182-1183
[23] Shen F, Han Q, Xie D, Fang M, Zeng H, Deng Y. Efficacy and safety of tigecycline for the treatment of severe infectious diseases; an updated meta-analysis of RCTs. Int J Infect Dis 2015;39:25-33
[24] Wendt C, Ruden H, Edmond M. Vancomycin-resistente Enterokokken Epidemiologie, Risikofaktoren und Prävention. Dtsch Arztebl 1998;95:A1604-1610
[25] Duckro AN, Blom DW, Lyle EA, Weinstein RA, Hayden MK. Transfer of vancomycin-resistant enterococci via health care workers hands. Arch Intern Med 2005;165:302-307
[26] Bonten MJ, Hayden MK, Nathan C et al. Epidemiology of colonisation of patients and enviroment with vancomycin-resistant enterococci. Lancet 1996;348:1615-1619
[27] Erb S, Frei R, Dangel M, Widmer AF. Multidrug-resistant organisms detected more than 48 hours after hospital admission are not necessarily hospital-acquired. Infect Control Hosp Epidemiol 2017;38:18-23
[28] Global priority list of antibiotic-resistant bacteria to guide research, discovery and development of new antibiotics. World Health Organization (WHO), Genf, 2017
[29] Belley A, McKay GA, Arhin FF, Sarmiento I, Beaulieu S, Fadhil I, Parr TR, Moeck G. Oritavancin disrupts membrane integrity of Staphylococcus aureus and vancomycin-resistant enterococci to effect rapid bacterial killing. Antimicrob Agents Chemother 2010;54:5369-5371
[30] Okano O, Isley NA, Boger DL. Total synthesis of vancomycin-related glyopeptide antibiotics and key analogues. Chem Rev 2017;117:11952-11993
[31] Yarlaggada V, Sarkar P, Samaddar S, Halder J. A vancomycin derivative with a pyrophosphate-binding group: A strategy to combat vancomycin-resistant bacteria. Angew Chem Int Ed Engl 2016;55:7836-7840
[32] Domhan C, Uhl P, Meinhardt A, Zimmermann S, Kleist C, Lindner T, Leotta K, Mier W, Wink M. A novel tool against multiresistant bacterial pathogens: lipopeptide modification of the natural antimicrobial peptide ranalexin for enhanced antimicrobial activity and improved pharmacokinetics. Int J Anmicrob Agents 2018;52:52-62
[33] Bi R, Qin T, Fan W, Ma P, Gu B. The emerging problem of linezolid-resistant enterococci. J Glob Antimicrob Resist 2018;13:11-19
[34] Guidance document on use of daptomycin to treat enterococcal endocarditis. EUCAST - European Committee on Antimicrobial Susceptibility Testing, 2016, www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/General_documents/EUCAST_daptomycin_guidance_note_20160924.pdf, Abruf am 29. Juli 2019
[35] Klare I, Bender JK, Marktwart R, Reuss A, Abu Sin M, Eckmanns T, Werner G. Eigenschaften, Häufigkeit und Verbreitung von Vancomycin-resistenten Enterokokken in Deutschland – Update 2017/2018. Epid Bull 2019;37:365-372
[36] Mutters NT, Mersch-Sundermann V, Mutters R, Brandt C, Schneider-Brachert W, Frank U. Control of the spread of vancomycin-resistant enterococci in hospitals: epidemiology and clinical relevance. Dtsch Arztebl 2013;110:725-731
[37] Otawa K, Kaku M, Nakai Y. Bacteriophage control of vancomycin-resistant enterococci in cattle compost. J Appl Microbiol 2012;113:499-507
[38] Bolocan AS, Upadrasta A, de Almeido Bettio PH, Clooney AG, Draper LA, Ross RP, Hill C. Evaluation of Phage Therapy in the Context of Enterococcus faecalis and Its Associated Diseases. Viruses 2019;11:366























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.