
- DAZ.online
- DAZ / AZ
- DAZ 18/2020
- Lehren aus der Leere
Pandemie Spezial
Lehren aus der Leere
Wie eine Rückholung der Wirkstoffproduktion nach Europa gelingen kann
Die Tatsache, dass Indien eine Exportbeschränkung für Aciclovir, Chloramphenicol, Clindamycin, Erythromycin, Metronidazol, Neomycin, Ornidazol, Paracetamol, Progesteron, Tinidazol sowie die Vitamine B1, B6 und B12 Anfang März verhängt hat, zeigt das Problem deutlich auf [2].
Mangelverwaltung in der Corona-Krisenzeit
Schon seit vielen Jahren sind Lieferengpässe allgegenwärtig, sowohl in den deutschen Apotheken als auch in Krankenhausapotheken. Und fast muss man den Eindruck gewinnen, dass es diese elementare Krise brauchte, um das Problem endlich wirklich ernst zu nehmen. Waren es vorher unter anderem in Hospitälern Antibiotika und teilweise Chemotherapeutika, Sartane, Ibuprofen und ab und an auch mal einfache Trägerlösungen wie Kochsalz, so geht es jetzt um wesentliche Arzneistoffe, die ausnahmslos bei akuten und lebensbedrohlichen Symptomen auf Intensivstationen benötigt werden. Derzeit müssen Apotheken viele Stunden damit verbringen, am Telefon zu versuchen, bei den Herstellern noch die letzten Vorräte locker zu machen, was längst nicht immer gelingt, wobei der Preis keine Rolle mehr spielt, Hauptsache, man bekommt von irgendwoher noch Ware. Da niemand weiß, wie lange und wie dramatisch sich in der eigenen Krankenhausapotheke die Situation entwickeln wird, werden Mengen geordert, die ähnlich dem Klopapier-Effekt in einigen Fällen auch über dem tatsächlichen Bedarf liegen – aber man kann es eben nicht abschätzen!
Die Patienten, die in kritischen Zuständen beatmet werden müssen, werden dies, das zeigen die Erfahrungen, oftmals über zehn bis vierzehn Tage. Vor allem benötigt werden hier derzeit Propofol, Midazolam, Noradrenalin und Inhalationsnarkotika.
Zur intensivmedizinischen Versorgung gehören ebenso Heparin, Humanalbumin, Stoffe zur Aufrechterhaltung der Blutgerinnung, Antibiotika und Antimykotika, Insulin, Virustatika, Opioide wie Sufentanil oder Fentanyl, Hydrocortison, Diuretika und einzelne Analgetika unzweifelhaft dazu.
Produktion in Europa / USA - zu teuer?
Der Anteil der Arzneimittelkosten an den Gesamtausgaben (inklusive Patientenzuzahlung) der gesetzlichen Krankenversicherung (GKV) schwankt in den letzten 15 Jahren zwischen 16,2 und 18,6 Prozent; 2018 lag er z. B. bei 16,9 Prozent [3]. Der Arzneiverordnungsreport 2019 [4] berichtet ein Gesamtvolumen der GKV von 2018 von 41,2 Mrd. Euro mit Einsparungen durch Rabattverträge von 4,5 Mrd. Euro. Dabei entfallen 21,9 Mrd. Euro auf patentfreie Fertigarzneimittel (FAM) und 19,7 Mrd. Euro auf patentgeschützte Fertigarzneimittel. Generika machen von den Gesamtkosten 12,5 Mrd. Euro aus.
Ein beträchtlicher Teil der Ausgaben wird durch die zumeist hochpreisigen Antikörper verursacht. Etwa die Hälfte der 20 umsatzstärksten Arzneimittel waren 2018 Antikörper; allein auf Humira® (Adalimumab) entfiel mehr als eine Milliarde Euro. Obgleich diese Substanzgruppe von sehr großem Wert für die Behandlung von Krebserkrankungen und vielen anderen Indikationen ist, so sind es in Krisenzeiten, wie wir sie gerade erleben, nicht die Substanzen, die dringend benötigt werden. Corona-Krisenzeit heißt, dass Produktionen stillgelegt werden müssen, um die Mitarbeiter vor einer Ansteckung zu schützen. So ist es kürzlich bei dem Corona-Ausbruch in China geschehen. Hier wird aber der überwiegende Teil unserer Arzneistoffe hergestellt, und wir müssen uns fragen, ob es deshalb zu zusätzlichen Lieferengpässen in Bälde kommen wird. Wir müssen uns aber vor allem fragen, ob es vernünftig ist, sich im Wesentlichen von einem Land bei der Produktion von lebenswichtigen Arzneistoffen abhängig zu machen. Arzneimittel sind ein besonderes Gut und nicht vergleichbar mit T-Shirts, Hosen, Schuhen, Strümpfen oder anderen Alltagswaren. Wie bereits erwähnt, ist eine ganze Menge an Arzneimitteln lebenswichtig, wie z. B. Antibiotika, antivirale, antimykotische und kreislaufstabilisierende Substanzen wie Arterenol (Noradrenalin) oder Propofol, Midazolam, Gerinnungsfaktoren, Heparine, um nur einige wenige, aber sehr wichtige Gruppen zu nennen. Bei diesen wäre es von größerer Wichtigkeit, sie auch in Europa und Amerika zu produzieren, um eine Abhängigkeit von einem oder einigen wenigen Ländern zu umgehen. Dies würde auch der Konzentrierung der Produktionsstätten, die im Augenblick stattfindet, entgegenwirken. Man muss allerdings fragen: Was würde uns die Produktion von wichtigen Arzneimitteln in Europa kosten, wenn die wichtigen Arzneimittel alles kleine und damit billige Moleküle sind? Dies sei beispielhaft an Metoprolol dargestellt:
Bei Pharmacompass [5] wird z. B. der Preis für Metoprolol-succinat mit rund 50 US-Dollar pro kg angegeben. Eine Packung mit 100 Tabletten kostet im Handel rund 15 Euro (je nach pharmazeutischem Hersteller). Die gesamte Packung enthält 4,75 g Wirkstoff bei 47,5 mg Wirkstoff pro Tablette. Somit belaufen sich die Kosten des Wirkstoffes in der Packung auf rund 24 Eurocent (dies entspricht 1,5% des Packungspreises). Eine vergleichbare Rechnung kann für andere generische „kleine Moleküle“ ebenfalls gemacht werden. Das zeigt, dass es im Bereich der Arzneimittelkosten für die Produktion von versorgungsrelevanten Arzneimitteln sicher nicht zu einer Kostenexplosion kommen wird, selbst wenn die Produktion der Wirkstoffe in Europa teurer sein wird. Der Wegfall der Transportkosten von China nach Europa spielt dabei nur eine nachrangige Rolle.
Probleme der Produktions-Rückholung
Wichtig ist, dass man bei der Diskussion einer Rückholung der Wirkstoffproduktion nach Europa nicht nur auf den Teil der Wirkstoffsynthese beginnend von den Startmaterialien und den regulatorischen Part von Wirkstoffzulassungen bzw. Arzneimittelzulassungen fokussiert, sondern auch die Herstellung der Startmaterialien selbst sowie weitere notwendige Genehmigungen, wie z. B. in Deutschland Baugenehmigungen, Genehmigungen nach dem Bundes-Immissionsschutzgesetz (BImSchG), wasserrechtliche Genehmigungen, Erlaubnisse nach der Betriebssicherheitsverordnung (BetrSichV) und viele weitere angemessen berücksichtigt.
Zudem werden nicht nur wenige Wirkstoffe in Europa gefertigt, noch viel seltener werden die Startmaterialien für die Wirkstoffsynthese in Europa produziert. China hat diesbezüglich eindeutig eine Schlüsselposition, das liegt u. a. an der staatlichen Subventionierung der lokalen Chemieproduktion, damit einhergehend an einem umfangreichen Aufbau von Produktionskapazitäten, wodurch Skaleneffekte massiv realisiert werden konnten, an Lohnkostenvorteilen sowie an bisher geringeren Produktionsauflagen in Bezug auf Umwelt und Sicherheit.
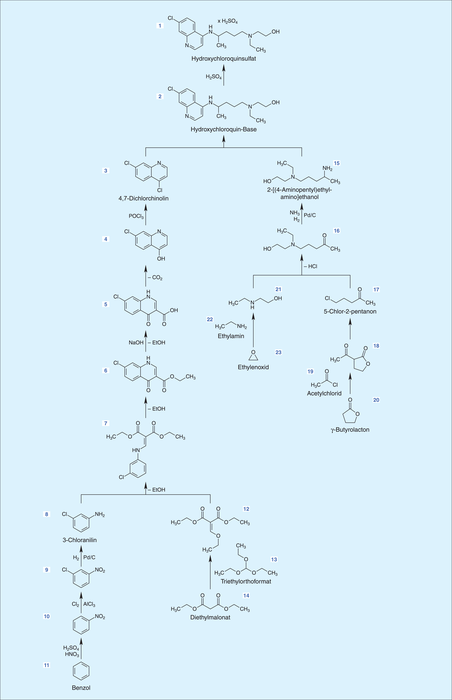
Der „Beginn“ der Wirkstoffherstellung soll im Folgenden am Beispiel der Synthese von Hydroxychloroquinsulfat (siehe Abb. 1) kurz erläutert werden, da es zurzeit zur Behandlung von Corona-Patienten untersucht wird.
Die Synthese des Wirkstoffes Hydroxychloroquinsulfat 1 „beginnt“ – in der Regel – bei den beiden Startmaterialien 4,7-Dichlorchinolin 3 und 2-[(4-Aminopentyl)-ethylamino]-ethanol 15 und führt über die Base 2 zum Wirkstoff. Eine umfangreiche Recherche hat ergeben, dass beide Startmaterialien in Europa nicht zu beschaffen sind. 4,7-Dichlorchinolin 3 kann über mehrere vorgelagerte Synthesestufen aus Chloranilin 8 synthetisiert werden, welches auch nicht mehr aus Europa bezogen werden kann. Somit führt die Syntheseroute weiter zurück zu Nitrobenzol 10, bzw. Benzol 11, welche leicht zugänglich sind, da sie wichtige Bausteine für die petrochemische Industrie darstellen. Mit dem Synthesezweig zur Darstellung von 2-[(4-Aminopentyl)-ethylamino]ethanol 15 verhält es sich ähnlich.
Die „einfach“ anmutende Herstellung von Hydroxychloroquinsulfat bestehend aus einem Syntheseschritt, in welchem die beiden Startmaterialien 3 und 15 umgesetzt werden, und einer Salzfällung mit Schwefelsäure, „mutiert“ unter Berücksichtigung der leichten Zugänglichkeit von Ausgangsstoffen aus Europa zu einer Sequenz bestehend aus 15 Syntheseschritten ausgehend von sieben relevanten Ausgangsstoffen mit der anschließenden Salzfällung.
Dieses Beispiel soll verdeutlichen, dass es in letzter Konsequenz nicht ausreicht, nur den Teil der zulassungsrelevanten Wirkstoffsynthese nach Europa zurückzuverlegen, sondern weitere Teile der Wertschöpfungskette. Nur auf diesem Wege kann die Herstellung von Wirkstoffen in Europa sichergestellt werden, andernfalls wird lediglich die Abhängigkeit verlagert.
Die Abhängigkeit bei der Beschaffung von Startmaterialien für die Wirkstoffsynthese ist auch in den letzten mindestens zwei Jahren schon deutlich spürbar gewesen, z. B. durch Verschärfungen von Umweltschutzbestimmungen in den produzierenden Ländern.
Ein anderer Punkt ist die regulatorische Seite, wenn ein Wirkstoff eines anderen Wirkstoffherstellers für das zugelassene Fertigarzneimittel verwendet wird. Im regulatorischen Sinne ist eine „Variation“ eine Änderung innerhalb der Zulassungsunterlagen von zugelassenen Fertigarzneimitteln, wenn sich nach der Zulassung bestimmte Änderungen bei der Herstellung oder Herstellungskontrolle ergeben haben [8]. Gründe hierfür können das Auftauchen von bisher nicht identifizierten Verunreinigungen sein, Änderungen im Herstellprozess, Befunde aus den laufenden Stabilitätsuntersuchungen, die einen Einfluss auf die Lagerbeständigkeit haben oder andere Aufbewahrungsbedingungen notwendig machen, oder aber auch, dass der Wirkstoff von einem weiteren Wirkstoffhersteller verwendet wird oder der in den Zulassungsunterlagen genannte Hersteller durch einen anderen ersetzt wird. Je nach Umfang der Änderungen unterscheidet man sogenannte Typ-1A-, Typ-1B- und Typ-II-Variationen. Zu Typ-II gehören größere Änderungen im Herstellprozess, die einen wesentlichen Einfluss auf die Qualität, Sicherheit oder Wirksamkeit des Fertigarzneimittels haben können. Hierzu gehört auch der Wechsel des Wirkstoffherstellers (Klassifikations-Kategorie nach der EMA-Richtlinie: B.I.a.1.g.). Für die Zulassungsunterlagen muss nicht nur der gesamte Teil, der die Wirkstoffherstellung beschreibt, nachgeliefert werden (sogenannter Drug Substance Part des Common Technical Document (CTD) Moduls 3), sondern es muss auch der Einfluss auf die Qualität des Fertigarzneimittels untersucht und dargestellt werden. Der Wirkstoff könnte nach einem veränderten, neuen Verfahren hergestellt werden, so dass sich das Verunreinigungsprofil oder die verwendeten Lösungsmittel geändert haben. Darüber hinaus kann auch eine unterschiedliche Partikelgrößenverteilung vorliegen oder gar eine unterschiedliche kristalline Form (sogenanntes Polymorph). Diese letztgenannten Eigenschaften könnten einen großen Einfluss auf das Profil des Arzneimittels haben, weil sich durch ein unterschiedliches Löslichkeitsverhalten das Profil der Bioverfügbarkeit ändern könnte. Dies bedeutet, dass die Äquivalenz eines Wirkstoffs von einem anderen Hersteller auch im Fertigarzneimittel zu untersuchen ist. Insbesondere der Einfluss auf die sogenannten kritischen Qualitätsattribute wie Auflösungsprofil, Verunreinigungsprofil und Lagerstabilität sind darzustellen. Dieser Prozess kann sehr umfangreich und zeitintensiv werden. Vor allem die zu erbringenden Daten zur Lagerstabilität können 12 Monate und länger dauern. In Abhängigkeit von dem Preisdruck, unter dem die Generika-Hersteller der Fertigarzneimittel stehen, kann sich so ein Aufwand möglicherweise gar nicht lohnen.
In Europa gibt es allerdings immer noch genügend Produktionskapazitäten für die Herstellung von niedermolekularen generischen Wirkstoffen. Darüber hinaus existieren das Know-how in der Chemie sowie die Expertise im Anlagenbau. Somit kann die Wirkstoffproduktion prinzipiell – unter Berücksichtigung einer gesicherten Versorgung mit Basischemikalien – realisiert werden.
Unter Berücksichtigung von Zeitschienen gelingt es natürlich schneller, Produktionssteigerungen von relevanten Wirkstoffen nach bereits etablierten Verfahren bei den jeweiligen Herstellern in Europa zu realisieren als noch nicht etablierte Verfahren zu entwickeln und dann auch noch für die Produktion spezielle – beim entsprechenden Hersteller noch nicht vorhandene – Produktionsanlagen zu bauen. Demnach sollten Produktionssteigerungen in Europa nach etablierten Verfahren primär betrachtet werden.
Für alle Fälle gilt jedoch, dass die Abnahme garantiert sein muss und somit die Geschäftsgrundlage eines europäischen oder deutschen Wirkstoffherstellers langfristig gesichert werden kann. Insbesondere Investitionskosten durch Entwicklungsleistungen oder sogar bis hin zum Anlagenbau müssen kompensiert werden können. An dieser Stelle bedarf es aus heutiger Sicht einer staatlichen Unterstützung, um die Gesamtkosten der Produktion wettbewerbsfähig zu gestalten bzw. um Investitionen zu bezuschussen.
Weitere Eingriffe werden wahrscheinlich notwendig, um die „Rückholung“ effizient gestalten zu können. Die Hersteller werden vorrangig die Produktion von hochpreisigen Wirkstoffen etablieren. Somit kann nicht garantiert werden, dass auch alle versorgungsrelevanten Wirkstoffe in Deutschland bzw. Europa produziert werden. Um dies zu gewährleisten, bedarf es einer Koordination, die die Industrie alleine wohl nicht leisten kann.
Ein weiterer Baustein, der bei der „Rückholung“ betrachtet werden muss, ist es, darauf zu achten, dass die Produktionsressourcen nicht stark zentriert werden, um von vorneherein Marktverengungen entgegenzuwirken. Viele Engpässe in der Vergangenheit wurden verursacht, weil ein großer der wenigen verbliebenen Hersteller eines Produktes ausgefallen ist und der Ausfall von den anderen nicht kompensiert werden konnte. Deutschland hat diesbezüglich mit seinen mittelständischen Herstellern einen Vorteil. Dieser Vorteil bringt gleichzeitig den Nachteil mit sich, dass kleinere Wirkstoffhersteller in größerer Abhängigkeit der etablierten, multinationalen Pharmariesen stehen.
Eine Rückholung der Produktion nach Europa würde – neben der verbesserten Versorgungssicherheit – auch das Produktions-Know-how stärken, die heimischen Standorte erhalten und vor allem Arbeitsplätze sichern.
Aufbau eines Depots für Krisenzeiten
Wenn man die jetzige Krise bedenkt, dann kann man auch darüber nachdenken, dass die Bundesregierung für die wichtigsten Arzneimittel ein großes Depot schaffen sollte. Die Bundeswehr hat so etwas aufgebaut für die Versorgung ihrer Truppen in Krisenzeiten, aber es wäre auch für die Ausstattung von Krankenhäusern und insbesondere von Intensivstationen notwendig.
Wichtig wäre hier, dass man über die Mindesthaltbarkeit nachdenkt. Diese ist zumeist viel länger als die Standardregel von fünf Jahren, wie wir kürzlich 2019 hier in der DAZ [6] und in einer Übersicht mit dem wissenschaftlichen Hintergrund [7] dargestellt haben. Ein beredtes Beispiel ist die Verlängerung des Haltbarkeitsdatums von Oseltamivir (Tamiflu®) 2009 vor dem Hintergrund der Verknappung während der Vogelgrippe, die zu einer Pandemie zu werden drohte.
Hier gibt es ohnehin ein allgemeines Problem, nämlich dass für „stock pilling“ andere Maßstäbe bezogen auf die Stabilität anzuwenden wären. Die österreichische Zulassungsbehörde AGES überlegt, genau solche Ausnahmeregelungen basierend auf „Real-time-Stability-Daten“ zu etablieren. Auch in Amerika werden immer wieder Haltbarkeitslaufzeiten verlängert [6, 7].
Ruf nach europäischer Wirkstoffproduktion – ernst gemeint?
Sicher denken viele im Augenblick über eine zusätzliche Produktion von wichtigen Arzneimitteln in Europa nach. In diesem Artikel haben wir versucht aufzuzeigen, dass die zusätzlichen Kosten überschaubar scheinen, da die Produktion von kleinen Molekülen häufig nicht so teuer ist. Jedoch muss man im Blick haben, dass ggf. wichtige Ausgangsmaterialien auf dem europäischen Markt fehlen und eventuell in China gekauft werden müssen. Das steht einer Unabhängigkeit der Produktion von anderen Ländern entgegen.
Europäische Produktionskapazitäten sind noch genügend vorhanden, eine kostentragende Nutzung muss aber sichergestellt werden, damit diese auch in Zukunft reaktiviert und wieder genutzt werden können, um konkurrenzfähig im europäischen Markt auch bestehen zu können. Initiativen der großen Pharmariesen, diese europäische Kapazität wieder herzustellen, müssen aber auch sehr kritisch beobachtet werden, da durch eine starke Konzentration der Kapazitäten in einer Hand sehr leicht neue Abhängigkeiten entstehen können. Hier muss Europa weiterhin auf die europäische Vielfalt setzen und auch europaweit solche Produktionskapazitäten fördern.
Für eine zukünftige Produktion in Europa muss es auch eine deutliche Erleichterung der regulatorischen Hürden geben, damit europäische Hersteller eine Chance haben können. Es muss also auch der politische Wille vorhanden sein, sich zumindest in Teilen von der Abhängigkeit von asiatischen Staaten zu befreien und auch dafür zu bezahlen. |
Literatur
[1] file:///D:/Dokumente/PAPER/Lieferengpässe%20Corona/versorgungsrelevante%20API.pdf
[2] https://www.deutsche-apotheker-zeitung.de/news/artikel/2020/03/04/indien-stoppt-arzneimittel-export
[3] https://www.pharma-fakten.de/news/details/758-gkv-ausgabenanteil-fuer-arzneimittel-ruecklaeufig/
[4] Arzneiverordnungs-Report 2019, Schwabe U, Paffrath D, Ludwig WD, Klauber J (Hrsg.). Springer-Verlag GmbH, Deutschland, 2019
[5] https://www.pharmacompass.com/active-pharmaceutical-ingredients/metoprolol-succinate
[6] Zilker M, Holzgrabe U, Sörgel F, Überraschend stabil – Analyse von Altarzneien lässt auf deutlich längere Haltbarkeiten schließen. Deutsche Apotheker-Zeitung 2019 (159); 1646-1653
[7] Zilker M, Sörgel F, Holzgrabe U, A systematic review of the stability of finished pharmaceutical products and drug substances beyond their labeled expiry dates. J. Pharm. Biomed. Anal. 2019 (166); 222-235
[8] https://www.ema.europa.eu/en/human-regulatory/post-authorisation/variations
Weitere Beiträge des Pandemie Spezial in DAZ 2020, Nr. 18
- Tatsächlich hygienisch?
- Hinter (bunten) Masken
- Mut zur Maske
- So verwendet man Masken korrekt
- Apotheken auf Achterbahnfahrt
- Wertvolles Apothekensystem unterstützen
- „Testen, testen, testen“
- Mit Spermidin gegen Corona?
- PEI gibt grünes Licht
- Verschwundene Studie sorgt für Aufregung
- Weit mehr als eine Lungenerkrankung
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.