
- DAZ.online
- DAZ / AZ
- DAZ 1-2/2020
- Totgesagte leben länger
Arzneimittel und Therapie
Totgesagte leben länger
Aducanumab gibt sich im Kampf gegen Alzheimer nicht geschlagen
Die beiden parallel verlaufenden Zwillingsstudien Emerge und Engage sollten den Beweis erbringen, dass Aducanumab bei Patienten mit Alzheimer im frühen Stadium wirksam und sicher ist. Jedoch prognostizierten die Ergebnisse einer vorangegangenen Futility-Analyse – durchgeführt von einem unabhängigen Datenprüfkommitee –, dass beide Studien ihren primären Endpunkt sehr wahrscheinlich nicht erreichen werden (s. Kasten).
Biogen und Esai verkündeten daraufhin am 21. März 2019 das Ende der beiden Phase-III-Studien [1]. Und somit auch das Ende des so hoffnungsvoll erwarteten Antikörpers.
Futility-Analyse
In einer Futility-Analyse werden verschiedene statistische Methoden zur Beurteilung der Erfolgsaussichten angewendet. Solche Zwischenauswertungen sind mittlerweile gängige Praxis. Der Begriff „futility“ kann sinngemäß mit „Sinnlosigkeit“ oder „Vergeblichkeit“ übersetzt werden. Gemeint ist damit, dass die zuvor gesetzten Ziele einer klinischen Studie nicht zu erreichen sind. Insbesondere wenn die Zwischenergebnisse darauf hindeuten, dass statistische Signifikanz wahrscheinlich nicht nachgewiesen werden kann, lassen sich durch die vorzeitige Beendigung einer klinischen Studie zum Teil erhebliche Ressourcen einsparen. Ressourcen, die für vielversprechendere Forschung eingesetzt werden könnten. Hier hinein spielen natürlich auch ethische Überlegungen: Ist es ethisch vertretbar, eine aussichtslose Studie fortzuführen? [5]
Emerge und Engage – das doppelte Lottchen
Aducanumab war mit dem Ziel entwickelt worden, die kognitiven und funktionellen Beeinträchtigungen bei Alzheimer-Patienten zu verlangsamen. Der monoklonale Antikörper bindet die für Morbus Alzheimer charakteristischen Ablagerungen und Oligomere von fibrillärem beta-Amyloid. Im Tiermodell konnte so das Fortschreiten der Erkrankung verhindert werden [3]. Die ersten Studien waren vielversprechend, Aducanumab erwies sich als sicher. So starteten im Sommer 2015 dann auch die beiden randomisierten, placebokontrollierten Doppelblindstudien Emerge und Engage. In die Emerge-Studie wurden 1638 Patienten mit Alzheimer im frühen Stadium eingeschlossen, in der Engage-Studie waren es 1647. Insgesamt nahmen an den beiden Phase-III-Studien 3285 Patienten im Alter von 50 bis 85 Jahren aus 20 verschiedenen Ländern teil. Zwei Dosierungsschemata wurden über 78 Wochen gegen Placebo getestet: eine niedrige Dosierung (titriert auf 3 mg/kg oder 6 mg/kg Körpergewicht [KG]) versus eine hohe Dosierung (titriert auf 6 mg/kg KG oder 10 mg/kg KG). Die Infusion wurde einmal pro Monat verabreicht. Primärer Endpunkt in beiden Studien war eine Verbesserung im Clinical Dementia Rating – Sum of Boxes (CDR-SB) Score nach 18 Monaten [4].
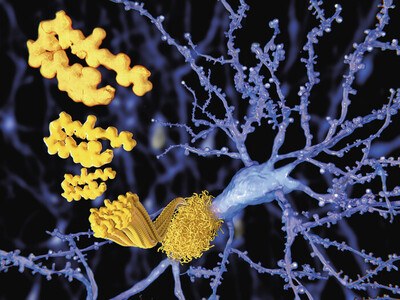
Amyloid-Plaques sind ein charakteristisches Merkmal der Alzheimer-Erkrankung: Der Antikörper Aducanumab reduziert die Peptid-Ablagerungen im Gehirn.
Dann die ernüchternden Ergebnisse der Futility-Analyse, die zum Stopp der beiden Studien führen sollten. Beide Studien, so hieß es, würden ihren primären Endpunkt bis zum Studienende wahrscheinlich nicht erreichen. Biogen und Esai betonten, dass Sicherheitsbedenken bei der Entscheidung zum Studienabbruch keine Rolle spielten [1]. Für die Futility-Analyse wurden OTC-Daten (Opportunity to complete) von 1748 Patienten verwendet, die bis dato (Stand: 26. Dezember 2018) das offizielle Studienende nach 78 Wochen erreicht hatten [2].
Im Oktober 2019, nur wenige Monate später, tauchte eine neue Analyse mit einem erweiterten Datensatz auf: Berücksichtigt wurden dabei nicht nur die Daten der OTC-Population mit 2066 Patienten (Stand: 20. März 2019), sondern auch die bis zum Zeitpunkt des Studienabbruchs gesammelten Daten aller eingeschlossenen 3285 Patienten (Intent-to-Treat-Population). Diese Ergebnisse brachten dann die große Wende: In der Emerge-Studie war der Unterschied im primären Endpunkt nun doch signifikant. Die Engage-Studie entpuppte sich währenddessen als „böser“ Zwilling. Die Ergebnisse aus Engage konnten die positiven Beobachtungen aus Emerge nicht in Gänze stützen. Angaben von Biogen und Esai zufolge soll eine Subgruppenanalyse innerhalb der Engage-Studienpopulation jedoch zu den gleichen Ergebnissen wie in der Emerge-Studie kommen. Es heißt, dass bei jenen Patienten der Engage-Studie, deren kumulative Dosis von Aducanumab hoch genug gewesen sei, die klinische Wirksamkeit des Antikörpers nachgewiesen werden konnte [2].
Nachgefragt
Wie ist die Neubewertung des Antikörpers Aducanumab für die Alzheimertherapie einzuschätzen?
„Die jetzigen Ergebnisse der Emerge-Studie belegen zum ersten Mal einen positiven Effekt der Immuntherapie auf die mentale Leistung von Patienten mit der Alzheimer-Krankheit. Das ist eine Zäsur in der seit 20 Jahren laufenden Immuntherapieforschung. Es ist jedoch noch nicht möglich, vollständig zu bewerten, was die Studienergebnisse für die Zulassung des Medikaments zur Behandlung von Alzheimerkranken bedeuten. Den Studienerfolg muss man vor dem Hintergrund einordnen, dass die Studie vorzeitig aufgrund einer Interimsanalyse abgebrochen wurde. Der jetzige Datensatz ist somit kleiner als geplant. Auch ist die klinische Bedeutsamkeit des statistisch ermittelten Behandlungseffekts zum jetzigen Zeitpunkt noch unklar. Zu beachten ist zudem, dass die Ergebnisse der Emerge-Studie in einer Parallelstudie nur teilweise, das heißt in Subgruppenanalysen, bestätigt werden konnten. Wir fordern daher die rasche vollständige Veröffentlichung der Daten.“ [6]
Prof. Dr. Michael Ewers, Brain Imaging and Biomarker, Institut für Schlaganfall- und Demenzforschung (ISD) des Klinikums der Ludwig-Maximilians-Universität München
Viel hilft viel: die Endpunkte wurden doch noch erreicht
Die Ergebnisse der Emerge-Studie zeigten bei Patienten, die Aducanumab in hoher Dosierung erhalten hatten, nach 78 Wochen eine signifikante Reduktion der klinischen Verschlechterung im CDR-SB-Score um 23% gegenüber Placebo (p = 0,01). Auch in den sekundären Endpunkten waren die Ergebnisse in jenem Studienarm, in dem der Antikörper in hoher Dosierung infundiert worden war, überzeugend: In der Mini-Mental State Examination (MMSE; 15% vs. Placebo, p = 0,06), der AD Assessment Scale – Cognitive Subscale 13 Items (ADAS-Cog-13; 27% vs. Placebo, p = 0,01) und im AD Cooperative Study-Activites of Daily Living Inventory Mild Cognitive Impairment (ADCS-ADL-MCI; 40% vs. Placebo, p = 0,001) wurden Verbesserungen beobachtet. In den bildgebenden Tests stellte man bei den Teilnehmern der Emerge-Studie unter Aducanumab eine Reduktion der Amyloid-Plaque-Ablagerungen fest. Die Amyloid-Plaque-Last war unter beiden Dosierungen im Vergleich zu Placebo nach 26 und 78 Wochen deutlich reduziert (p < 0,001). „Dieser große Datensatz zeigt zum ersten Mal, dass in einer Phase-III-Studie nachgewiesen wurde, dass das Entfernen von aggregiertem Amyloid-Beta zu einem klinischen Rückgang der Alzheimer-Krankheit führen kann, was der Fachöffentlichkeit, den Patienten und ihren Familien neue Hoffnung gibt“, sagte der Studienleiter von Emerge und Engage, Professor Anton Porsteinsson, University of Rochester, USA [2].
Nachgefragt
Wie wirkt Aducanumab – und wie kann man diesen Wirkstoff in die derzeitige Alzheimer-Forschung einordnen?
„Die Anwendung von Aducanumab basiert auf der Annahme, dass Amyloid-Plaques, die sich im Gehirn ablagern und Nervenzellen zerstören, die Ursache für die Alzheimer-Erkrankung sind. Antikörper wie Aducanumab binden an die Amyloid-Plaques im Gehirn der Alzheimerpatienten. Damit wird eine Immunantwort des Gehirns stimuliert, und Fresszellen entfernen recht effizient die Plaques. Mit bildgebenden Verfahren konnte in der Emerge-Studie sehr schön gezeigt werden, dass umso mehr Plaques entfernt wurden, je mehr Antikörper die Patienten erhielten. Immer wieder wird angezweifelt, dass das Amyloid der Plaques wirklich der Auslöser der Erkrankung ist, obwohl hieb- und stichfeste humangenetische Daten vorliegen. Der dosisabhängige Abbau von Amyloid-Plaques, mit dem eine Stabilisierung des Gedächtnisses einhergeht, würde endgültig die Diskussion um die Ursache der Erkrankung beenden.“ [6]
Prof. Dr. Christian Haass, Biomedizinisches Centrum (BMC), Biochemie, Ludwig-Maximilians-Universität München & Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
Hohe Dosis, viele Nebenwirkungen?
Stellt sich noch die Frage nach dem Sicherheitsprofil von Aducanumab. „Es erstaunt […], dass die Diskussion um die Nebenwirkungen des Antikörpers nun vom Tisch sein soll. Denn gerade in der hohen Dosierung von Aducanumab, die den therapeutischen Vorteil bringen soll, traten in vorhergehenden Studien Nebenwirkungen auf.“ so Prof. Dr. Richard Dodel, Neurologe und Experte der Deutschen Gesellschaft für Neurologie, in einem Interview des Deutschen Ärzteblatts [3]. Mittlerweile haben Biogen und Esai im Dezember 2019 auf dem Clinical Trials on Alzheimer’s Disease (CTAD) Kongress in San Diego hierzu konkrete Zahlen veröffentlicht [4]. In Emerge wurde unter der niedrigen Dosierung bei 477 Patienten (87,7%) von einem unerwünschten Ereignis berichtet, unter der hohen Dosierung bei 505 (92,3%) und unter Placebo bei 476 (87,0%) Patienten. Der Anteil der unerwünschten Ereignisse nahm mit steigender Dosierung zu. Jedoch kam es aufgrund der höheren Dosierung nicht, wie vielleicht erwartet, auch zu mehr schwerwiegenden unerwünschten Ereignissen: Unter der niedrigen Dosierung waren 69 von 544 Patienten betroffen, unter der hohen Dosierung 66 und unter Placebo 77 von je 547 Studienteilnehmern. Die zwei häufigsten unerwünschten Ereignisse waren Hirnödeme – sogenannte Amyloid-related Imaging Abnormality Edema (ARIA-E) – und Kopfschmerzen. ARIA‑E traten bei 25,7% der Patienten unter der niedrigen Aducanumab-Dosierung auf und bei 34,0% der Patienten mit hoher Dosierung – unter Placebo waren es hingegen nur 2,2%. Patienten, die ARIA-E entwickelten, klagten über Kopfschmerzen, Schwindel, Sehstörungen, Übelkeit und Erbrechen. In der Regel entwickelten sich die Hirnödeme jedoch innerhalb von vier bis 16 Wochen ohne Folgeschäden zurück, und der Großteil der Patienten konnte die Studie fortsetzen. Auch kleinere Hirnblutungen (ARIA-H) wurden unter Aducanumab häufiger beobachtet als unter Placebo – und zwar bei 16,2% (niedrige Dosierung) bzw. 18,6% (hohe Dosierung) der Patienten vs. 6,9% unter Placebo. Aufgrund von ARIA brachen in den Aducanumab-Gruppen mehr Patienten die Studie ab als in der Placebo-Gruppe (4,6% und 6,6% vs. 0,2%). In Engage zeigte sich ein ähnliches Sicherheitsprofil.
Nachgefragt
Welche Patienten profitieren von Aducanumab – und welche nicht?
„Bisherige Studien legen nahe, dass das Prinzip der passiven Impfung mit Antikörpern gegen Amyloid vermutlich in frühen Krankheitsstadien – wahrscheinlich am besten bei leichten Gedächtnisstörungen, vor Ausbruch der Demenz – klinisch wirksam ist. Daher wurden auch nur leichtgradig erkrankte Patienten in die Zulassungsstudien eingeschlossen. Im Rahmen der Emerge-Studie waren über 40 Ausschlusskriterien definiert. Für die Anwendung außerhalb von Studien ist wohl am wichtigsten, dass nur Patienten die Substanz erhalten durften, bei denen MRTs gemacht werden konnten und die – bis auf niedrig dosiertes ASS – keine Blutverdünnung erhielten.“ [6]
Wie sieht es mit Nebenwirkungen aus?
„Alle Antikörper gegen Amyloid können zu Nebenwirkungen wie Hirnblutungen und Wassereinlagerungen im Gehirn führen. Bei den Studien waren diese Nebenwirkungen oft nur auf MRT-Gehirnaufnahmen erkennbar, die meisten Patienten zeigten keine Symptome. Abhängig vom MRT-Befund durfte das Präparat weiter verabreicht werden oder wurde gestoppt. In den Studien wurden bei den Patienten in 1,5 Jahren sieben MRT-Untersuchungen gemacht, im Falle von Nebenwirkungen zusätzlich alle zwei bis vier Wochen. Das macht den Einsatz von Aducanumab im Alltag kompliziert. Eine Studie zur Anwendung der Substanz unter Alltagsbedingungen wurde leider ebenfalls im Frühjahr 2019 gestoppt. Diese Informationen fehlen uns nun.“ [6]
Wie geht es für Patienten in und außerhalb der Studien weiter?
„Es ist eine Wiederaufnahme der Studie geplant („Re-Dosing“). Patienten der abgebrochenen Studien sollen die Möglichkeit bekommen, wieder Aducanumab zu erhalten. Das bedeutet eine Studie mit allen dafür erforderlichen regulatorischen und formalen Abläufen. In Deutschland ist mit einer Wiederaufnahme der Behandlung in Studien nicht vor dem Frühsommer 2020 zu rechnen. Patienten außerhalb der Studien müssen abwarten, ob – und falls ja, für welche Patienten – Aducanumab als Wirkstoff in Deutschland zugelassen wird. Wie lange es bis dahin dauert, ist schwer abzuschätzen. In Europa hat Biogen bisher noch kein Prüfverfahren beantragt.“ [6]
Priv.-Doz. Dr. Katharina Bürger, Oberärztin der Gedächtnisambulanz und Leiterin der Aducanumab-Studie „Emerge“ am Institut für Schlaganfall- und Demenzforschung (ISD), München
Wie geht es weiter?
In der Pressemitteilung vom 22. Oktober 2019 verkünden Biogen und Esai, dass geplant sei, zunächst all jenen Patienten aus vorangegangen und zuvor geplanten Studien, die für eine Behandlung mit Aducanumab infrage kommen, den Zugang zur Therapie zu ermöglichen. In Zusammenarbeit mit den Aufsichtsbehörden und den Studienleitern soll mit Dringlichkeit auf dieses Ziel hingearbeitet werden. „Es besteht ein enormer medizinischer Bedarf, und die Alzheimer-Gemeinschaft hat auf diesen Moment gewartet. Ich empfehle Biogen, der FDA, der Fachöffentlichkeit, den Patienten und ihren Studienpartnern, dass sie hartnäckig daran arbeiten, die heutige Ankündigung Wirklichkeit werden zu lassen.“, so Porsteinsson [2]. Anfang 2020 soll nun eine Biologics License Application (BLA) mit Daten aus den Phase-I- und Phase-Ib-Studien sowie dem vollständigen Datensatz aus den beiden Phase-III-Studien bei der US-amerikanischen Food and Drug Administration (FDA) eingereicht werden. Die Gespräche mit den Aufsichtsbehörden der internationalen Märkte, inklusive Europa und Japan, sollen weiter vorangetrieben werden. „Angesichts einer so verheerenden Krankheit, von der weltweit mehrere zehn Millionen Menschen betroffen sind, ist die heutige Ankündigung im Kampf gegen Alzheimer wirklich ermutigend. […] Wir sind zuversichtlich, Patienten die erste Therapie anbieten zu können, mit der die klinische Verschlechterung der Alzheimer-Krankheit verringert werden kann, und hoffnungsvoll, dass sich diese Ergebnisse auf ähnliche Therapieansätze, die auf Amyloid-Beta gerichtet sind, auswirken werden“, sagt Michael Vounatsos, Vorstandsvorsitzender von Biogen [2].
Nachgefragt
Welches sind die offenen Fragen bezüglich der Anwendung von Aducanumab?
„Selbst wenn Aducanumab zu einer deutlichen Verlangsamung des Gedächtnisverlustes führen sollte, ist heute unklar, wie die notwendigen, gewaltigen Mengen dieses Antikörpers zu einem vernünftigen Preis hergestellt werden können. Auch gibt es Nebenwirkungen, die man noch nicht ganz im Griff hat. Zudem gilt es, noch genauere biologische Definitionen zu finden, welche Patienten profitieren und wie häufig über welchen Zeitraum Aducanumab zu verabreichen ist: zum Beispiel ob eine Dauertherapie erforderlich ist oder ob Therapiezyklen ausreichen.“ [6]
Gibt es derzeit vielversprechende Alternativen?
„In der Alzheimerforschung gibt es weitere Ansätze mit sehr ähnlichen Antikörpern, auch Antikörper gegen andere Veränderungen bei Alzheimer, zum Beispiel gegen Tau-Protein oder zur Modulation von Immunzellen. Davon liegen aber noch keine Auswertungen vor. Direkt klinisch einsetzbare Alternativen gibt es also im Moment nicht.“ [6]
Prof. Dr. Stefan Lichtenthaler, Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE), München
Literatur
[1] Biogen und Eisai brechen Phase-III-Studien ENGAGE und EMERGE zu Aducanumab bei Alzheimer-Krankheit ab. Pressemitteilung vom 21. März 2019. www.biogen.de
[2] Biogen plant Zulassungsantrag für Aducanumab bei Alzheimer auf der Grundlage einer neuen Analyse eines größeren Datensatzes aus Phase-3-Studien. Pressemitteilung vom 22. Oktober 2019. www.biogen.de
[3] Zylka-Menhorn V, Grunert D. Alzheimer-Wirkstoff Aducanumab: Erstaunliche Kehrtwende. Dtsch Arztebl 2019; 116(44): A-2014/B-1650/C-1616. www.aerzteblatt.de
[4] Budd Haeberlein S et al. EMERGE and ENGAGE Topline Results: Two Phase 3 Studies to Evaluate Aducanumab in Patients With Early Alzheimer’s Disease. Clinical Trials on Alzheimer’s Disease (CTAD) Congress, San Diego, USA. Präsentation vom 05. Dezember 2019. https://investors.biogen.com
[5] Snapinn, S et al. Assessment of futility in clinical trials. Pharmaceutical Statistics 2006;5(4):273-281
[6] Pressemitteilungen der Ludwig-Maximilians-Universität München vom 6. Dezember 2019

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.